Слайд 1СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ХИМИЯ урана и
нептуния
Слайд 2СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
УРАН
Открыт в 1789 немецким химиком М.
Г. Клапротом и назван в честь планеты Уран, металлический уран
получил Э. Пелиго в 1841.Первоначально уран считали элементом со степенью окисления +3 и приписывали атомную массу 120. В 1871 г. Д. И. Менделеев пришёл к выводу, что эту величину надо удвоить.
Природный уран состоит из смеси трёх изотопов: 238U — 99,2739 %, (T1/2 = 4,51×109 лет), 235U — 0,7024 % (T1/2 = 7,13×108 лет) и 234U — 0,0057 % (T1/2 = 2,48×105 лет). Стабильных изотопов не имеет. Известно 16 изотопов с массовыми числами 226-240, 242; наиболее долгоживущие изотопы 234U (Т1/2 =2,45·105 лет, α-излучатель), 235U (T1/2 =7,04·108 лет, α-излучатель) - родоначальник радиоактивного ряда (4n + 3) и 238U (Т1/2=4,47·109 лет, α -излучатель)- родоначальник радиоактивного ряда (4n + 2). Среднее содержание урана в земной коре (кларк) 2,5×10-4% по массе (38-е место по распространенности, урана на Земле больше, чем серебра, висмута, ртути )
В 1896 А. Беккерель открыл радиоактивность природного урана. В 1939г. немецкие химики Ган и Штрассман установили деление ядер 235U под действием медленных нейтронов.

Слайд 3СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
УРАН как делящийся материал
Ядра 235U и
233U делятся спонтанно, а также при захвате как медленных (тепловых
0,025 эВ), так и быстрых нейтронов. Ядра 238U делятся при захвате только быстрых нейтронов с энергией не менее 1 Мэв; при захвате медленных нейтронов 238U превращается в 239Pu, ядерные свойства которого близки к 235U. Критическая масса урана (93,5% 235U) в водных растворах составляет менее 1 кг, для открытого шара - около 50 кг (критический радиус 9 см) , для шара с отражателем - 15 - 23 кг; критическая масса 233U - примерно 1/3 критической массы 235U.
Слайд 4СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ОБЩАЯ характеристика химических свойств урана
Конфигурация внешних.
электронных оболочек атома урана 5f36s26p66d17s2. Валентными являются 6d1,7s2, 5f3 электроны.
В соединениях проявляет степени окисления + 3, + 4, + 5, + 6, иногда + 2; устойчивые с.о. - U (IV) и U (VI). Самая устойчивая с.о. U (VI). Электроотрицательность по Полингу 1,22; атомный радиус 0,156 нм, ионные радиусы U3+ 0,1024 нм, U4+ 0,089 нм, U5+ 0,088 нм и U6+ 0,083 нм.
В таблице Менделеева, в 30-х годах, уран помещали в VI группе, поскольку было известно много соединений шестивалентного урана. Сейчас в соответствии с актиноидной гипотезой Сиборга место урана – среди актиноидов, непосредственно под неодимом.
Уран не очень типичный актиноид, известно пять его валентных состояний – от 2+ до 6+. Изучение химических свойств урана осуществляется методами классической химии.
Слайд 5СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
СВОЙСТВА металлического урана
Уран серебристо-белый блестящий металл
реакционноспособный металл. В порошкообразном состоянии металлический уран пирофорен и горит
ярким пламенем.
Ниже 6690C устойчива α-форма с ромбической решеткой, плотн. 19,12 г/см3; в интервале 669-776 0C устойчива β-форма с тетрагон. решеткой, плотн. 18,11 г/см3; выше 776 0C существует -форма с объемноцентрированной кубич. решеткой, плотн. 18,06 г/см3.
С кислородом образует двуокись UO2, трёхокись UO3 и большое число промежуточных окислов, важнейший из которых U3O8. С фтором при 500-600°C образует тетрафторид (зелёные игольчатые кристаллы, малорастворимые в воде и кислотах) и гексафторид UF6 (белое кристаллическое вещество, возгоняющееся без плавления при 56,4°C); При взаимодействии урана с водородом при 220 °С получается гидрид UH3; с азотом при температуре от 450 до 700 °С и атмосферном давлении - нитрид U4N7, медленно реагирует с кипящей водой с образованием UO2 и H2, с водяным паром - в интервале температур 150-250 °С; растворяется в соляной и азотной кислотах, слабо - в концентрированной плавиковой кислоте. Быстро растворяется в соляной и азотной кислотах, медленно - в H2SO4, H3PO4, фтористоводородной кислоте, образуя соли уранила UO22+.

Слайд 6СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
УРАН в растворе - U(III), U(IV)
В водном растворе уран образует ионы со степенями окисления
+3, +4, +5, +6. Степень гидролиза и закомплексованность растет в ряду:
U(V)(UO2+)< U(III)(U3+)< U(VI)(UO22+)< U(IV)(U4+ )
Ионы урана в растворах имеют характерную окраску: U3+ - красную, U4+ -зеленую, UO22 - желтую
U(III) неустойчив в растворах:
2U3+ + 2Н2О <=> 2U4+ + Н2 + 2ОН-
образуется из U4+ под действием сильных восстановителей (например, порошка Zn) или при электрохимическом восстановлении;
U(IV) устойчив в растворах, но сильно гидролизован и гидратирован
U4+ + 2Н2О <=> 2U(ОН)3+ + Н3O+
при этом подобно Th(IV)образуются полимерные комплексы.
U4+ устойчив в отсутствии воздуха, медленно окисляется воздухом до UO22+, образуется в растворах UO22+ под действием восстановителей средней силы (например, Na2S2O6) или электрохимически.
Малорастворимые соединения U(IV) фторид, иодат, оксалат, пирофосфат, гипофосфат, купферонат, гидроокись (носит основной характер).
Слайд 7СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
УРАН в растворе - U(V)
U(V): благодаря
высокому заряду и сравнительно небольшому радиусу U(V) не может существовать
в виде простого иона и в растворе образует диоксикатион ураноил UO2+. Он может быть получен электровосстановлением, восстановлением амальгамой цинка или водородом соединений U(VI).
U(V) малоустойчив, стабилен лишь при рН=2,5, при больших рН идет гидролиз, при большей кислотности – диспропорционирование:
2UO2+ + 4 Н3О+ <=> UO22+ + U4+ + 2Н2О
Кроме того, имеет место гидролиз UO2+. Гидроокись UO2ОН·Н2О амфотерна.
UO2+ устойчив в неводных растворах.
Слайд 8СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
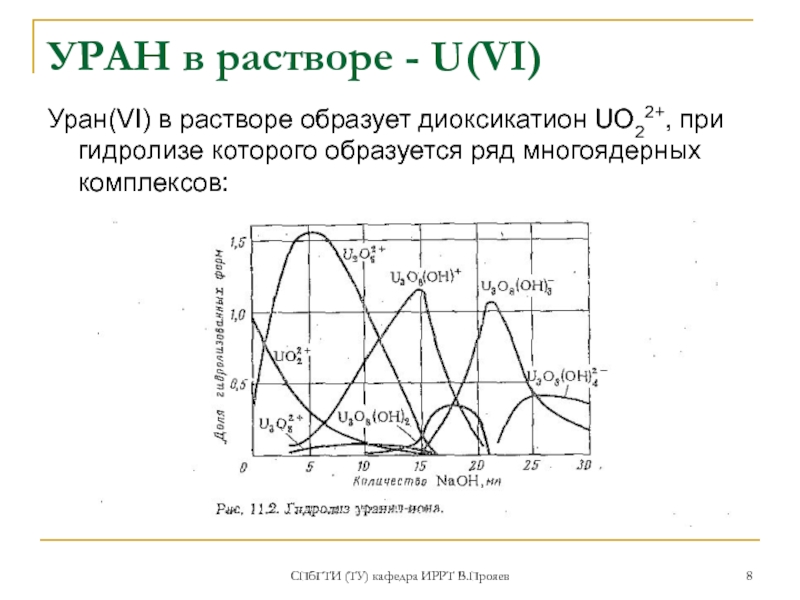
УРАН в растворе - U(VI)
Уран(VI) в
растворе образует диоксикатион UO22+, при гидролизе которого образуется ряд многоядерных
комплексов:
Слайд 9СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
СОЕДИНЕНИЯ U(VI)
Гидроокись уранила UO2(ОН)2 амфотерна
и образует два ряда солей - соли уранила и уранаты.
Соли уранила появляются благодаря основным свойствам гидроокиси уранила и содержат в своем составе ион UO22+. Кроме солей уранила, образованных минеральными и органическими кислотами (уранилформиат, уранилацетат, уранилоксалат и др), известно много двойных солей с металлами в степенях окисления +1 и +2 типа: МеIUО2(NO3)3. Из них важен малорастворимый натрий уранилтриацетат. Малорастворимы также гидрофосфат и гидроарсенат уранила. Уранилнитрат хорошо растворим в воде и многих органических растворителях, что позволяет экстрагировать его из азотнокислых растворов.
Уранаты - соли урановой кислоты - результат кислотной функции гидроокиси уранила. Полиуранаты образуются при действии щелочей или аммиака на UO22+. Уранаты имеют общую формулу МеI2 UO4, состав полиуранатов меняется в зависимости от условий образовании. Диуранаты имеют формулу МеI2 U2O7
Слайд 10СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
КОМПЛЕКСНЫЕ соединения и ионы U4+ и
UO22+
Ион U4+ и ион UO22+ образуют большое количество комплексных
ионов и комплексных соединений. Чем выше положительный заряд нона, тем более он склонен к комплексообразованию. Константы равновесия образования галоген-ионов на порядок ниже констант образования тиоцианатных ионов, а тиоцианатных ионов в свою очередь на порядок ниже сульфатных. С кислотами идет также образование отрицательных ионов, например UIV(С2O4)44-, UIV (SO4)44-, и др.
Комплексные соединения образуются с угольной, винной, лимонной, яблочной, молочной и другими органическими кислотами. Важными являются карбонатные комплексы U4+, которые растворимы: [U(СО3)n(ОН)m]4-2m-n.
Несмотря на большой объем и небольшой заряд уранил-ион также дает большое число комплексных ионов. Это, очевидно, объясняется тем, что лиганды связаны с металлом ковалентными связями
Слайд 114.4.4.3. Извлечение урана из карбонатных растворов
с помощью анионитов
После карбонатного выщелачивания
уран находится в растворе в виде комплексного аниона [UO2(CO3)3]4–. Поскольку
константа устойчивости этого аниона равна 2·1018, т.е. на 15 порядков больше константы устойчивости сульфатных анионных комплексов, то нет смысла говорить о существовании подвижного равновесия между катионом UO 2+ и анионом [, UO2(CO3)3]4– поскольку катион UO 2+ в этих растворах практически отсутствует. Поэтому для извлечения урана из карбонатных растворов можно использовать только аниониты. Выбор анионитов ограничен тем, что в щелочной среде можно использовать только сильноосновные аниониты, работающие при всех значениях рН.
В связи с большим зарядом карбонатного комплексного аниона процесс извлечения урана идет селективно:
4(R4N)Cl + [UO2(CO3)3]4– = (R4N)4[UO2(CO3)3] + 4Cl–.
Однозарядный анион алюмината практически не сорбируется. При избытке соды практически не сорбируются ванадат- и фосфат-ионы. Емкость смолы по урану падает с увеличением избыточной концентрации соды в исходном растворе, что объясняется конкуренцией карбонат-иона:
2(R4N)Cl + CO3 2- = (R4N)2CO3 + 2Cl–
Десорбция урана проводится 2 моль/л раствором NaCl или NaNO3, содержащим 5 г/л Na2CO3. Концентрация урана в товарном регенерате примерно в 50 раз больше, чем в исходном растворе
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев

Слайд 12СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
СРАВНИТЕЛЬНАЯ характеристика степени окисления +6 U,
Np, Pu, Am (1)
Все ураниды в с.о. +6 элементы находятся
в виде ионов MeO22+.
Для урана эта степень окисления является наиболее устойчивой.
Соединения нептуния и плутония могут быть получены при действии сильных окислителей на Np(V) или Pu(IV) и устойчивы в растворах хлорной и соляной кислот. В азотнокислых растворах происходит восстановление соединении шестивалентных нептуния и плутония продуктами радиолиза азотной кислоты.
Америций в степени окисления +6 является очень сильным окислителем. Соединения Am(VI) получаются лишь при действии на Am(III) такого сильного окислителя, как персульфат аммония в присутствии ионов серебра при высоких температурах (85—90° С) и низкой кислотности раствора (с < 0,2 моль/л). Для нептуния и америция в степени окисления +6 в сильнощелочных растворах (с >10 моль/л) возможно протекание реакций диспропорционирования по схеме
2Me(VI) <=> Me(V) + Me(VII).
Среди рассматриваемых элементов в степени окисления +6 наиболее полно изучено химическое поведение U (VI). Уран в этой степени окисления, как и его соседи, проявляет двойственность химических свойств. С одной стороны, наблюдается некоторая аналогия с молибденом и вольфрамом (хотя структура «ильной» группировки MeO22+ для уранидов (U, Np, Pu, Am) линейна в отличие от аналогичной группировки, образуемой вольфрамом). С другой стороны, уран в степени окисления +6 сходен с соседними актиноидными элементами — с нептунием, плутонием и америцием.

Слайд 13СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
СРАВНИТЕЛЬНАЯ характеристика степени окисления +6 U,
Np, Pu, Am (2)
РАСТВОРИМЫЕ СОЕДИНЕНИЯ - все галогениды, нитраты, перхлораты,
сульфаты и многие другие соединения U(VI) —Am(VI) хорошо растворимы (включая фториды, тогда как фториды 3-ех и 4-ех валентных ионов нерастворимы!)
К ТРУДНО РАСТВОРИМЫМ относятся соединения с гидроксид-ионом, а также иодаты, фосфаты, оксалаты, и двойные ацетаты состава Na[MeO2(CH3COO)3] (еще хуже растворимы тройные ацетаты, например, NaZn[MeO2(CH3COO)3]3
Под действием H2O2 уран(VI) образует труднорастворимый пероксид уранила [UO2(OO)(H2O)4]. Поскольку перекись водорода обладает как окислительными, так восстановительными свойствами, она стабилизирует элементы в наиболее устойчивых степенях окисления. Так, например, перекись водорода окисляет U(IV) до U(VI) (далее образуется труднорастворимый пероксид уранила). При взаимодействии нептуния, плутония и америция в степени окисления +6 с пероксидом водорода происходит их восстановление до более устойчивых степеней окисления Np(V), Pu(IV), Am(III), соответственно.
Осадки карбонатов MeO22+ растворимы в избытке осадителя с образованием анионных комплексов
Аналогично, растворимы в избытке осадителя, оксалаты MeO22+, если осадителем не является щавелевая кислота.
В водных растворах диоксиионы MeO22+ подвержены гидролизу с образованием моно- и полиядерных продуктов. Склонность к гидролизу уменьшается в ряду UO22+ > NpO22+ > PuO22+.
Для рассматриваемых элементов в степени окисления +6, несмотря на небольшой заряд и большой размер иона MeO22+ известно значительное число комплексных соединений. Связь металл — лиганд в этих соединениях носит в основном ковалентный характер. Координационное число MeO22+ равно 6.

Слайд 14СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ОПРЕДЕЛЕНИЕ урана
Качественно уран обнаруживают:
-по яркой
желто-зеленой флуоресценции в присутствии NaF под действием УФ излучения;
-по
образованию желтой окраски при добавлении H2O2 к карбонатному раствору или KCNS к кислым растворам;
- по красно-бурой окраске раствора в присутствии ферроцианида К или 8-гидрооксихинолина и др.
Количественно уран определяют:
- гравиметрически в виде U3O8, (UO2)2P2O7 и др.
- титриметрически - в виде U4+ с использованием для титрования KMnO4, K2Cr2O7 и др.
- фотометрически - по собств. окраске ионов.
Субмикрограммовые количества урана·(10-6-10-10 г) определяют люминесцентным методом. Применяют также электрохимический, (полярография, потенциометрия, кулонометрия), радиометрический (уд. α-активность 235U и 238U составляет соотв. 0,08 и 0,012 Бк/мкг), нейтронно-активационный (с использованием нуклидов 239U, 239Np или продуктов деления урана) и атомно-эмиссионный методы анализа.
Слайд 15СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ПРИМЕНЕНИЕ урана
1. Уран – основа ядерного
оружия и ядерной энергетики
2. Другие области применения урана:
- небольшая добавка
урана придаёт красивую жёлто-зелёную флуоресценцию стеклу; уранат натрия Na2U2O7 использовался как жёлтый пигмент в живописи; соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в цвета: жёлтый, бурый, зелёный и чёрный, в зависимости от степени окисления);
- обеднённый уран: оставшийся после обогащения природный уран (в основном - 238U) носит название «обеднённый уран». Обеднённый уран в два раза менее радиоактивен, чем природный уран. В основном его использование связано с большой плотностью урана (балластный материал в летательных аппаратах, гироскопах, маховиках, гоночных яхтах и т.п.) Сплавы железа и обедненного урана применяются как мощные магнитострикционные материалы. Обеднённый уран используется для радиационной защиты.
Самое известное применение обеднённого урана — в качестве сердечников для бронебойных снарядов.
Слайд 16СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ПРИМЕНЕНИЕ обедненного урана
Наконечник (вкладыш) снаряда калибра
30мм (пушки GAU-8 самолёта A-10) диаметром около 20 мм из обеднённого
урана.
При сплавлении с 2 % Mo или 0,75 % Ti и термической обработке (быстрая закалка разогретого до 850 °C металла в воде или масле, дальнейшее выдерживание при 450 °C 5 часов) металлический уран становится твёрже и прочнее стали (прочность на разрыв больше 1600 МПа, при том, что у чистого урана она равна 450 МПа). В сочетании с большой плотностью, это делает закалённую урановую болванку чрезвычайно эффективным средством для пробивания брони, аналогичным по эффективности более дорогому вольфраму. Тяжёлый урановый наконечник также выравнивает распределение масс в снаряде, улучшая его аэродинамику. Около 300 тонн обедненного урана остались на поле боя во время операции «Буря в Пустыне». Такие снаряды были использованы войсками НАТО в боевых действиях на территории Югославии. После их применения обсуждалась экологическая проблема радиационного загрязнения территории страны. Обеднённый уран используется в современной танковой броне, например, танка M-1 «Абрамс»

Слайд 17СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
УРАНОВЫЕ часы
В 1904 г. Эрнест Резерфорд обратил
внимание на то, что возраст Земли и древнейших минералов –
величина того же порядка, что и период полураспада урана и предложил определять возраст минералов по соотношению количеств гелия и урана, содержащихся в плотной породе.
Поскольку атомы гелия легко диффундируют вблизи материнских урановых ядер остается значительно меньше гелия, чем следует по законам радиоактивного распада. Поэтому более надежно возраст пород вычислять по соотношению урана и радиогенного свинца – конечного продукта распада урановых ядер. Этот метод называют «урановыми часами».
Урано-свинцовым способом измерен возраст древнейших минералов, а по возрасту метеоритов определили дату рождения планеты Земля.
Слайд 18СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
Слайд 19СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
НЕПТУНИЙ
Впервые получен Э. Макмилланом и Ф.
Эйблсоном в 1940.
Стабильных изотопов не имеет. Известно 15 изотопов с
масcовыми числами 227-241. Наиболее долгоживущий изотоп 237Nр (Т1/2 2,14.106 лет, α-излучатель), являющийся родоначальником четвертого радиоактивного ряда. В природе встречается в ничтожных количествах в урановых рудах. Образуется из ядер урана под действием нейтронов космического излучения и нейтронов спонтанного деления 238U.
Слайд 20СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
ОБЩАЯ характеристика химических свойств Nр
Конфигурация
внешних электронных оболочек атома 5f46s26p66d17s2; степени окисления +3, +4, +
5 (наиб. устойчива), +6, +7; ат. радиус 0,155 нм, ионные радиусы Np3+ 0.0986 нм, Np4+ 0,0913 нм, Np5+ 0,087 нм, Np6+ 0,082 нм.
Свойства металлического Nр. Нептуний - хрупкий серебристо-белый металл. Известен в трех полиморфных модификациях: ниже 280 °С устойчива α-форма с орторомбической решеткой; в интервале 280-576 °С устойчива β-форма с тетрагональной решеткой; выше 576 °С существует модификация с кубической гранецентрированной решеткой.
Весьма реакционноспособен, растворяется в разбавленной НСl с образованием ионов Np3+ в присут. восстановителей или Np4+ в присутствии воздуха. При нагревании в атмосфере Н2 образуются гидриды
Окислы. Известны два окисла – NpO2, Np2O5. Oкисел нептуния в степени окисления шесть в отличие от урана не получен. Большая устойчивость нептуния и в низших степенях окисления по сравнению с ураном проявляется в том, что при прокаливании на воздухе солей кислородных кислот любых степеней окисления образуется NpO2. Двуокиси нептуния отвечает - основная гидроокись Np(ОН)4, которая образуется при действии щелочей на соединения в растворе. Известны амфотерные гидроокиси Np(V) и Np(VI) NpO2(ОН) и NpO2(ОН)2. При озонировании суспензии гидроокиси Np образуется NpO3 2Н2О . При этом происходит частичное окисление нептуния до степени окисления +7.

Слайд 21СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
НЕПТУНИЙ в водных растворах
В водных растворах
Np. может существовать в степенях окисления от +3 до +7.
При окислении Np(VI) озоном в щелочной среде образуется Np(VII). Ионы Np. в растворе склонны к гидролизу и комплексообразованию. В слабокислых р-рах существуют ионы [Np(H2O)8]3+, [NpO2(H2O)6] + и [NpO2(H2O)6]2+. Ионы Н. в р-рах имеют характерную окраску: Np3+ -фиолетово-голубую, Np4+-желто-зеленую, NpO2+-зелено-голубую, NpO22+-розовую и NpO23+ -зеленую в щелочных р-рах и коричневую в р-ре НСlО4. По способности к комплек-сообразованию ионы Н. располагаются в ряд: Np4+ > > NpO22+ > Np3+ > NpO2+ > NpO23+ . Ионы Н. склонны к диспропорционированию в зависимости от кислотности и состава среды, на их хим. поведение в целом влияют продукты радиолиза р-ров, образующиеся под действием собств. излучения Н.
Слайд 22СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
СРАВНИТЕЛЬНАЯ характеристика степени окисления +5 U,
Np, Pu, Am (1)
Степень окисления +5. В этой степени окисления
все рассматриваемые элементы существуют в форме диоксиионов состава МеО2+ Наиболее устойчива эта степень окисления для нептуния, для которого диспропорционирование по схеме
2NpO2+ + 4H+ ↔ Np4+ + NpO2 2++ 2H2O
протекает только в сильнокислых растворах.
U(V) в форме иона UO+2 устойчив в узком интервале кислотности при рН 2,5. Область существования этой формы для плутония несколько шире рН(2¸6). В более кислых растворах U(V) и Pu(V) быстро диспропорционируют с образованием Me(IV) и Me(VI). Изучение реакций диспропорционирования Am(V) осложняется авторадиолизом, приводящим, в частности, к самовосстановлению Am(V) и Am(VI). Наблюдаемая реакция диспропорционирования Am(V) отвечает уравнению
3AmO+2 + 4H+ ↔ 2AmO2+2 + Am3+ + 2H2O.
Образование Am3+ объясняется крайней неустойчивостью в водных растворах Am(IV).
Слайд 23СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
СРАВНИТЕЛЬНАЯ характеристика степени окисления +5 U,
Np, Pu, Am (2)
Ионная форма существования всех рассматриваемых элементов в
степени окисления +5 (однозарядный ион МеО2+ большого радиуса) предопределяет их химические свойства в этой степени окисления — малую склонность к гидролизу и комплексообразованию. Получены комплексные соединения Np(V) с F-, СН3СОО- и CO32-. Из них представляют определенный интерес труднорастворимые двойные карбонаты состава К3[МеО2(СО3)2], где Me = Np, Pu, Am.
По свойствам диоксиион МеО2+ проявляет большую аналогию с МеО22+ чем с Me+. Это выражается в одинаковых типах химической связи и геометрии комплексных соединений, образуемых диоксиионами.
В отличие от комплексов, образуемых рассматриваемыми элементами в степенях окисления +3 и +4, для диоксиионов не наблюдается определенной закономерности в устойчивости образуемых ими комплектов при изменении атомного номера элемента. В зависимости от типа лиганда может наблюдаться как уменьшение, так и возрастание устойчивости образующихся комплексных соединений в ряду уран — америций.