Слайд 1Специфіка полімерної будови речовини
Специфіка фізико-хімічних властивостей полімерів у значній
мірі визначається їхньою макромолекулярною будовою. Визначальну роль у зв'язку властивостей
і будови полімерів грає гнучкість ланцюга макромолекули.
Гнучкість ланцюга - це її здатність змінювати форму під впливом теплового руху ланок або під дією зовнішніх силових полів.
Дослідження природи гнучкості макроланцюга варто почати з розгляду окремих мономерних груп, її складових.
Слайд 2Внутрішнє обертання в макромолекулах
Найпростішим прикладом насиченого вуглеводної ланки полімеру
може служити молекула етану - С2Н6 . У ній атоми
вуглецю та водню з'єднані ковалентними зв'язками з утворенням так званого s-зв'язку. Валентний кут між σ-зв'язками становить 109°28’. У просторі така молекула має структуру тетраедра.
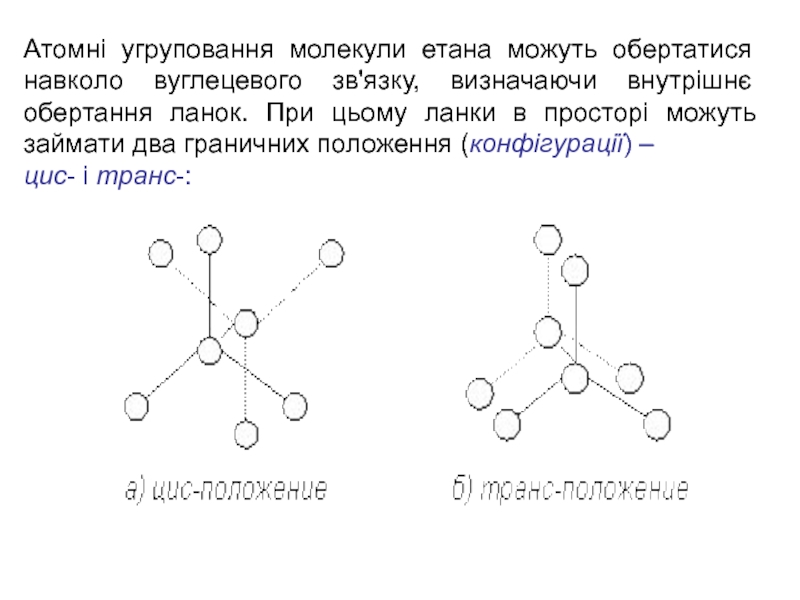
Слайд 3Атомні угруповання молекули етана можуть обертатися навколо вуглецевого зв'язку, визначаючи
внутрішнє обертання ланок. При цьому ланки в просторі можуть займати
два граничних положення (конфігурації) –
цис- і транс-:
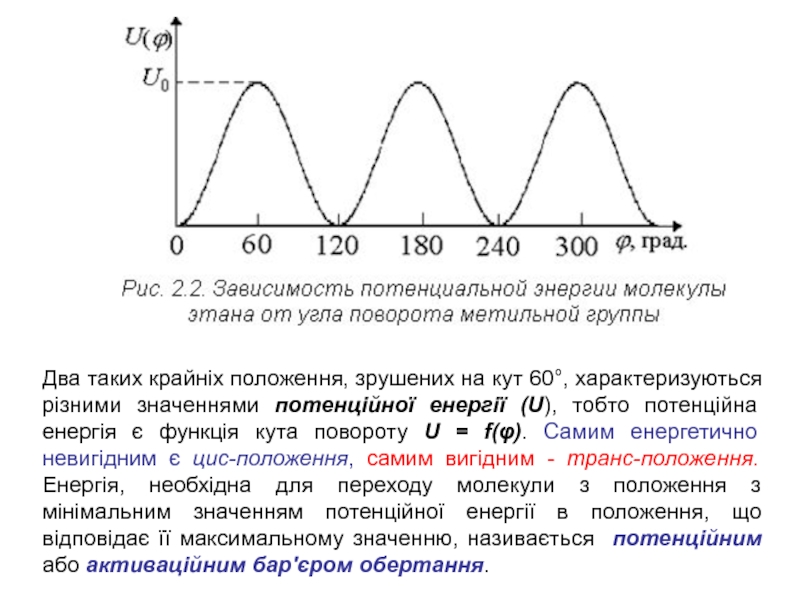
Слайд 4Два таких крайніх положення, зрушених на кут 60°, характеризуються різними
значеннями потенційної енергії (U), тобто потенційна енергія є функція кута
повороту U = f(φ). Самим енергетично невигідним є цис-положення, самим вигідним - транс-положення. Енергія, необхідна для переходу молекули з положення з мінімальним значенням потенційної енергії в положення, що відповідає її максимальному значенню, називається потенційним або активаційним бар'єром обертання.
Слайд 5Взаємне розташування атомів і атомних груп у молекулі, що може
бути змінене в результаті обертання окремих частин молекули без розриву
хімічних зв'язків називається конформацією молекули.
Для молекули етана висота такого бар'єру = 12,1 кДж/моль. Зміни положень атомів можливі без розриву вуглецевого хімічного зв'язку.
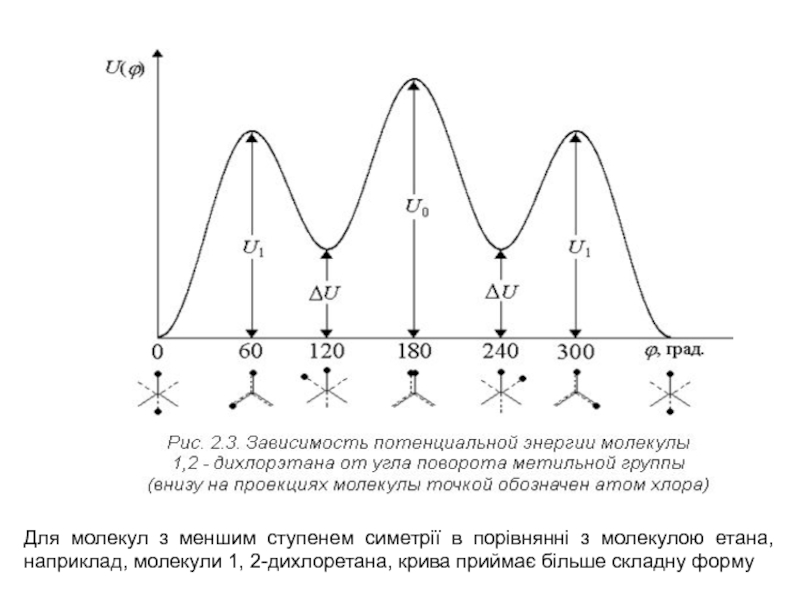
Слайд 6Для молекул з меншим ступенем симетрії в порівнянні з молекулою
етана, наприклад, молекули 1, 2-дихлоретана, крива приймає більше складну форму
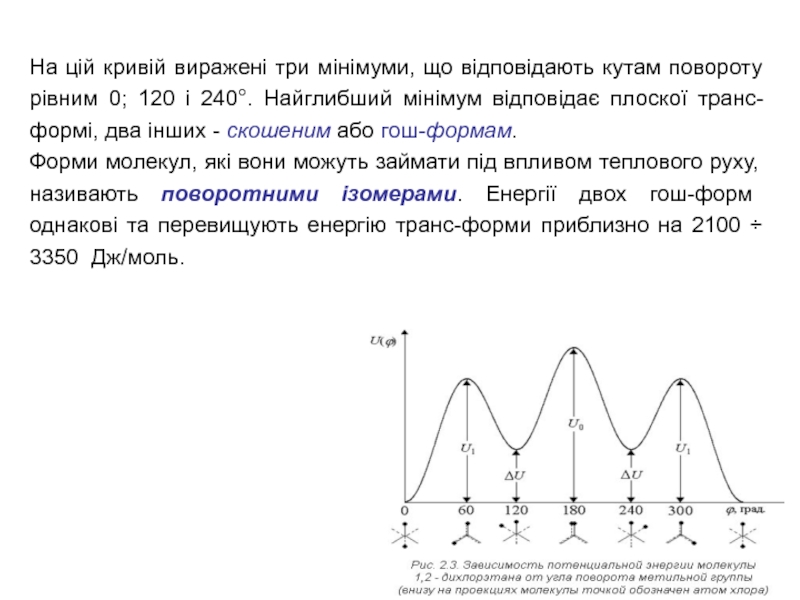
Слайд 7На цій кривій виражені три мінімуми, що відповідають кутам повороту
рівним 0; 120 і 240°. Найглибший мінімум відповідає плоскої транс-формі,
два інших - скошеним або гош-формам.
Форми молекул, які вони можуть займати під впливом теплового руху, називають поворотними ізомерами. Енергії двох гош-форм однакові та перевищують енергію транс-форми приблизно на 2100 ÷ 3350 Дж/моль.
Слайд 8Подвійний зв'язок у молекулі етилена здійснюється за допомогою звичайного σ-зв'язку
та специфічного π-зв'язку (мал. 2.1, б). Особлива конфігурація електронної хмари
π-зв'язку обумовлює фіксований напрямок інших чотирьох ковалентних σ-зв'язків при двох вуглецевих атомах. Ці зв'язки розташовані в одній площині під кутом 120° відносно один одного й щодо напрямку σ-зв'язку при двох атомах вуглецю. Обертання атомних груп навколо подвійного зв'язку неможливо без розриву цього зв'язку.
Взаємне розташування атомів і атомних груп у молекулі, що не може бути змінене в результаті обертання окремих частин молекули без розриву хімічних зв'язків називається конфігурацією молекули.
Слайд 9У випадку з етиленом, обидві можливі конфігурації рівнозначні. Але вже
конфігурації молекули, що має подвійний зв'язок і два різних заступники
- A і B, принципово розрізняються:
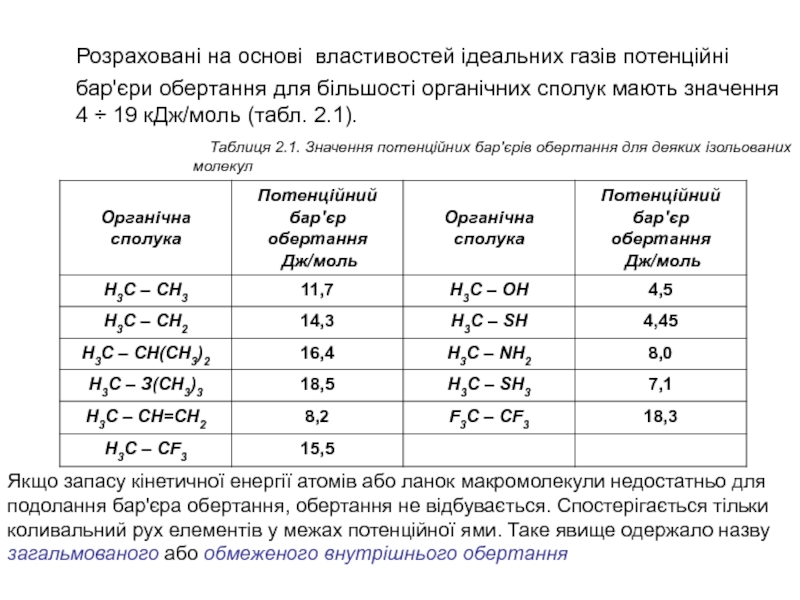
Слайд 10Розраховані на основі властивостей ідеальних газів потенційні бар'єри обертання для
більшості органічних сполук мають значення 4 ÷ 19 кДж/моль (табл.
2.1).
Таблиця 2.1. Значення потенційних бар'єрів обертання для деяких ізольованих молекул
Якщо запасу кінетичної енергії атомів або ланок макромолекули недостатньо для подолання бар'єра обертання, обертання не відбувається. Спостерігається тільки коливальний рух елементів у межах потенційної ями. Таке явище одержало назву загальмованого або обмеженого внутрішнього обертання
Слайд 11Гнучкість макромолекул
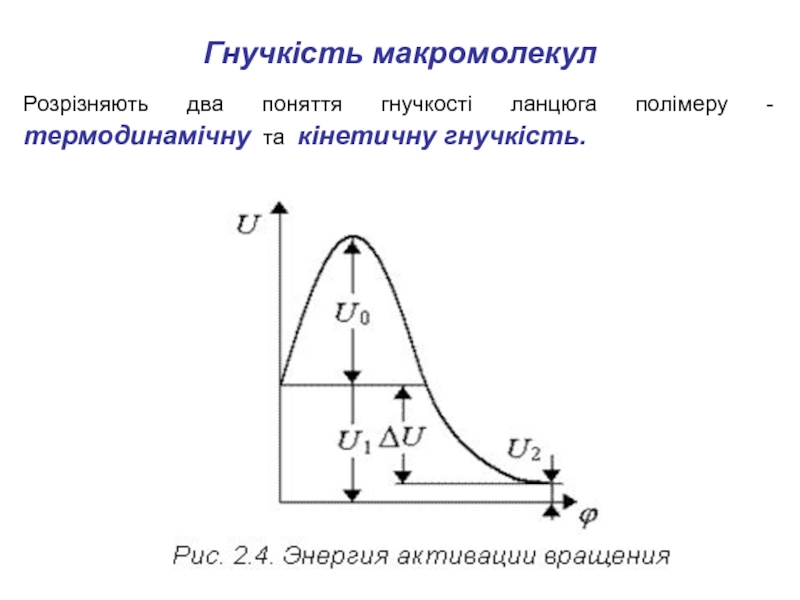
Розрізняють два поняття гнучкості ланцюга полімеру - термодинамічну
та кінетичну гнучкість.
Слайд 12Термодинамічна гнучкість - це здатність ланцюга згибатися під впливом теплового
руху. Визначається термодинамічна різницею потенційних енергій двох сусідніх станів ΔU
(рис. 2.4).
Характеризує ймовірність конформаційного переходу
Кінетична гнучкість ланцюга відбиває швидкість переходу ланцюга з одного енергетичного стану в інше. Визначається енергією активації, тобто величиною потенційного бар'єра U0 (рис. 2.4).
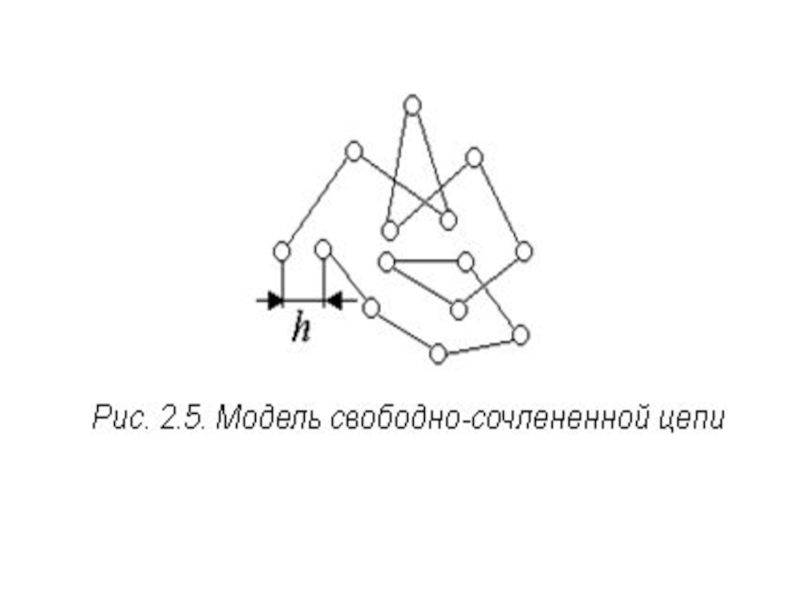
Слайд 13Найпростішою моделлю, запропонованої для опису фізичних властивостей, у тому числі
гнучкості ланцюга, полімерів є модель вільно з’єднаного ланцюга (модель “статистичних
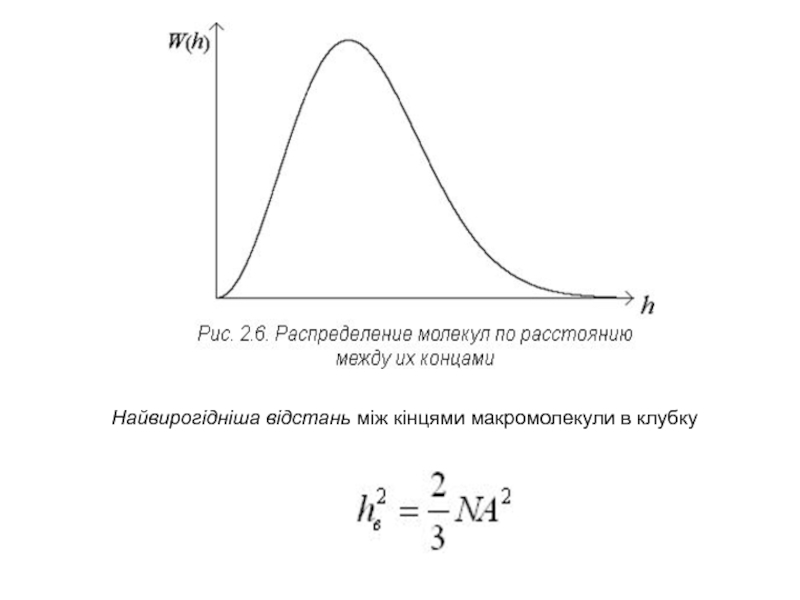
блукань”) (рис. 2.5). У такому ланцюзі немає жорстко зафіксованих валентних кутів і реалізується вільне обертання молекул. Гнучкість ланцюга обумовлює згортання макромолекул у розчинах полімерів у клубки. Важливим параметром такого клубка може служити відстань між кінцями згорнутого ланцюга h. Природно, імовірність реалізації W(h) конформацій з лінійно витягнутим ланцюжком (hmax = довжині витягнутого ланцюжка) і знаходженням кінців ланцюга в одній точці (hmin = 0) мізерно мала. Проміжні значення ймовірності розподіляються (рис. 2.5) за відомим законом (рис. 2.6):
Слайд 15де N - число повторюваних ланок у ланцюзі; A -
довжина однієї ланки.
Властивість цієї моделі – повна відсутність кореляцій між
орієнтаціями суміжних ланок
Слайд 16Найвирогідніша відстань між кінцями макромолекули в клубку
Слайд 17 Середньоквадратична відстань вільно з’єднаного ланцюга
Слід зазначити, що модель вільно з’єднаного
ланцюга є лише грубим наближенням до реального ланцюга й недостатня
для її опису. У полімерних ланцюгах валентні кути між зв'язками досить жорстко зафіксовані й обертання ланок не є вільним.
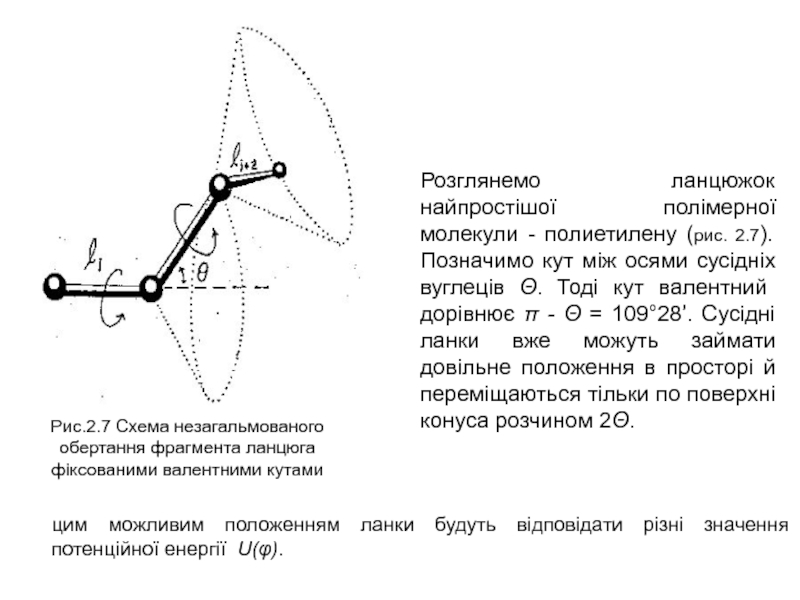
Слайд 18Розглянемо ланцюжок найпростішої полімерної молекули - полиетилену (рис. 2.7). Позначимо
кут між осями сусідніх вуглеців Θ. Тоді кут валентний дорівнює
π - Θ = 109°28’. Сусідні ланки вже можуть займати довільне положення в просторі й переміщаються тільки по поверхні конуса розчином 2Θ.
цим можливим положенням ланки будуть відповідати різні значення потенційної енергії U(φ).
Рис.2.7 Схема незагальмованого обертання фрагмента ланцюга фіксованими валентними кутами
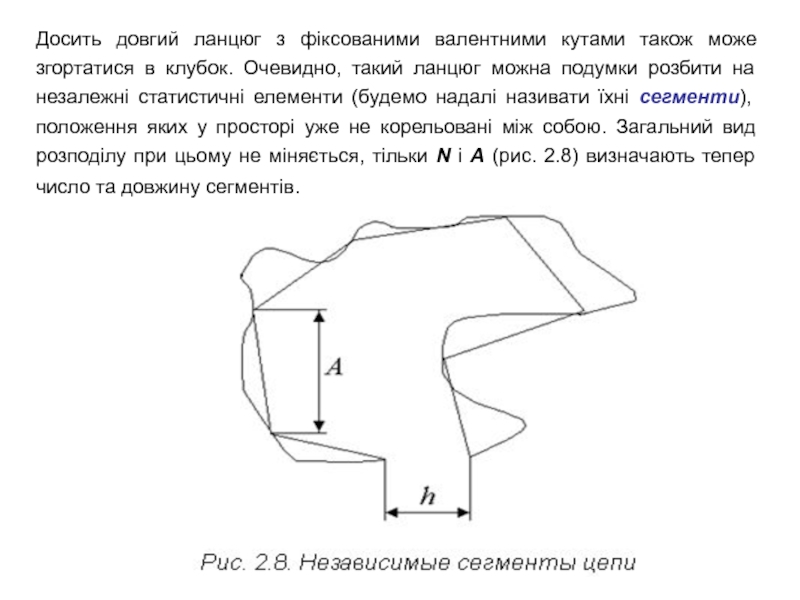
Слайд 19Досить довгий ланцюг з фіксованими валентними кутами також може згортатися
в клубок. Очевидно, такий ланцюг можна подумки розбити на незалежні
статистичні елементи (будемо надалі називати їхні сегменти), положення яких у просторі уже не корельовані між собою. Загальний вид розподілу при цьому не міняється, тільки N і A (рис. 2.8) визначають тепер число та довжину сегментів.
Слайд 20Облік загальмованості внутрішнього обертання й фіксованих валентних кутів приводить до
того, що вираження для середнього квадрата відстаней між кінцями реального
ланцюга приймає вид
де η - середній косинус кута внутрішнього обертання
У випадку вільного внутрішнього обертання η = 0, і ланцюг буде найбільш гнучкою; при η = 1 ланцюг буде максимально твердою. Величину
можна розглядати як міру термодинамічної гнучкості реального ланцюга.
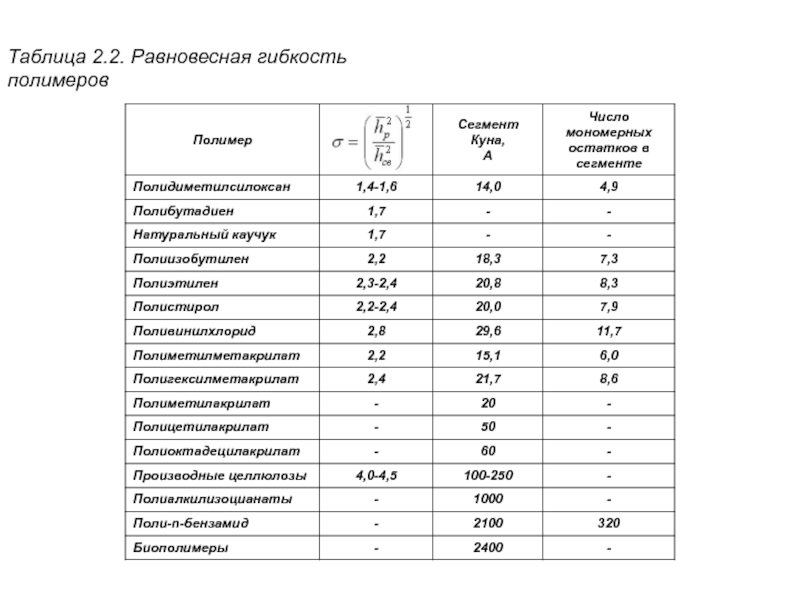
Слайд 21Таблица 2.2. Равновесная гибкость полимеров
Слайд 22Структуроутворення в полімерах
Відомо, що речовина може перебувати в трьох агрегатних
станах - газоподібному, рідкому й твердому.
Газоподібному стану відповідають відстані між
молекулами, значно переважаючі розміри самих молекул. При цьому розмірами молекул і їхньою взаємодією часто можна зневажити - стан ідеального газу. Такий стан не відповідає полімерному стану речовини.
Слайд 23Гнучкість полімерних ланцюгів дозволяє при взаємодії макромолекул займати їм різні
конфігураційні позиції відносно один одного. Найбільш вигідним станом полімерної речовини
залишається стан з найменшою потенційною енергією. Якщо енергія теплового руху ланок ланцюга не дозволяє робити їхнє перекидання через потенційні бар'єри, обумовлені взаємодією, макромолекули втрачають здатність переміщатися друг щодо друга. Кінетичну енергію макроланцюгів у цьому випадку визначає тільки обертання окремих ланок макромолекули навколо ковалентних зв'язків. Речовина здобуває ознаки твердого тіла. При цьому в масі полімерної речовини можуть утворюватися структури з наявністю далекого й ближнього порядків.
Слайд 24Відсутність або наявність тільки ближнього порядку в розташуванні ланок ланцюга
визначає
аморфний стан полімеру.
Наявність ближнього й далекого порядку в структурі
визначає кристалічну структуру полімеру.
Слайд 25З підвищенням температури макромолекули можуть знайти здатність до взаємного переміщення
друг щодо друга, визначаючи течію матеріалу, переводячи речовину в рідке
в'язкотекуче становище . В аморфних полімерах течія із ростом температури розвивається монотонно, говорять що полімер розм'якшується. Втрачаючи властивість течії зі зниженням температури полімер склується - переходить у склоподібний стан. Різні фізичні стани полімер при цьому здобуває без поглинання або виділення тепла. Строго визначити границю переходу з рідкого стану у тверде виявляється неможливим. Часто аморфний твердий стан полімеру розглядають як рідкий конденсований стан.
Слайд 26Термомеханічний метод дослідження полімерів
Найбільш повну інформацію про фізичні стани аморфних
полімерів дає метод термомеханічний дослідження полімерів.
Слайд 27Фізична сутність термомеханічних методів дослідження речовин складається у впливі на
зразок постійної сили F протягом певного часу при безперервному нагріванні
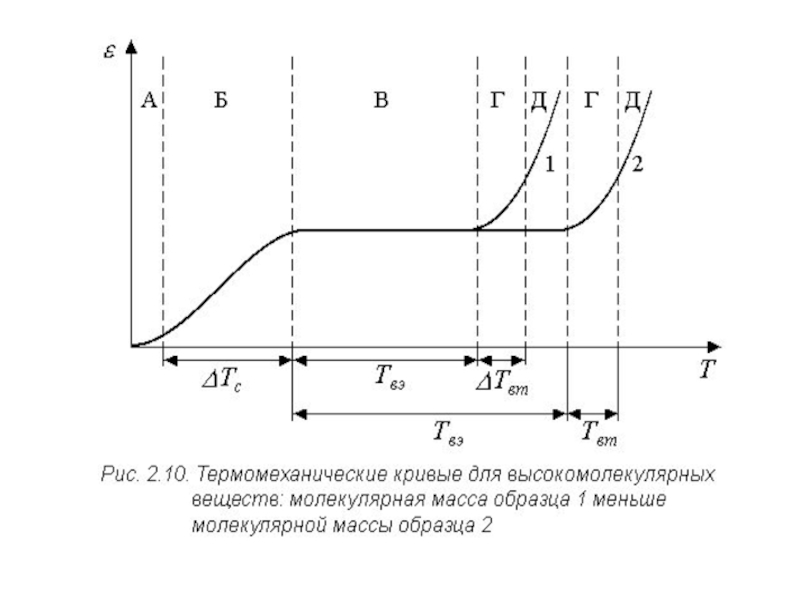
в заданому інтервалі температури. При використанні термомеханічного методу зразок досліджуваної речовини охолоджується до низької температури (наприклад, до температури рідкого азоту), витримується якийсь час для затухання релаксаційних процесів, а потім навантажується до заданої напруги σпоч. При підвищенні температури під дією обраного навантаження за той самий відрізок часу розвивається все більша відносна деформація різного виду (ε). Залежності ε = f(T) являють собою криві з різним нахилом до осей абсцис (T) і ординат (ε). На характер цих залежностей істотно впливає молекулярна маса речовин ММ (рис. 2.9). Для низькомолекулярних речовин (ММ = 10÷500) залежність має вигляд крутих криволінійних відрізків 1.
Слайд 28Температура, при якій починається різке зростання деформації речовини, називається
температурою
розм'якшення (або температурою склування Tс (Тg).
При цьому Tс, як
правило, збігається з початком процесу в’язкої течії (Tвт). У такий спосіб Tс ділить криву залежності ε = f(T) на області склоподібного стану та стану в’язкої течії .
Слайд 30На термомеханічній кривій олигомерів (ММ = 500 ÷ 6000) відбувається
зсув області розм'якшення убік високих температур (крива 2, більше полога),
а деформація розвивається менш інтенсивно. Однак температури склування та в’язкої течії як і раніше збігаються.
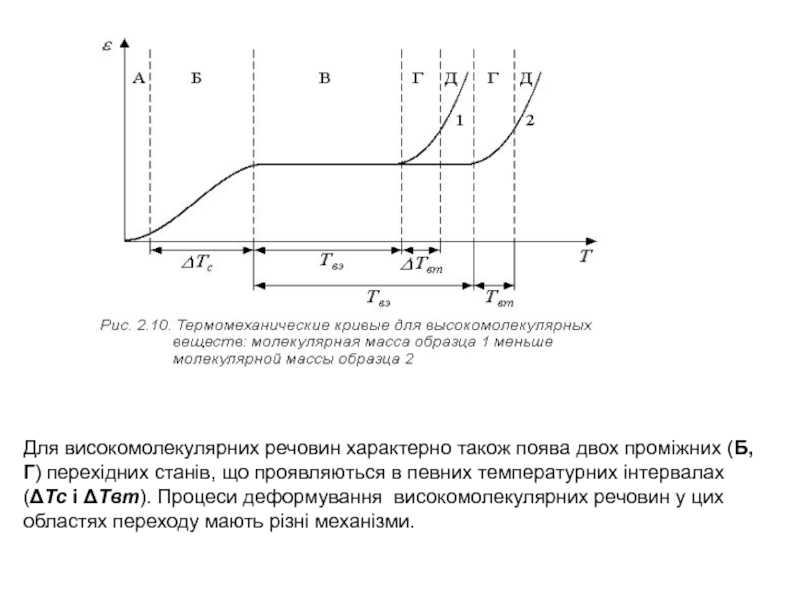
Перехід до високомолекулярних речовин супроводжується якісною й кількісною зміною виду термомеханічної кривої (рис. 2.10). Знижується інтенсивність розвитку деформаційних процесів через істотне збільшення внутрішнього тертя. Виявляє себе новий, властивий тільки високомолекулярним сполукам, високоеластичний стан речовини. Проявляється він на термомеханічній кривій у вигляді полички (ΔTвэ), що відповідає малій зміні деформації в межах від Tc до температури течії ( в’язкої течії ).
Саме наявність температурного інтервалу високоеластичного стану є достатньою ознакою полімерного тіла, тобто проявом специфічної особливості ланцюгових полімерних молекул - гнучкості.
Слайд 31Таким чином, термомеханічна крива, знята в широкому температурному інтервалі, дозволяє
виділити для високомолекулярних речовин крім склоподібного (А) (рис. 2.10) стану
і стану в’язкої течії ( Д) , також високоеластичний (В) фізичний (деформаційний) стан.
Тому що значення Tc, Tвт і ΔTвэ залежать від величини прикладеного навантаження та тимчасового фактора, високоеластичний стан відносять до релаксаційного фізичного стану.
Слайд 32Для високомолекулярних речовин характерно також поява двох проміжних (Б, Г)
перехідних станів, що проявляються в певних температурних інтервалах (ΔTc і
ΔTвт). Процеси деформування високомолекулярних речовин у цих областях переходу мають різні механізми.
Слайд 33Перехідний стан Б обумовлений розморожуванням сегментальної рухливості макроланцюгів. У стані
Г у рух виявляються залученими полімерні ланцюги в цілому. Розходження
механізмів теплового руху обумовлює різний характер еволюції термомеханічної залежності при збільшенні молекулярної маси полімеру (1,2).
Форма кривої в області склування (Tc) практично не залежить від ММ. Інтервал же ΔTвт зі збільшенням ММ зміщається у високотемпературну область.
Слайд 34Релаксаційний характер високоеластичного стану проявляється при проведенні випробувань в імпульсному
режимі. Зменшення часу впливу навантаження приводить до зсуву інтервалу ΔTвт
у високотемпературну область.