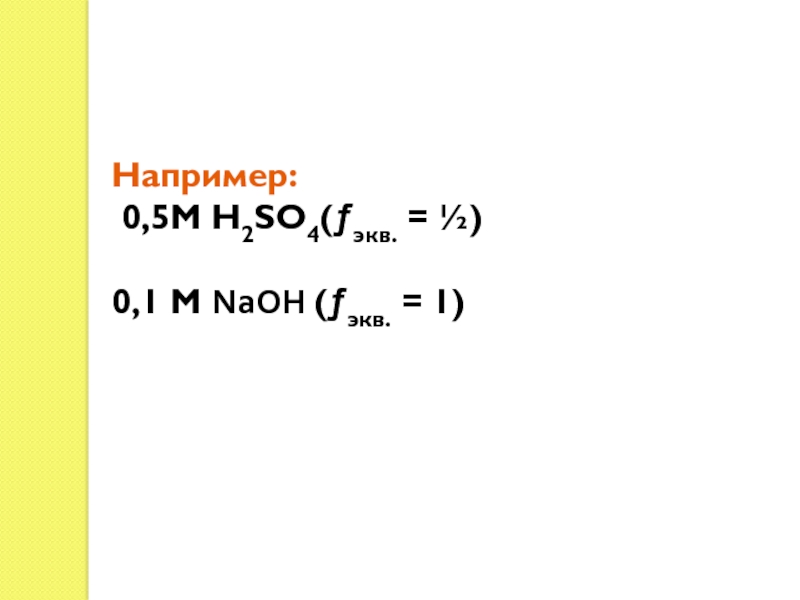Слайд 1СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
Слайд 2Состав раствора выражают
в виде концентрации или доли
каждого из
веществ.
Под концентрацией принято
понимать массу, объём или
количество вещества
в
определенной массе или
объёме раствора.
В связи с этим различают массовую и
объёмную концентрации.
Слайд 31. МАССОВАЯ ДОЛЯ -
отношение массы растворенного вещества к общей
массе раствора:
m(Х)
ω(Х) = ------------------, где
m(р-ра)
ω (Х) –массовая доля растворённого вещества Х;
m(Х) – масса растворенного вещества Х;
m(р-ра) – масса раствора.
Слайд 4
Массовую долю растворённого вещества ω(Х) обычно выражают в %;
она
показывает содержание массы растворённого вещества в 100 г раствора:
m(Х)
ω(Х) = ------------ · 100 % ,
m(р-ра)
например, массовая доля ω(NаСl) в растворе
составляет 20 %.
Это значит, что в 100 г раствора содержится :
20 г NаСl и 80 г воды
Слайд 5
2.Молярная доля – отношение количества растворенного вещества в растворе к
общему количеству веществ этого раствора: nобщ. = n(Х1)
+ n(Н2О)
n(Х1)
(Х1) = -------- или
nобщ.
n(Х1)
(Х1) = -------- · 100 %
nобщ
Слайд 6
3.Количество растворенного вещества:
m(Х1)
n(Х1) = ------------,
M(Х1)
где m(Х1) – масса растворенного вещества Х1;
M(Х1) – молярная масса растворенного вещества Х1;
Слайд 7например,
М(NаОН) = 40 г/моль;
m(NаОН) = 80 г;
тогда n(NаОН) = 2 моль
Слайд 84.Фактор эквивалентности – число, показывающее, какая доля реальной частицы вещества
Х эквивалентна одному иону водорода в данной кислотно-основной реакции или
одному электрону в окислительно-восстановительной реакции.
Это безразмерная величина, которая рассчитывается на основании стехиометрических коэффициентов реакции, равная или меньше единицы:
экв.(Х) 1
Для кислотно-основных реакции экв.(Х) вычисляют по числу замещенных атомов водорода, а для окислительно-восстановительных – по числу электронов, участвующих в реакции.
Слайд 9
5.Эквивалент (Э) – 1/х часть частицы вещества.
Число х называют
числом эквивалента. Оно указывает на число замещенных (присоединенных) атомов водорода
или число отданных (принятых) электронов.
Фактор и число эквивалентности связаны соотношением:
экв.(Х) =1/х, очевидно, что 1
Слайд 10Эквивалент вещества, используя фактор эквивалентности, записывают
экв.(Х)
и при этом указывают его
величину
Слайд 11
Пример, в реакции
Na2CO3 + 2HCl = 2NaCl+H2О + СО2
молекула
Na2CO3 эквивалентна двум протонам. Следовательно, 1/2 её часть, взаимодействующая с
одним протоном, является эквивалентом. Поэтому число эквивалентности : (Na2CO3) = 2; (Na2CO3) = 1/2
Слайд 12Значение (Х) можно определить по химической формуле вещества.
Так, для
кислот число эквивалента (Х) равно числу катионов водорода, способных замещаться
катионами металла (равно основности кислоты). Для гидроксидов число эквивалента (Х) равно числу гидроксогрупп ОН- . Для солей число эквивалента (Х) равно числу катионов водорода кислоты, замещенных катионами металла или аммония.
Слайд 13Пример, в реакции:
10FeSO4 + 2KMn+7O4 +8Н2SO4 = 5Fe2(SO4)3 +2Mn2+SO4
+ К2SO4 + 8Н2О
Mn7¯ + 5е¯
Mn2+
Следовательно: Z(КМnO4) =5; (KMnO4) = 1/5;
Слайд 14
экв.(кислоты) =
1
[H]
экв.(HCl)= 1/[H]=1|1
экв.(H2SO4)= 1/[H]=1|2
экв.(гидроксида) = 1
[OH]
экв.(KOH)= 1/[OH]=1|1
экв.Ba(OH)2= 1/[OH]=1|2
экв.(соли) = 1
[Ме]хВ
(Na2CO3) = 1/2 х 1=1/2
Слайд 15экв.(HCl)= 1/[H]=1|1
экв.(H2SO4)= 1/[H]=1|2
экв.(KOH)= 1/[OH]=1|1
экв.Ba(OH)2= 1/[OH]=1|2
экв.(Na2CO3) = 1/2 х 1=1/2
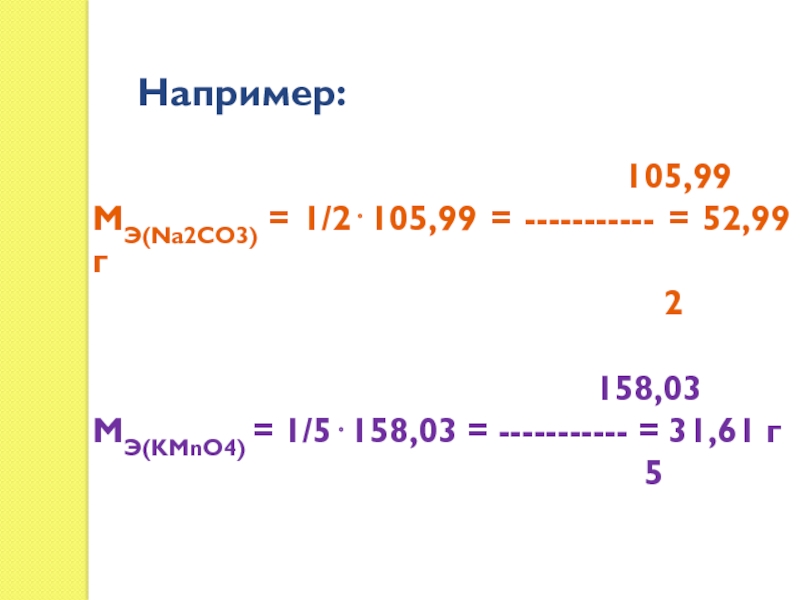
Слайд 166.Молярная масса эквивалента вещества Х – это масса одного моля
эквивалента этого вещества. Её записывают и рассчитывают следующим образом:
МЭ(Х) =
экв.(Х)·М (Х) = М(Х)/х
105,99
МЭ(Na2CO3) = 1/2105,99 = ----------- = 52,99 г
2
158,03
МЭ(KMnO4) = 1/5158,03 = ----------- = 31,61 г
5
Слайд 187.Молярная концентрация – отношение количества растворенного вещества к объёму раствора
(количество молей растворенного вещества в 1 л раствора).
Обычно её
обозначают С(Х), а после численного значения пишут моль/л или М:
n(Х) m(Х)
С(Х) = ---------- 1000 = -------------- 1000 ,
V М(Х) V
например С(HCl) = 0,1 моль/л или 0,1М
Слайд 19m(Х) – масса растворенного вещества Х, г;
M(Х) – молярная масса
растворенного вещества Х, г;
V – объём раствора, мл;
n(Х) – количество
растворенного вещества Х, моль.
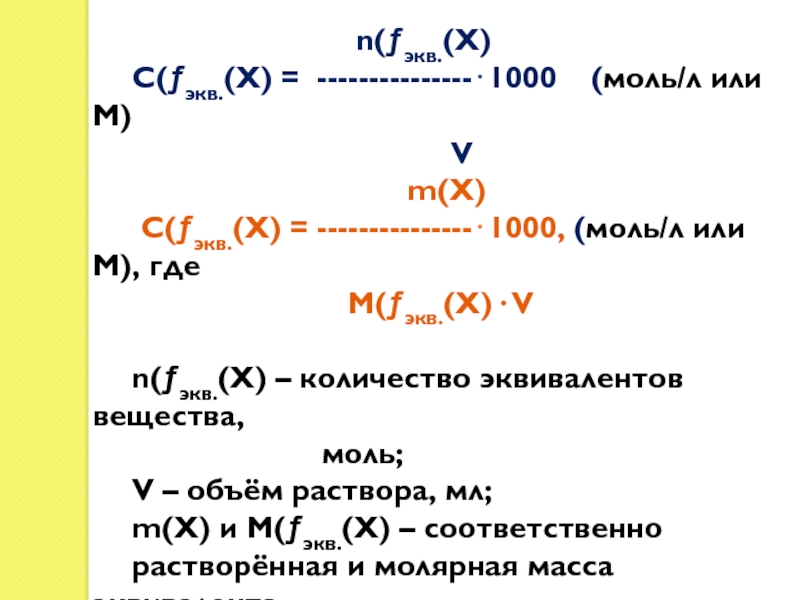
Слайд 208.Молярная концентрация эквивалента – отношение количества вещества эквивалента в растворе
к объёму этого раствора или количество молей эквивалента вещества в
1 л раствора.
Слайд 21Форма записи С(экв.(Х) :
n(экв.(Х)
С(экв.(Х) = ---------------1000
(моль/л или М)
V
m(Х)
С(экв.(Х) = ---------------1000, (моль/л или М), где
М(экв.(Х)· V
n(экв.(Х) – количество эквивалентов вещества,
моль;
V – объём раствора, мл;
m(Х) и М(экв.(Х) – соответственно
растворённая и молярная масса эквивалента
вещества, г.
Слайд 22Например:
0,5М Н2SО4(экв. = ½)
0,1 М NаОН (экв. = 1)
Слайд 239.Титр – масса вещества в г, содержащаяся
в 1 мл раствора, обозначается:
m(X)
Т(Х) =-----------,
г/мл
V
Например, Т(НСI) = 0,03604 г/мл, т.е. в 1 мл этого раствора содержится 0,034604 г НСI.
Слайд 24Титр связан с молярной концентрацией уравнением:
С(Х) · М(Х)
Т(Х) =--------------- (г/мл)
1000
связан с молярной концентрацией эквивалента уравнением:
С(экв.(Х) ·М(экв.(Х)
Т(Х) =---------------------------- ( г/мл)
1000
Слайд 2610.Титр раствора по определяемому веществу
(Т А/Х) – масса
определяемого вещества (Х) в г, реагирующая с 1 мл раствора
титранта (А)
m(Х)
Т(А/Х) = -----------, г/мл
V(А)
Например, Т(Н2SО4/NaОН) = 0,0025г/мл, это значит 1 мл раствора Н2SО4 реагирует с 0,0025 г NaОН.
Слайд 27Для перевода обычного (простого) титра в титр по определяемому веществу
(сложный) пользуются формулой:
Т(А) · Мэ(fэкв.Х)
Т(А/Х) = ----------------------- (г/моль)
Мэ(fэкв.А)
Слайд 2811. Поправочный коэффициент – число, показывающее, во сколько раз практическая
концентрация (навеска) больше или меньше заданной (расчётной, теоретической).
практическая концентрация
К = ------------------------------------- ------
теоретическая концентрация
взятая навеска
К = -------------------------------------
теоретическая навеска
Слайд 2912.Закон эквивалентов, в соответствии с которым число эквивалентов взаимодействующих и
образующихся веществ равно.
Для произвольной реакции :
аА + bB = сC
+ dD
закон эквивалентов имеет следующие математические выражения:
n(fэквА) = n(fэквВ) = n(fэквС)= n(fэквD) ;
2 моль · ½ А = 2 моль · ½ В = 2 моль · ½ С = 2 моль · ½ D = 1 моль
С(fэквА) ·V(А) = С(fэквВ) ·V(В)













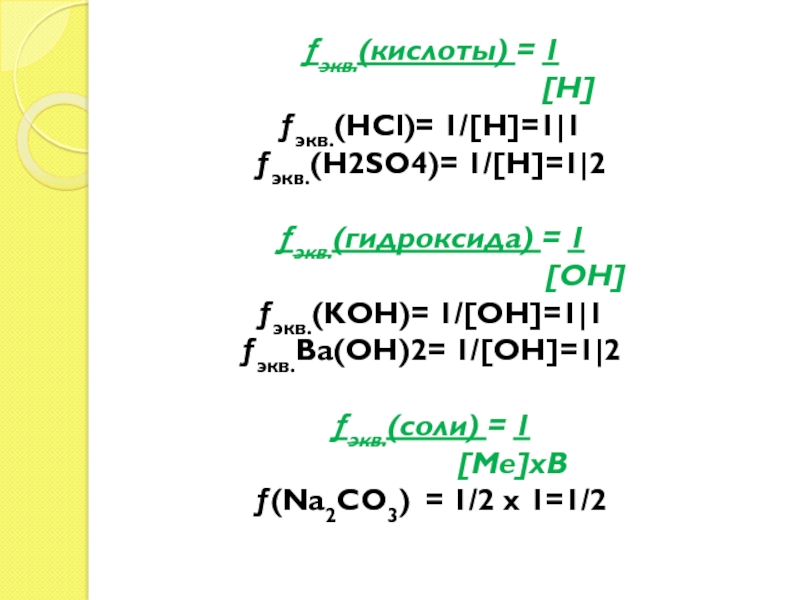
![СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ экв.(HCl)= 1/[H]=1|1 экв.(H2SO4)= 1/[H]=1|2 экв.(KOH)= 1/[OH]=1|1 экв.Ba(OH)2= 1/[OH]=1|2 экв.(Na2CO3) = 1/2 х 1=1/2 экв.(HCl)= 1/[H]=1|1 экв.(H2SO4)= 1/[H]=1|2 экв.(KOH)= 1/[OH]=1|1 экв.Ba(OH)2= 1/[OH]=1|2 экв.(Na2CO3) = 1/2 х 1=1/2](/img/tmb/3/267020/ae483fa22bbaf4c1366bb8a32922017c-800x.jpg)