Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атомов и молекул химического вещества с позиции квантовой теории
Содержание
- 1. Строение атомов и молекул химического вещества с позиции квантовой теории
- 2. Слово «атом» впервые упоминалось в трудах философов
- 3. После открытия электрона в 1897 г. Джозефом
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. Противоречие разрешил ученик Резерфорда Нильс Бор [7
- 8. Бор выдвинул предположение, что атом водорода (система
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Слайд 33
- 34. Слайд 34
- 35. Слайд 35
- 36. Слайд 36
- 37. Слайд 37
- 38. Слайд 38
- 39. Слайд 39
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
- 43. Слайд 43
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
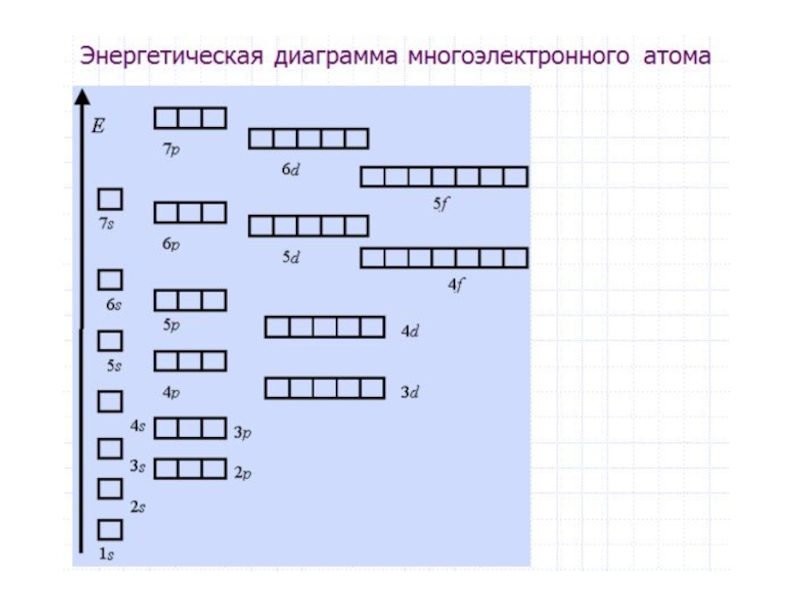
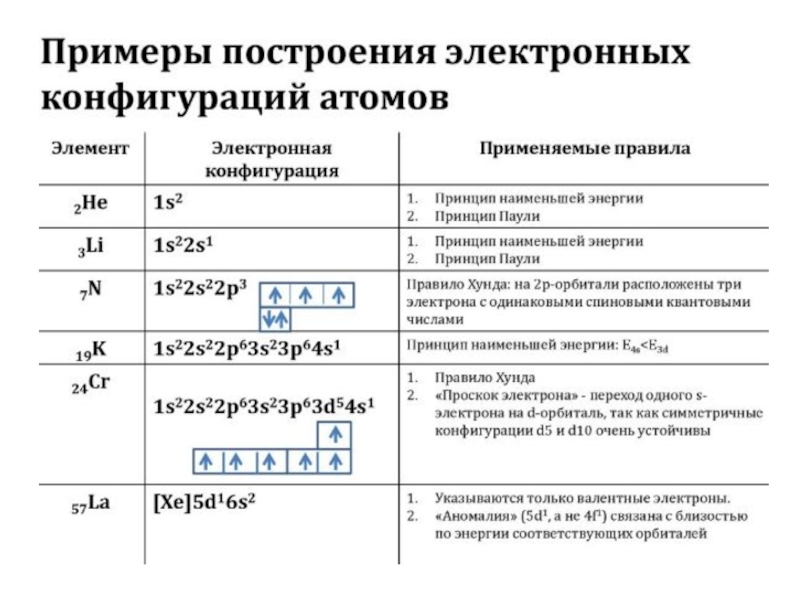
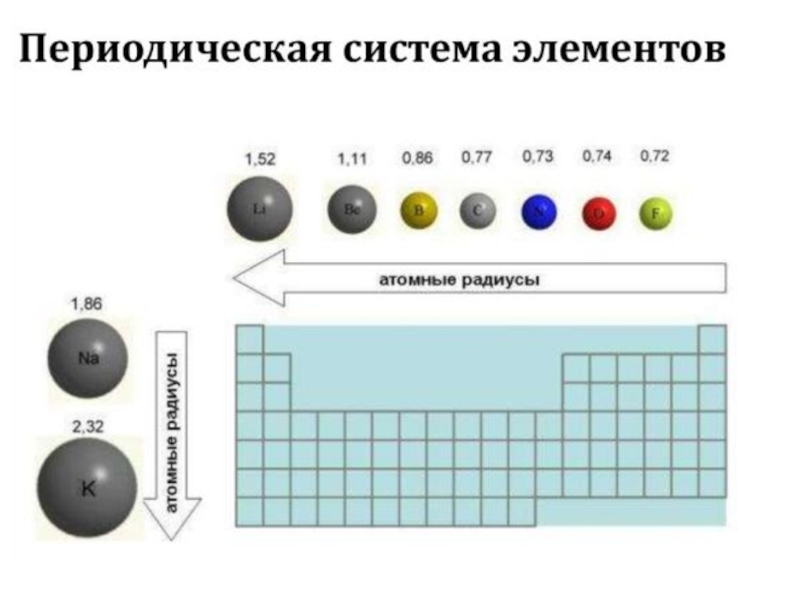
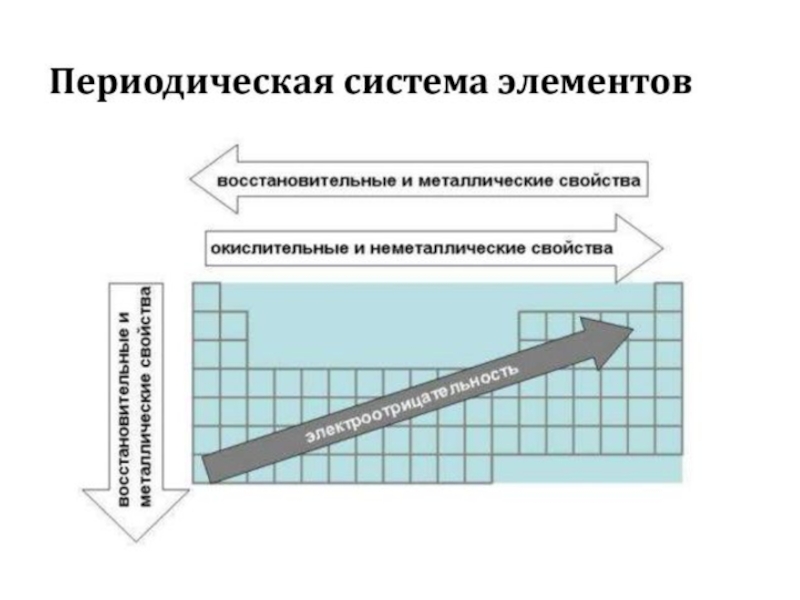
- 47. Для наглядного изображения электронной структуры атома существуют
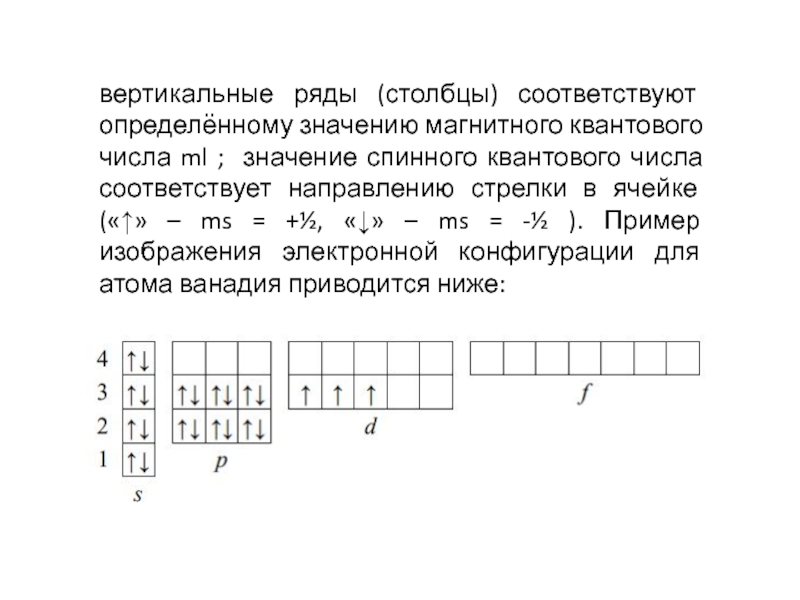
- 48. вертикальные ряды (столбцы) соответствуют определённому значению магнитного
- 49. Слайд 49
- 50. Слайд 50
- 51. Слайд 51
- 52. Слайд 52
- 53. Слайд 53
- 54. Слайд 54
- 55. Слайд 55
- 56. Слайд 56
- 57. Слайд 57
- 58. Слайд 58
- 59. Слайд 59
- 60. Слайд 60
- 61. Скачать презентанцию
Слово «атом» впервые упоминалось в трудах философов Древней Греции, и в переводе оно означает «неделимый». Не имея современных приборов, философ Демокрит, используя логику и наблюдательность, пришел к выводу, что любое вещество
Слайды и текст этой презентации
Слайд 3 После открытия электрона в 1897 г. Джозефом Джоном Томсоном [4
] им же была предложена первая атомная модель "пудинга с
изюмом" – в положительную сферу вкраплены электроны (1903 г.).В 1904 г. японский физик Хантаро Нагаока [5 ] предложил модель “сатурноподобного” атома, в котором электроны вращаются по кольцевой орбите вокруг положительного ядра.
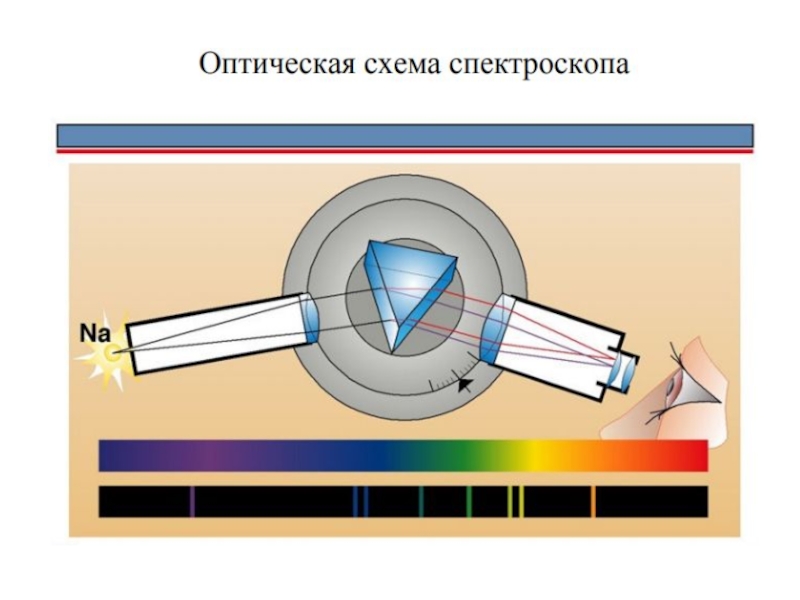
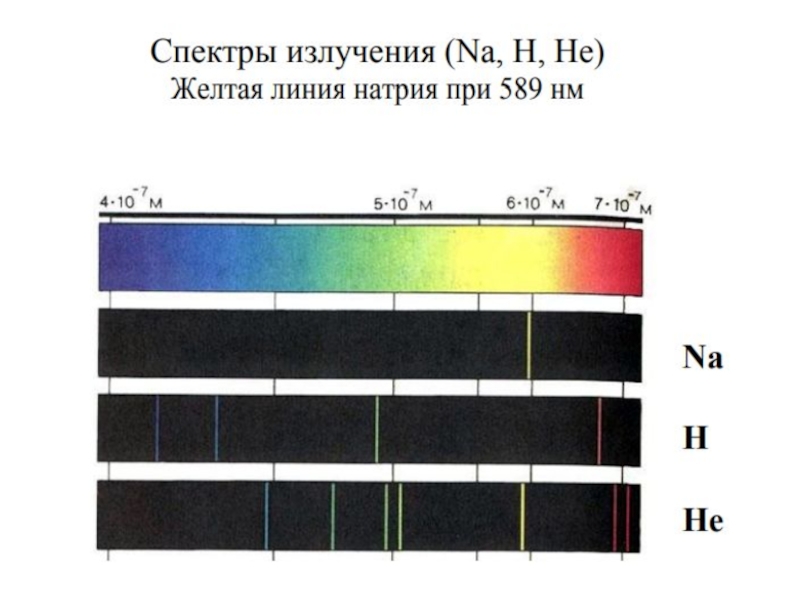
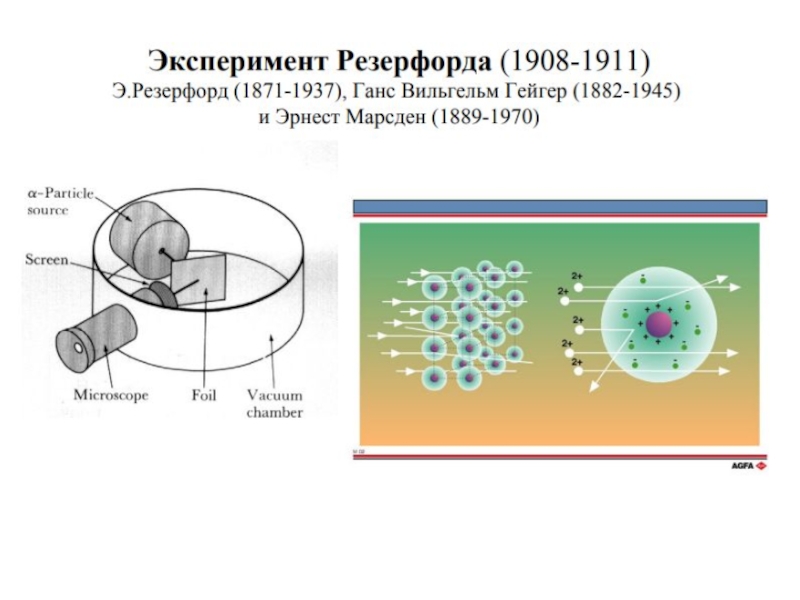
Ученик Томсона Эрнест Резерфорд в результате знаменитых экспериментов по рассеянию золотой фольгой a-частиц "разделил" атом на маленькое положительное ядро и окружающие его электроны [6 ]. Однако, согласно законам классической механики и электродинамики, вращение электрона вокруг ядра должно сопровождаться электромагнитным излучением с непрерывным спектром. Это противоречило известным с 1880 г. линейчатым спектрам газов и паров элементов.
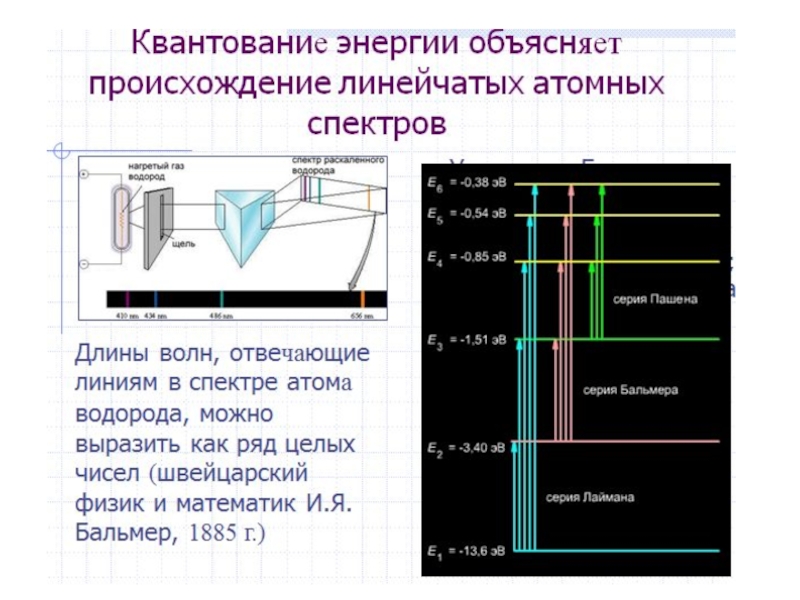
Слайд 7 Противоречие разрешил ученик Резерфорда Нильс Бор [7 ] в 1913
г., разработав квантовую модель атома на основе квантовой теории излучения
и поглощения света, созданной Максом Планком и Альбертом Эйнштейном. При этом удалось объяснить и рассчитать теоретически линейчатые спектры испускания атомов водорода, а также серии линий в рентгеновских спектрах элементов.Слайд 8 Бор выдвинул предположение, что атом водорода (система протон-электрон) может находиться
только в определенных стационарных энергетических состояниях (электрон – на определенных
орбитах), причем одно из них соответствует минимуму энергии и является основным (невозбужденным). Испускание или поглощение атомом энергии может происходить, согласно теории Бора, только при переходах электрона из одного энергетического состояния в другое (с одной орбиты на другую). Для R в формуле Бальмера Бор нашел следующее выражение:R = [(2π 2 me4 )/(ch3 )]
где m и e – масса и заряд электрона, c – скорость света в вакууме, h – постоянная Планка. При этом Бор предсказал существование серии линий испускания в ультрафиолетовой области (k = 1), которые затем были обнаружены в 1915 г. Теодором Лайманом.


![Строение атомов и молекул химического вещества с позиции квантовой теории После открытия электрона в 1897 г. Джозефом Джоном Томсоном [4 ] После открытия электрона в 1897 г. Джозефом Джоном Томсоном [4 ] им же была предложена первая атомная](/img/thumbs/98deacb53041513a14ffc62d472d2fb1-800x.jpg)


![Строение атомов и молекул химического вещества с позиции квантовой теории Противоречие разрешил ученик Резерфорда Нильс Бор [7 ] в 1913 г., Противоречие разрешил ученик Резерфорда Нильс Бор [7 ] в 1913 г., разработав квантовую модель атома на основе](/img/thumbs/75347aea3eacf17c97d868905c563239-800x.jpg)