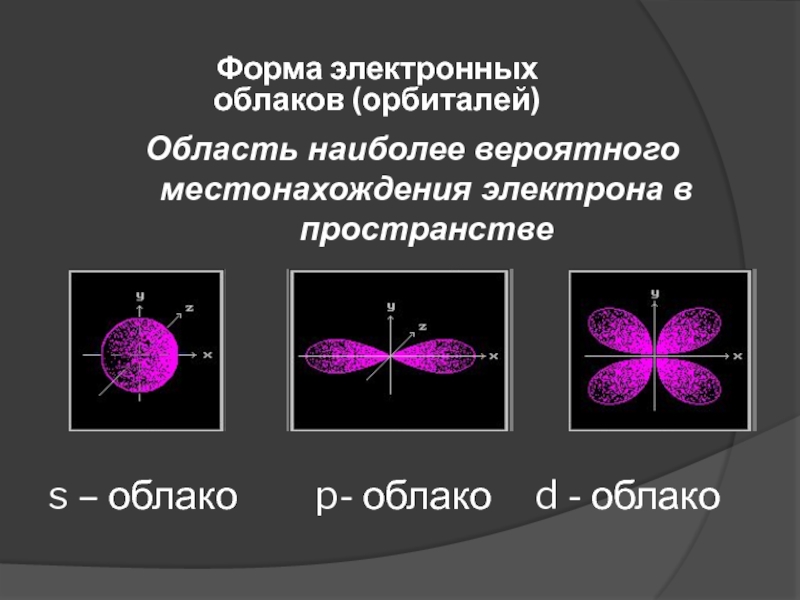
свою траекторию движения и запас энергии;
Электроны расположены на различном расстоянии
от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки;По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее.