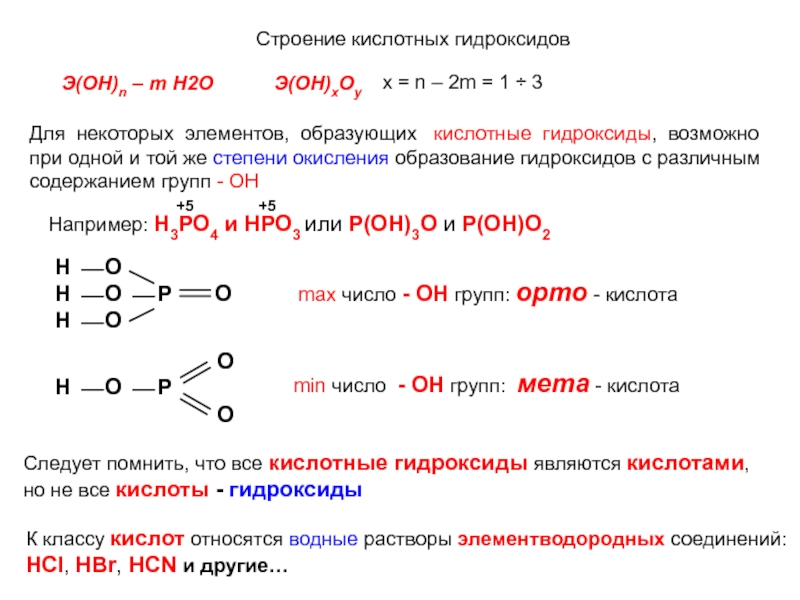
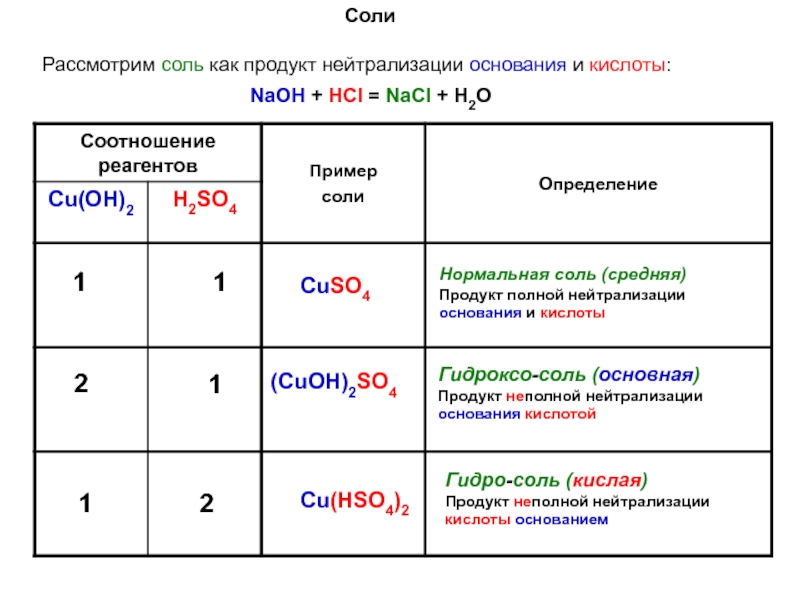
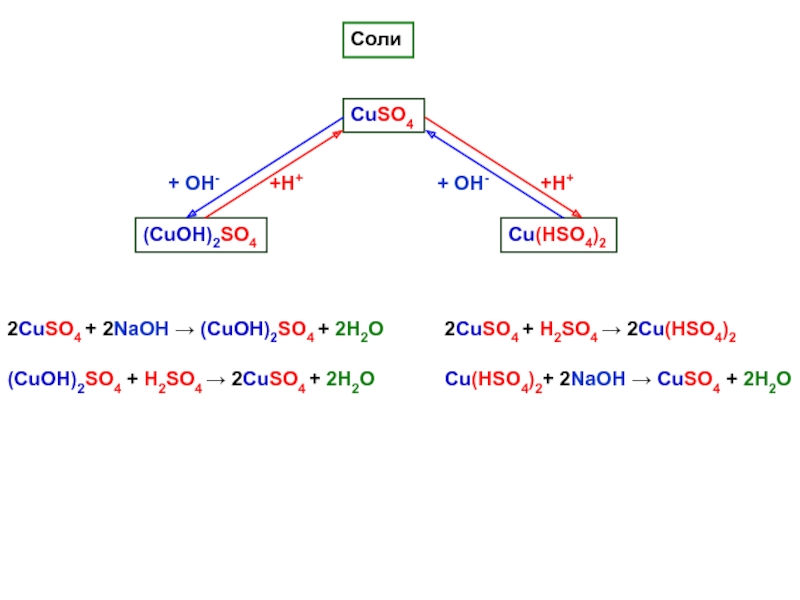
кислотные гидроксиды, возможно
при одной и той же степени окисления
образование гидроксидов с различнымсодержанием групп - ОН
Следует помнить, что все кислотные гидроксиды являются кислотами,
но не все кислоты - гидроксиды
К классу кислот относятся водные растворы элементводородных соединений:
HCl, HBr, HCN и другие…