Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение комплексных соединений
Содержание
- 1. Строение комплексных соединений
- 2. Строение комплексных соединений. Устойчивость комплексных соединений в растворах. Лигандообменное равновесиеЛекция №2Лектор:к.х.н., доцент Иванова Н.С.
- 3. Значение комплексных соединенийВыполняют биологические функции в организме:
- 4. Комплексные соединения – … … молекулярные соединения,
- 5. Альфред ВернерАльфред Вернер(1866 — 1919)Швейцарский химик. Профессор Цюрихского университета. Лауреат Нобелевской премии
- 6. Положения координационной теории Вернера (1893)Основой КС является
- 7. Положения координационной теории Вернера (1893)Количество лигандов, скоординированных
- 8. Недостатки координационной теорииСвязь между ядром и внешней
- 9. Строение комплексных соединений (по ТВС)Комплексообразователь – акцептор
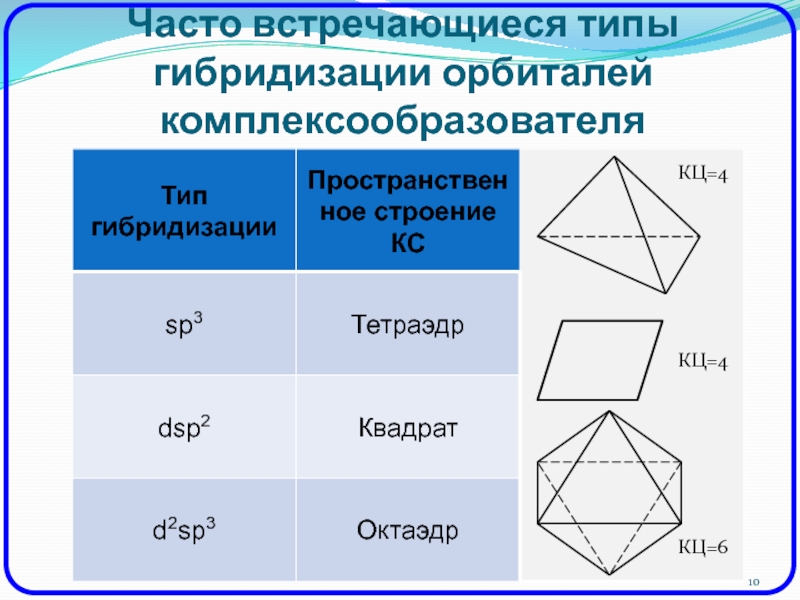
- 10. Часто встречающиеся типы гибридизации орбиталей комплексообразователяКЦ=4КЦ=4КЦ=6
- 11. Пример образования парамагнитного высокоспинового (спин-свободного) КС[Cr(NH3)6]3+24Cr
- 12. Пример образования диамагнитного низкоспинового (спин-спаренного) КС[Co(NH3)6]3+27Co
- 13. Пример образования высокоспинового внешнеорбитального комплекса Оба предыдущих
- 14. Классификация лигандов по «силе»…… проводится на основе
- 15. Дентатность (координационная ёмкость) лигандов …… (от латинского
- 16. Классификация комплексных соединенийХелаты (от греческого χλατ –
- 17. Классификация комплексных соединенийПолиядерные комплексы – (от слова
- 18. Классификация комплексных соединенийМакроциклические комплексы – комплексообразователь («гость»)
- 19. Поведение КС в растворахСпособность КС к диссоциации[Cr(NH3)6]Cl3
- 20. Поведение КС в растворахСпособность КС к замене
- 21. Номенклатура КС …… язык, который в названии
- 22. Номенклатура КС …Название комплексообразователя (в комплексном катионе
- 23. Комплексообразующая способность s-, p-, d- элементовs- элементы,
- 24. Изолированное лигандообменное равновесиереализуется при диссоциации комплексного иона,
- 25. Классификация биокомплексов (БК) по устойчивостиI группа: прочные
- 26. Совмещённые лигандообменные равновесияZn2+Кн1 S − белокHg2+Кн2Вывод: в
- 27. Совмещённые лигандообменные равновесияО2Кн1 Fe2+COКн2Вывод: в СЛОР доминирует
- 28. Hemoglobin
- 29. Металлолигандный гомеостазГомеостаз − постоянство показателей внутренней среды
- 30. S − белокHg2+Кн2 Кн3 < Кн2 Кн3
- 31. 2. Высокая или низкая концентрация микроэлементов в
- 32. Причины нарушенияИзбыток микроэлементов также ведёт к нарушению
- 33. 3. Попадание в организм лигандов-токсикантов из окружающей
- 34. В состав чая, кофе и соевого белка
- 35. 4. Выработка организмом «фальшивых» Л. Пример этого
- 36. Термодинамические принципы хелатотерапииI − биоКО, необходимый организму;Е
- 37. Детоксиканты хелатотерапииДля выведения Pb2+ используется трилонБ (EDTA);
- 38. Спасибо за внимание!
- 39. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Строение комплексных соединений. Устойчивость комплексных соединений в растворах. Лигандообменное равновесие
Лекция
№2
Слайд 3Значение комплексных соединений
Выполняют биологические функции в организме: перенос О2 к
тканям и органам гемоглобином, ионов металлов через мембрану клетки с
помощью ионофоров, действие металлоферментов (карбоксипептидаза, карбоангидраза, цитохромы и т.п.) и другие процессы.Являются лекарствами (Диакарб, Дисульфурам), регулируют гемостаз и являются антидотами (ЭДТА).
На реакциях комплексообразования основаны методы диагностики (более 80 элементов ПСЭ можно определить методами комплексометрии).
Слайд 4Комплексные соединения – …
… молекулярные соединения, не показывающие в
растворе всех свойств исходных для них соединений первого порядка (достаточно
простые по своей структуре соединения Н2О, SO3, СО, NH3 и т.п.).Главный признак КС – наличие 2х, 4х, 6и, а иногда и большего числа химических групп, расположенных геометрически правильно (координированных) вокруг иона металла. Они могут быть нейтральными и заряженными, независимы или связаны друг с другом, образовывая длинную гибкую молекулу.
Слайд 5Альфред Вернер
Альфред Вернер
(1866 — 1919)
Швейцарский химик. Профессор Цюрихского университета. Лауреат
Нобелевской премии
Слайд 6Положения координационной теории Вернера (1893)
Основой КС является центральный ион или
комплексообразователь, роль которого выполняет катион металла.
Комплексообразователь может проявлять не только
«главную» валентность, но и дополнительную или «побочную». Главная валентность насыщается только анионами, побочная – и анионами, и нейтральными молекулами и только в КС.Координированные ионы и молекулы в КС называются лигандами; они образуют внутреннюю сферу КС.
Слайд 7Положения координационной теории Вернера (1893)
Количество лигандов, скоординированных вокруг комплексообразователя, характеризуется
координационным числом.
Комплексообразователь и внутренняя сфера КС составляют ядро комплекса, которое
при записи выделяется квадратными скобками. Ядро может быть нейтральным или заряженным.Если ядро заряжено, то КС имеет внешнюю сферу за счёт противоположно заряженных ионов.
Слайд 8Недостатки координационной теории
Связь между ядром и внешней сферой ионная, поэтому,
в растворе КС диссоцируют по уравнению
[Cr(NH3)6]Cl3 ↔ [Cr(NH3)6]3+ + 3Cl–
Недостатки:
Не
объясняет природу связи в ядре комплекса.Не учитывает природу лигандов.
Слайд 9Строение комплексных соединений (по ТВС)
Комплексообразователь – акцептор электронов.
Лиганд – донор
электронов.
Связь между лигандами и центральным ионом – донорно-акцепторная.
Из-за энергетической неравноценности
орбиталей комплексообразователя ТВС вводит понятие гибридизации орбиталей.Гибридизация – смешение и выравнивание по форме и энергии орбиталей, принадлежащих к разным уровням и подуровням.
Слайд 11Пример образования парамагнитного высокоспинового (спин-свободного) КС
[Cr(NH3)6]3+
24Cr 3s23p64s13d54p0
Cr3+
3s23p64s03d34p0
NH3
* *
* ** *
* * * * * *
3d
4s
4p
Тип гибридизации d2sp3
**
Слайд 12Пример образования диамагнитного низкоспинового (спин-спаренного) КС
[Co(NH3)6]3+
27Co 3s23p6 4s23d74p0
Co3+
3s23p6 4s03d64p0
3d
4s
4p
* *
* ** *
* * * * * *
3d
4s
4p
Тип гибридизации d2sp3
3d
4s
4p
NH3
**
Низкоспиновые комплексы, как правило, меньше по размеру. Этот феномен обуславливает важнейшую биологическую функцию – транспорт О2 гемоглобином.
Слайд 13Пример образования высокоспинового внешнеорбитального комплекса
Оба предыдущих примера показывают образование
внутриорбитальных комплексов, т.к. размещение электронных пар лигандов начинается с внутренних
3d-орбиталей.Образование внешнеорбитального комплекса иллюстрирует пример
[CoF6]3– F–
Тип гибридизации sp3d2
3d
* *
* * * * * *
4s
4p
* *
* *
4d
**
Слайд 14Классификация лигандов по «силе»…
… проводится на основе квантовомеханической теории поля
лигандов (ТПЛ).
Сильные лиганды обладают способностью спаривать электроны комплексообразователя, слабые –
никогда.I–< Br–< Cl–= SCN–< F–< H2O< NO2–< ЭДТА< NH3
Образование низко- и высокоспиновых комплексов зависит также:
от степени окисления (СО) комплексообразователя: чем выше СО, тем лучше идёт спаривание электронов;
от размера d-орбитали комплексообразователя: чем больше размер, тем лучше идёт спаривание электронов.
Слабые
Сильные
Средней силы
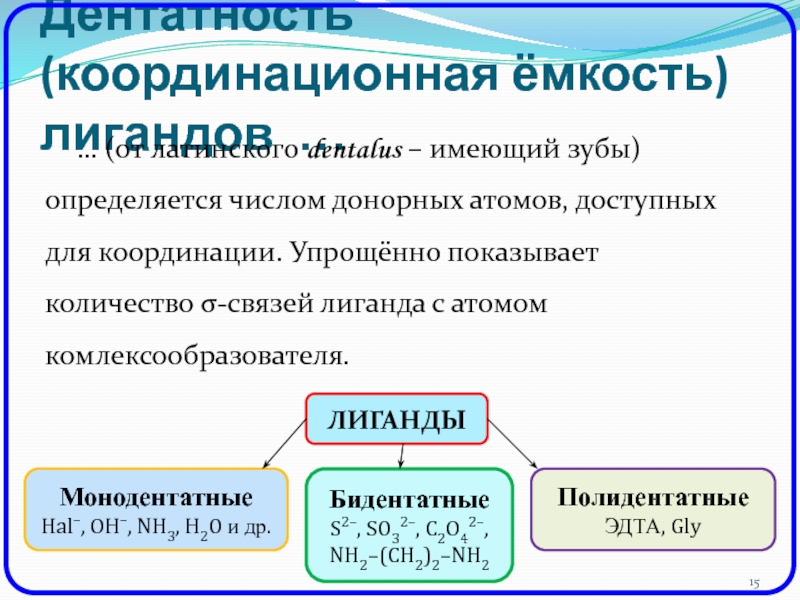
Слайд 15Дентатность (координационная ёмкость) лигандов …
… (от латинского dentalus – имеющий
зубы) определяется числом донорных атомов, доступных для координации. Упрощённо показывает
количество σ-связей лиганда с атомом комлексообразователя.ЛИГАНДЫ
Монодентатные
Hal–, OH–, NH3, H2O и др.
Бидентатные
S2–, SO32–, C2O42–,
NH2–(CH2)2–NH2
Полидентатные
ЭДТА, Gly
Слайд 16Классификация комплексных соединений
Хелаты (от греческого χλατ – клешня) образуются за
счёт способности полидентатных лигандов координироваться к комплексообразователю сразу в нескольких
точках.В разработку теории хелатов большой вклад внёс советский учёный Л.А. Чугаев.
Меn+
Диглицинатомедь (II)
Слайд 17Классификация комплексных соединений
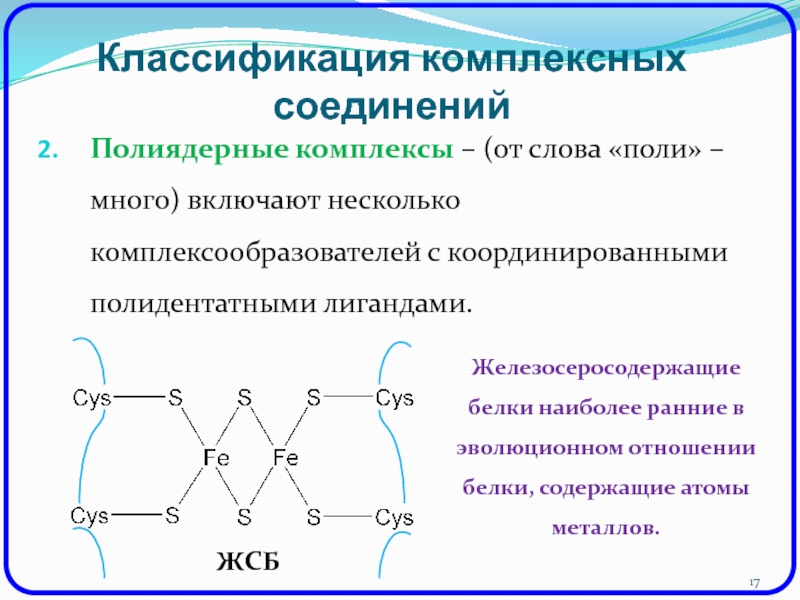
Полиядерные комплексы – (от слова «поли» – много)
включают несколько комплексообразователей с координированными полидентатными лигандами.
Железосеросодержащие белки наиболее
ранние в эволюционном отношении белки, содержащие атомы металлов.
Слайд 18Классификация комплексных соединений
Макроциклические комплексы – комплексообразователь («гость») размещается во внутренней
полости полидентатного лиганда («хозяин») и изолирован от окружающей среды. Данные
соединения широко распространены в природе: гемоглобин, хлорофилл, цианокобаламин и др.
Слайд 19Поведение КС в растворах
Способность КС к диссоциации
[Cr(NH3)6]Cl3 →[Cr(NH3)6]3+ + 3Cl–
[Cr(NH3)6]3+
↔ Cr3+ + 6NH3
Процесс b характеризуется термодинамическими константами: нестойкости (Кн)
и устойчивости (β).
Слайд 20Поведение КС в растворах
Способность КС к замене лигандов
[Zn(H2O)4]2+ + 4NH3
↔ [Zn(NH3)4]2+ + 4H2O
Лабильный комплекс – комлекс, полностью обменивающий лиганды
в течение 1 минуты при t=25°С.Инертный комплекс – комплекс, практически не обменивающий лиганды.
Слайд 21Номенклатура КС …
… язык, который в названии передаёт строение КС.
Порядок
составления названия КС:
Координационное число (моно-, ди-, три-, тетра-, пента-, гекса-
и т.д.).Название лиганда (если несколько, то первыми называют анионы с окончанием «о», искл. Н2О – «аква», NH3 – «аммин», затем нейтральные молекулы; перечисление в алфавитном порядке).
Слайд 22Номенклатура КС …
Название комплексообразователя (в комплексном катионе русские названия, в
комплексном анионе латинские названия с суффиксом «ат». После названия комплексообразователя
в скобках указывают его СО).Пример: [Cr(NH3)6]3+Cl3 гексааммин хрома (III) хлорид
[CoF6]3–Na3 гексафторокобальтат (III) натрия
[Pt(NH3)3Cl]Cl хлоротриаммин платины (II) хлорид
Слайд 23Комплексообразующая способность s-, p-, d- элементов
s- элементы, в принципе не
должны давать КС, т.к. не имеют низких по энергии свободных
орбиталей. Однако дают КС, но только с полидентатными лигандами.d-элементы – типичные комплексообразователи, т.к. d-подуровни у них заполнены не полностью. Самые прочные КС образуют d-элементы с электронной конфигурацией иона d6.
Слайд 24Изолированное лигандообменное равновесие
реализуется при диссоциации комплексного иона, который является слабым
электролитом, т.к. связь между комплексообразователем и лигандом донорно-акцепторная.
[Fe(SCN)6]3− ↔
Fe3+ + 6SCN−Константа равновесия данного процесса получила название константы нестойкости (Кн):
Чем меньше значение Кн, тем прочнее комплекс.
Слайд 25Классификация биокомплексов (БК) по устойчивости
I группа: прочные БК с маленькой
Кн. Теряют биоактивность при замене и комплексообразователей (КО), и лигандов
(Л), например: гемоглобин (Hb), цитохромы, каталаза, хлорофилл, витамин В12.II группа: непрочные БК с большой Кн. Биоактивность их падает незначительно при замене и КО, и Л. Нужны для выполнения определённых функций в организме, например:
Фермент + Ме-активатор → Компл. соед. → →Фермент + Ме-активатор
Слайд 26Совмещённые лигандообменные равновесия
Zn2+
Кн1
S − белок
Hg2+
Кн2
Вывод: в совмещённых лигандообменных равновесиях
(СЛОР) доминирует тот процесс, в котором образуется более прочный комплекс
с меньшей Кн.В нашем случае Кн2 < Кн1.
1-й тип
Слайд 27Совмещённые лигандообменные равновесия
О2
Кн1
Fe2+
CO
Кн2
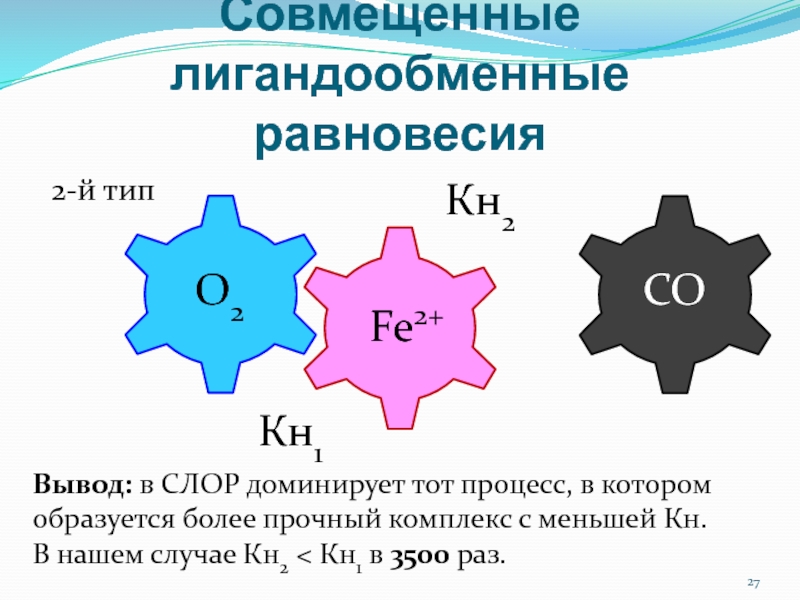
Вывод: в СЛОР доминирует тот процесс, в
котором образуется более прочный комплекс с меньшей Кн.
В нашем
случае Кн2 < Кн1 в 3500 раз.2-й тип
Слайд 29Металлолигандный гомеостаз
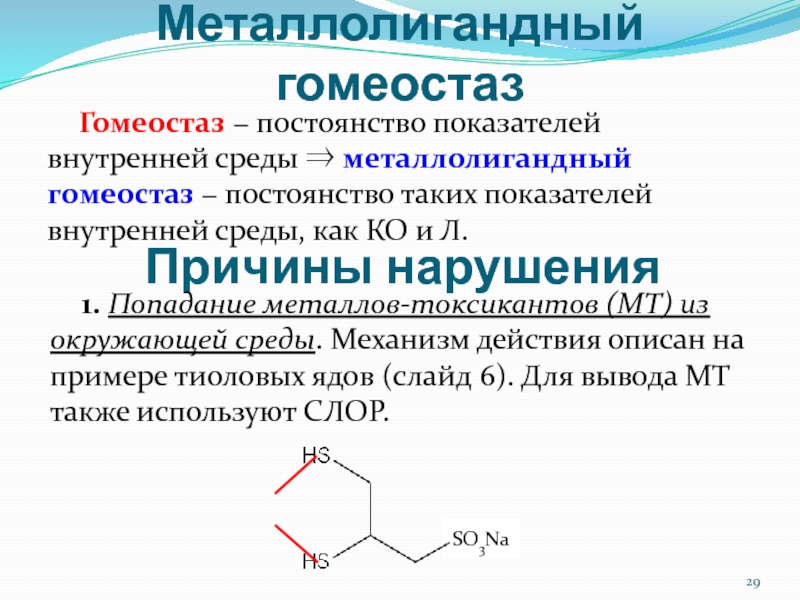
Гомеостаз − постоянство показателей внутренней среды ⇒ металлолигандный гомеостаз
− постоянство таких показателей внутренней среды, как КО и Л.
Причины
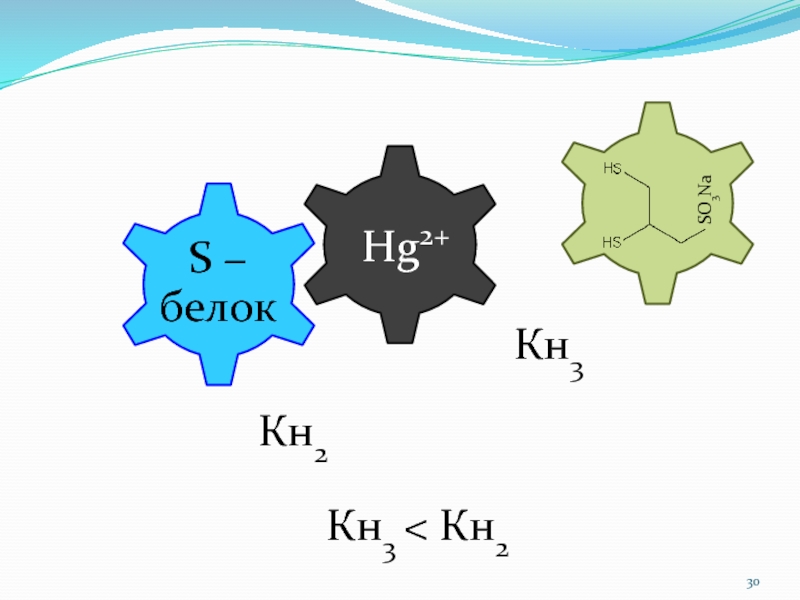
нарушения1. Попадание металлов-токсикантов (МТ) из окружающей среды. Механизм действия описан на примере тиоловых ядов (слайд 6). Для вывода МТ также используют СЛОР.
Hg2+
SO3Na
Слайд 312. Высокая или низкая концентрация микроэлементов в продуктах питания.
Дефицит микроэлементов
чаще всего наблюдается в, так называемых, биогеохимических провинциях и способствует
развитию эндемических заболеваний.Пример: акобальтоз (Бурятия), молибденовая подагра (Дагестан) и др.
Причины нарушения
Слайд 32Причины нарушения
Избыток микроэлементов также ведёт к нарушению метаболических процессов.
Пример: болезнь
«любителей пива» из-за избытка СoCl2, повышенная концентрация Cu2+ во французских
и Fe3+ в итальянских винах.Слайд 333. Попадание в организм лигандов-токсикантов из окружающей среды. Механизм действия
описан выше.
Некоторые Л в организме образуют прочный комплекс с Cu2+,
входящей в состав фермента лизилоксидаза. Фермент разрушается, что приводит к нарушению синтеза коллагена и развивается Lathyrism.
Причины нарушения
LATHYRISM
Слайд 34В состав чая, кофе и соевого белка входят полифенольные соединения,
выполняющие роль лигандов и образующие прочный комплекс с ионами железа,
тормозя его всасывание ⇒ анемия.Причины нарушения
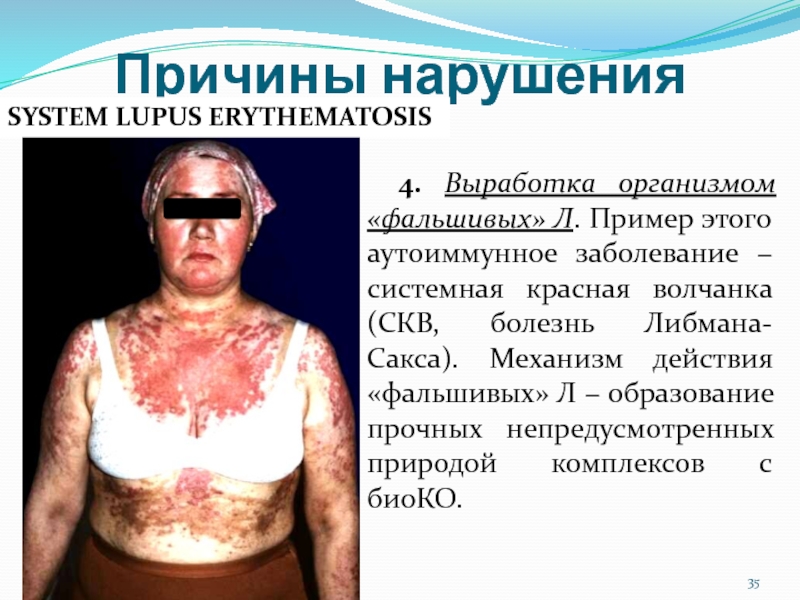
Слайд 354. Выработка организмом «фальшивых» Л. Пример этого аутоиммунное заболевание −
системная красная волчанка (СКВ, болезнь Либмана-Сакса). Механизм действия «фальшивых» Л
− образование прочных непредусмотренных природой комплексов с биоКО.Причины нарушения
SYSTEM LUPUS ERYTHEMATOSIS
Слайд 36Термодинамические принципы хелатотерапии
I − биоКО, необходимый организму;
Е − биоЛ, необходимый
организму;
Т − КО-токсикант из окружающей среды;
D − Л-детоксикант.
Основные принципы использования
лекарств для лечения больных:1. связать токсикант: принцип выполняется, если Кн(ТD) < Кн(ТЕ);
2. не навредить организму: принцип выполняется, если Кн(ID) > Кн(IЕ)
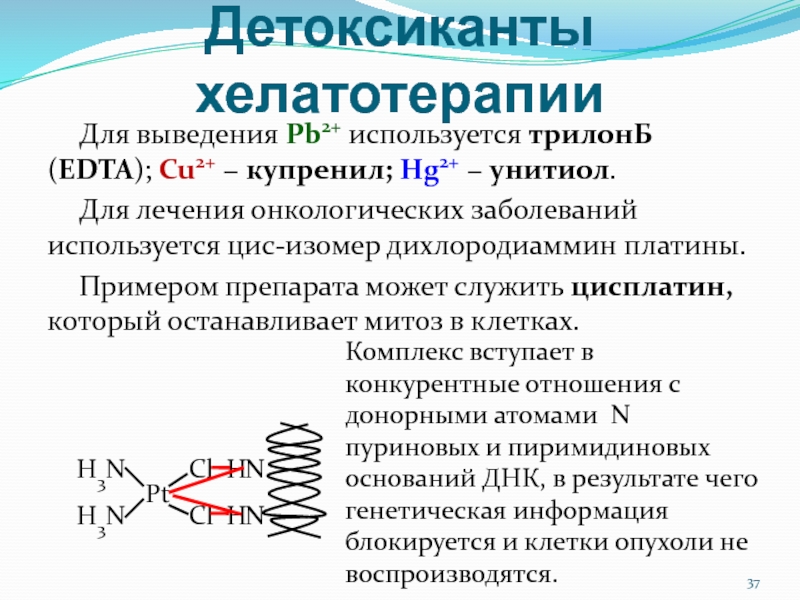
Слайд 37Детоксиканты хелатотерапии
Для выведения Pb2+ используется трилонБ (EDTA); Cu2+ − купренил;
Hg2+ − унитиол.
Для лечения онкологических заболеваний используется цис-изомер дихлородиаммин платины.
Примером
препарата может служить цисплатин, который останавливает митоз в клетках.Н3N
Н3N
Pt
Cl
Cl
N
Н
N
Н
Комплекс вступает в конкурентные отношения с донорными атомами N пуриновых и пиримидиновых оснований ДНК, в результате чего генетическая информация блокируется и клетки опухоли не воспроизводятся.







![Строение комплексных соединений Недостатки координационной теорииСвязь между ядром и внешней сферой ионная, поэтому, в Недостатки координационной теорииСвязь между ядром и внешней сферой ионная, поэтому, в растворе КС диссоцируют по уравнению[Cr(NH3)6]Cl3 ↔](/img/thumbs/2797ba6a5c3cbd8a394a837abc9fb1b7-800x.jpg)

![Строение комплексных соединений Пример образования парамагнитного высокоспинового (спин-свободного) КС[Cr(NH3)6]3+24Cr 3s23p64s13d54p0 Cr3+ 3s23p64s03d34p0 NH3 Пример образования парамагнитного высокоспинового (спин-свободного) КС[Cr(NH3)6]3+24Cr 3s23p64s13d54p0 Cr3+ 3s23p64s03d34p0 NH3](/img/thumbs/2aa75b9b7027bd40ebff3e12e860eb4f-800x.jpg)
![Строение комплексных соединений Пример образования диамагнитного низкоспинового (спин-спаренного) КС[Co(NH3)6]3+27Co 3s23p6 4s23d74p0 Co3+ 3s23p6 4s03d64p03d4s4p Пример образования диамагнитного низкоспинового (спин-спаренного) КС[Co(NH3)6]3+27Co 3s23p6 4s23d74p0 Co3+ 3s23p6 4s03d64p03d4s4p](/img/thumbs/d864b4f486d7895df751d77f3970e1bc-800x.jpg)




![Строение комплексных соединений Поведение КС в растворахСпособность КС к диссоциации[Cr(NH3)6]Cl3 →[Cr(NH3)6]3+ + 3Cl–[Cr(NH3)6]3+ ↔ Поведение КС в растворахСпособность КС к диссоциации[Cr(NH3)6]Cl3 →[Cr(NH3)6]3+ + 3Cl–[Cr(NH3)6]3+ ↔ Cr3+ + 6NH3Процесс b характеризуется термодинамическими](/img/thumbs/b4ffa439b8988998746a2b9ab6797f57-800x.jpg)
![Строение комплексных соединений Поведение КС в растворахСпособность КС к замене лигандов[Zn(H2O)4]2+ + 4NH3 ↔ Поведение КС в растворахСпособность КС к замене лигандов[Zn(H2O)4]2+ + 4NH3 ↔ [Zn(NH3)4]2+ + 4H2OЛабильный комплекс – комлекс,](/img/thumbs/f2d2b02a808bc997c2def4f6ac5a3dab-800x.jpg)