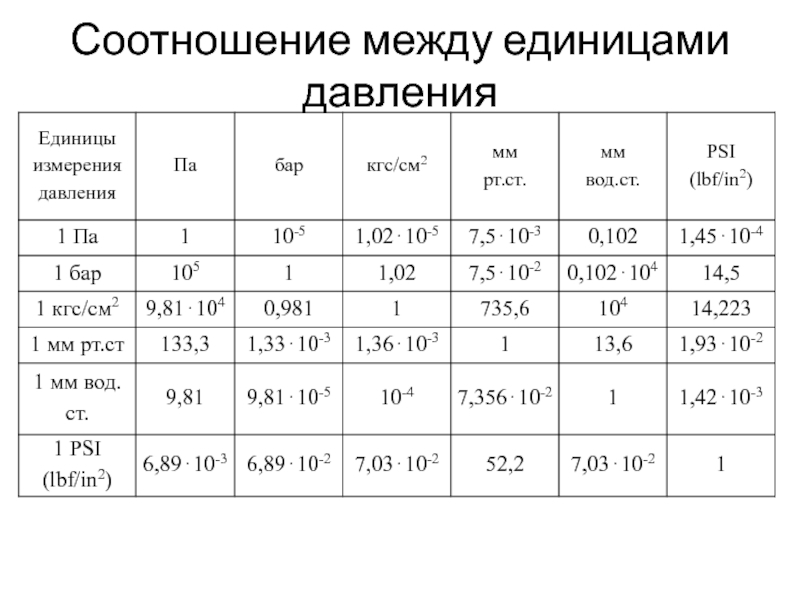
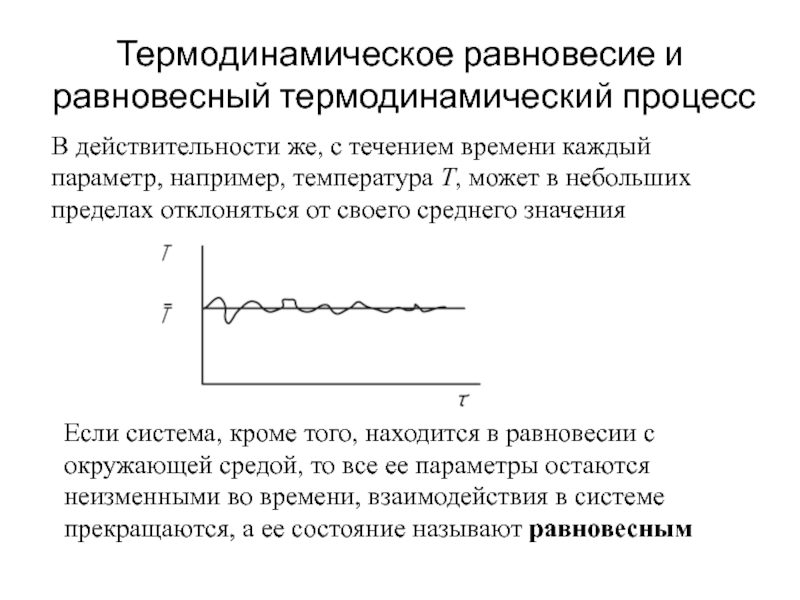
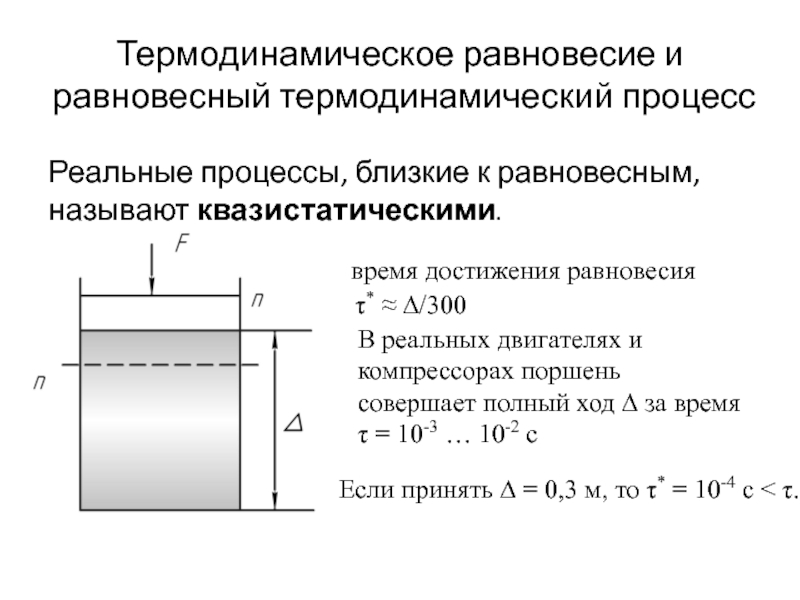
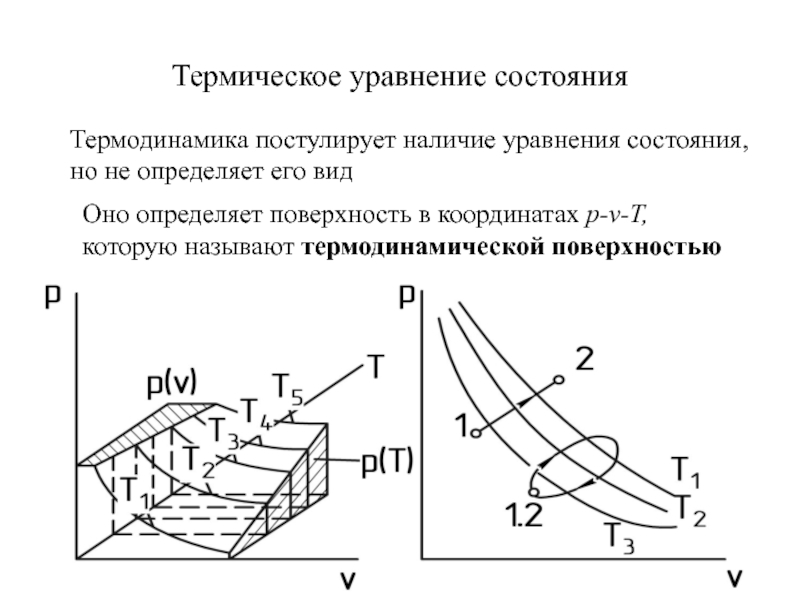
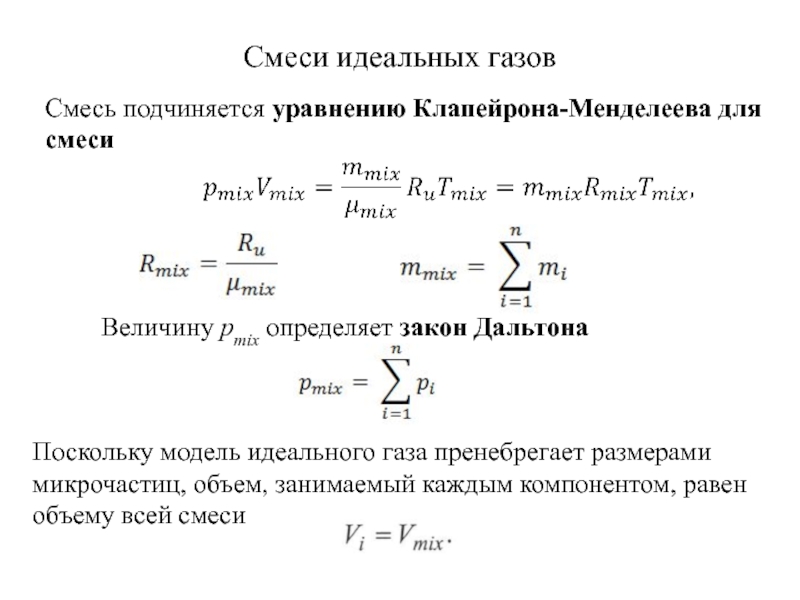
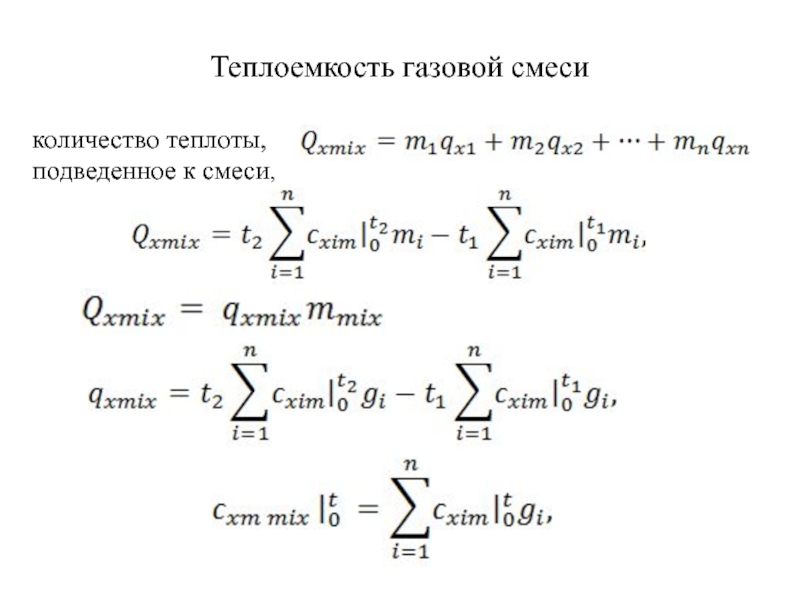
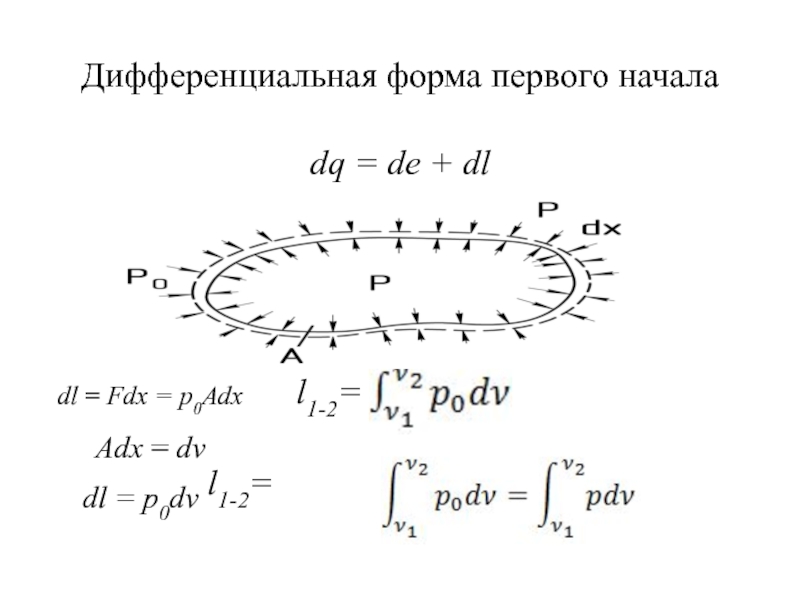
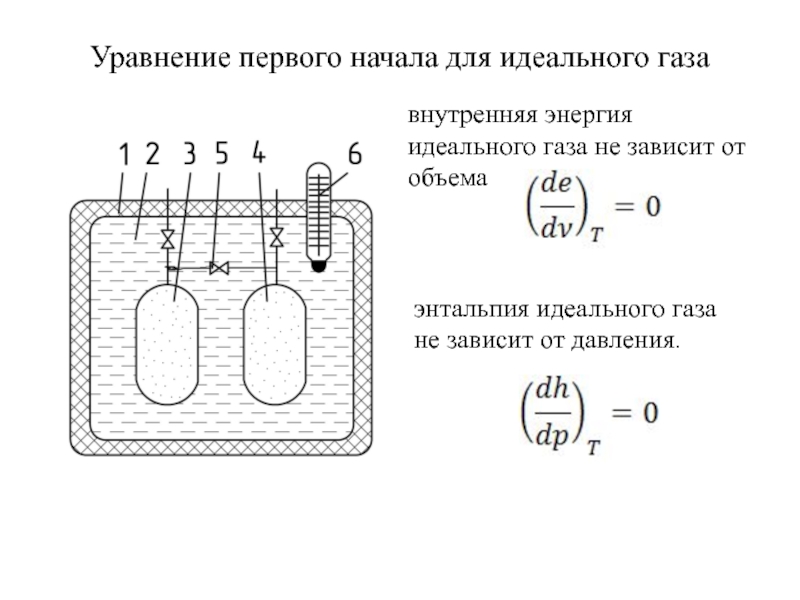
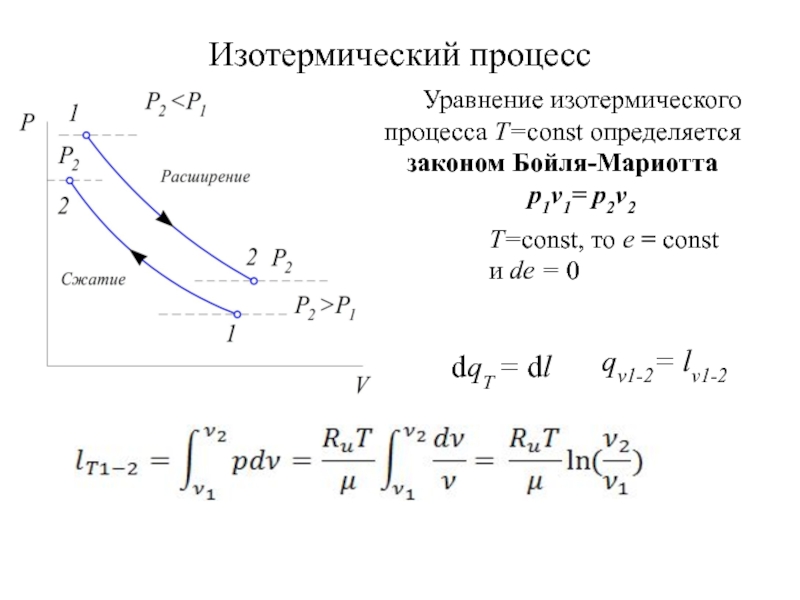
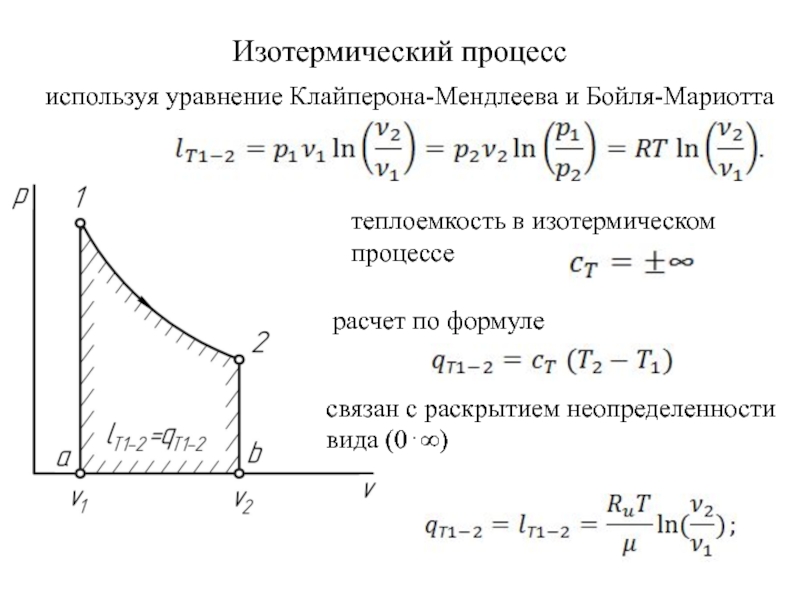
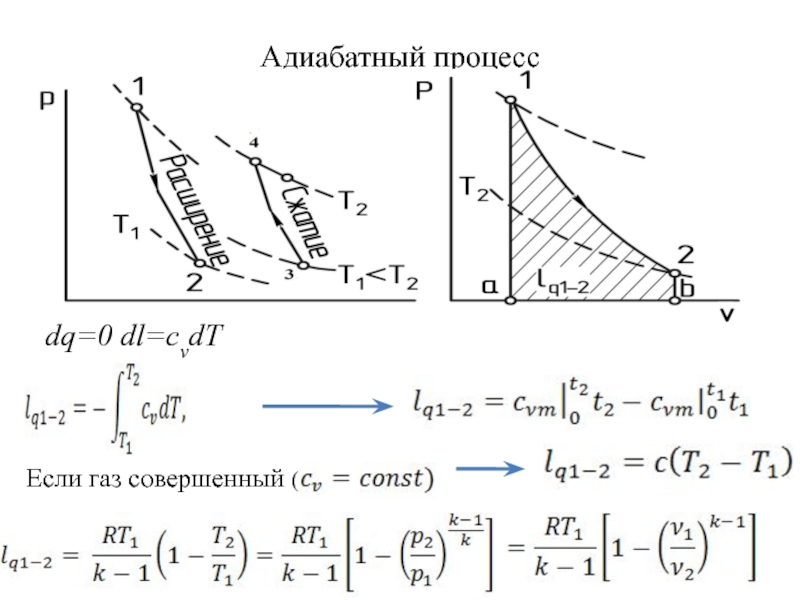
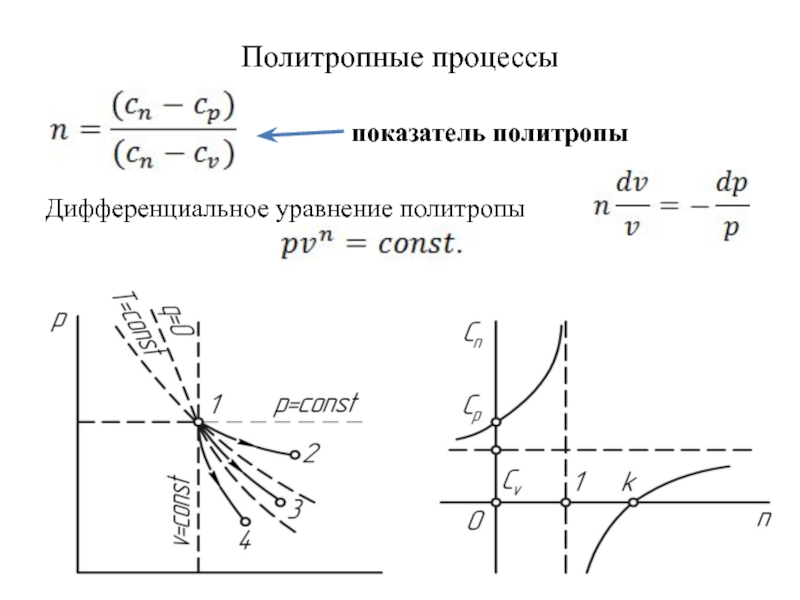
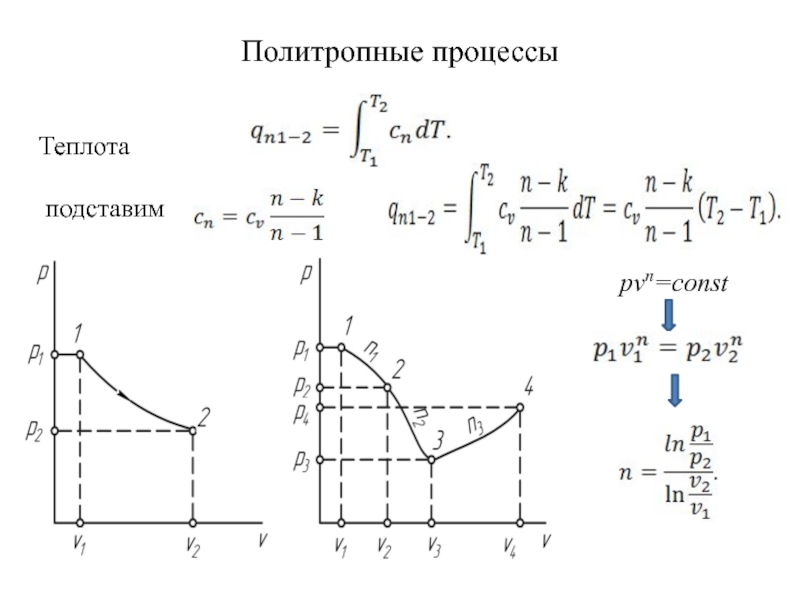
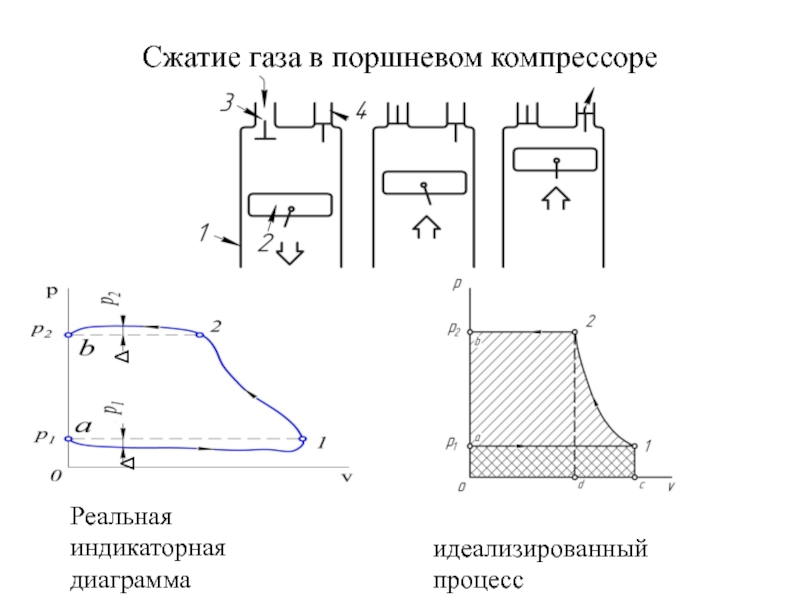
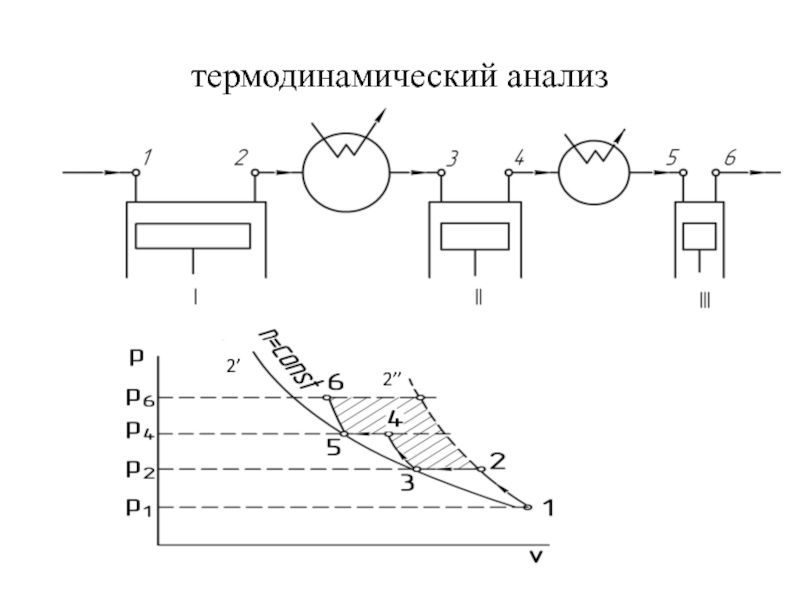
быть:
-достаточно обширной и сложной, чтобы в ней соблюдались статистические закономерности
-замкнутой, т. е. иметь пределы во всех пространственных направлениях и состоять из конечного числа частиц