Слайд 2f-блок в периодической таблице элементов — электронная оболочка атомов, валентные
электроны которых с наивысшей энергией занимают f-орбиталь.
В данный блок входят
актиноиды и лантаноиды.
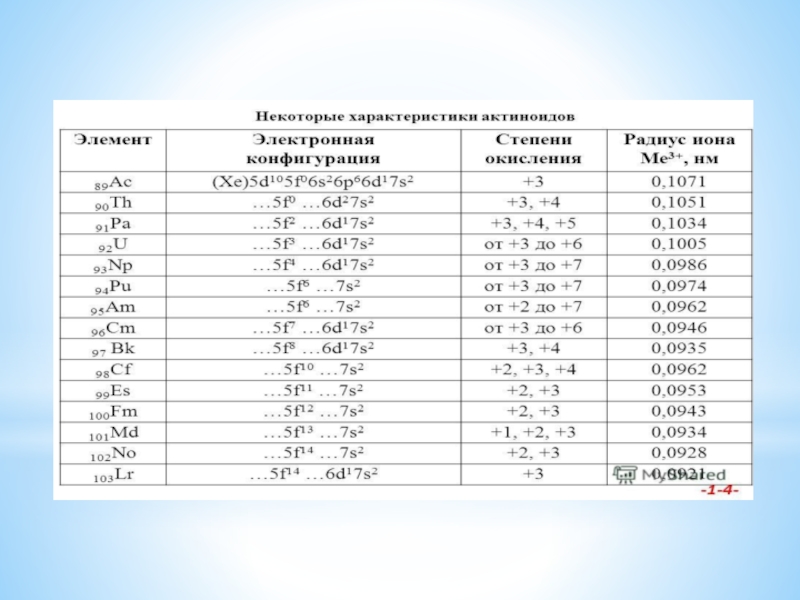
Фактическая электронная конфигурация элементов, входящих в этот блок, может отличаться от истинной и не может не подпадать под определение правила Клечковского. Данный блок делится на две группы:Элементы, у которых электроны находятся на 4f-орбитали, относятся к лантаноидам,
Элементы, у которых электроны находятся на 5f-орбитали, относятся к актиноидам.
Существует давний спор относительно того какие элементы следует относить к данным группам: актиний и лантан, или же лютеций и лоуренсий. Это связано с тем, что количество f-электронов, находящихся на внешнем электронном слое, может быть только 14
Слайд 4f-Элементы делятся на лантаноиды и актиноиды.
Лантаноиды – это 14 элементов,
следующих за лантаном, у которых к электронной конфигурации лантана последовательно
добавляются 14 4f-электронов.Общая электронная конфигурация лантаноидов – 4f2–145d0–16s2.
У церия на 4f-уровне находятся два электрона – один за счет увеличения порядкового номера по сравнению с лантаном на единицу, а другой переходит с 5d-уровня на 4f. До гадолиния происходит последовательное увеличение числа электронов на 4f-уровне, а уровень 5d остается незанятым. У гадолиния дополнительный электрон занимает 5d-уровень, давая электронную конфигурацию 4f75d16s2, а у следующего за гадолинием тербия происходит, аналогично церию, переход 5d-электрона на 4f-уровень (4f96s2). Далее до иттербия наблюдается монотонное увеличение числа электронов до 4f14, а у завершающего ряд лютеция вновь появляется 5d-электрон (4f145d16s2).
Слайд 6
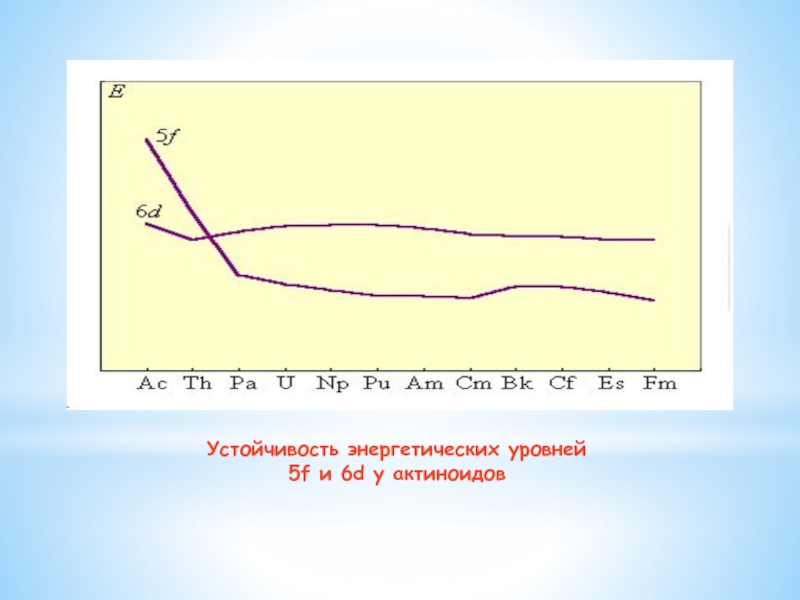
Устойчивость энергетических уровней 5f и
6d у актиноидов
Слайд 7Отличия актиноидов и лантаноидов что у актиноидов энергетические уровни 5f
и 6d стабилизируются по мере возрастания атомного ядра несколько иным
способом, чем у лантаноидов: у легких актиноидов более устойчивы 6d-орбитали, а у тяжелых – 5f
Для элементов с атомными номерами 90–95 энергия 5f- и 6d-подуровней примерно одинакова. Этим объясняются различия в химии актиноидов и лантаноидов. У элементов с атомными номерами 91–95 (Th–Am) электронные переходы происходят легко. Эти элементы поливалентны и в этом подобны d-элементам. Более того, для них степень окисления III вообще мало характерна. Получен семивалентный нептуний, уран легко может быть переведен в шестивалентное состояние, протактиний проявляет степень окисления пять, а для тория трудно получить соединения, в которых он имел бы степень окисления ниже четырех.
Однако по мере заполнения 5f-уровней электронные конфигурации атомов стабилизируются, переход 5f-электронов в 6d-состояние становится все более затрудненным. Поэтому элементы Bk–Lr, ведут себя как типичные f-элементы, а по свойствам близки к лантаноидам. Для них основной степенью окисления является III.

Слайд 8С водородом актиноиды образуют гидриды переменного состава (ThH2, Th4H15; PaH2–2,7;
AmH2–2,7), но для урана можно получить и стехиометрический гидрид UH3.
В общем случае гидриды этих элементов термически менее устойчивы, чем гидриды 4f-элементов. С кислородом актиноиды образуют оксиды, соответствующие их наиболее устойчивым степеням окисления (ThO2, PaO2, Pa2O5, NpO2 и др.). К исключительно сложным следует отнести систему уран–кислород. Характерными для урана являются оксиды UO2 – UO2,25; U3O8 и UO3, из них наиболее устойчив U3O8 (UO2∙2UO3) – урановая смолка.
Отличительной особенностью кислородсодержащих соединений актиноидов в высших степенях окисления V, VI является наличие катионных группировок и или , . Эти группировки называются иловыми оксоионами. Например, – уранил, – протактинил. Оксоионы устойчивы и сохраняются без изменения в разнообразных химических реакциях:
Слайд 9Особая устойчивость оксоионов объясняется тем, что связь между атомами актиноида
и кислорода формально можно рассматривать как тройную:
Для ионов прочность
связи увеличивается в ряду Am < Pu < Np.
С галогенами актиноиды образуют многообразные галогениды ЭГn, где n = 3, 4, 5, 6. Фториды элементов в высших степенях окисления летучи, что позволило разделить изотопы урана 235U и 238U. Взаимодействие актиноидов с B, Si, C, N, P, S и Se приводит к образованию соединений нестехиометрического состава вследствие возможного присутствия элемента в разных степенях окисления.
Уменьшение радиусов элементов в ряду Th–Lr приводит к ослаблению основных свойств соединений.
Соединения актиноидов склонны к диспропорционированию.
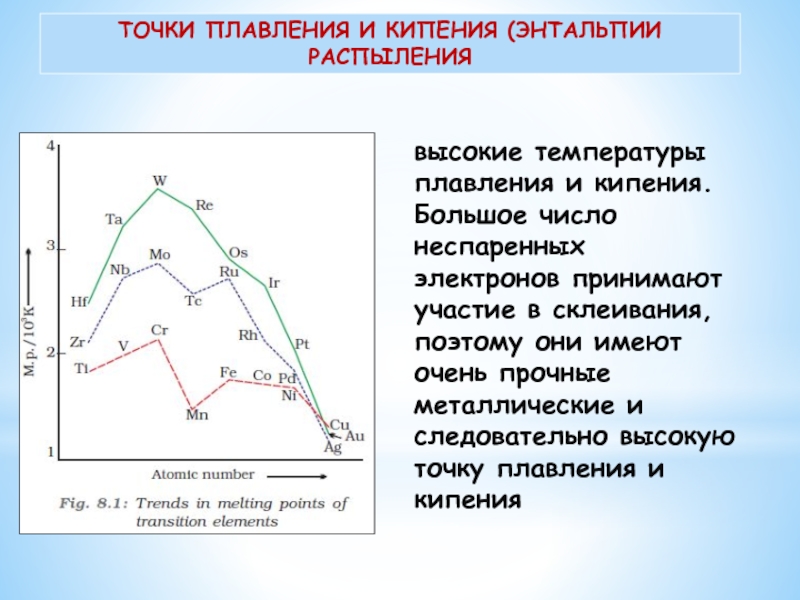
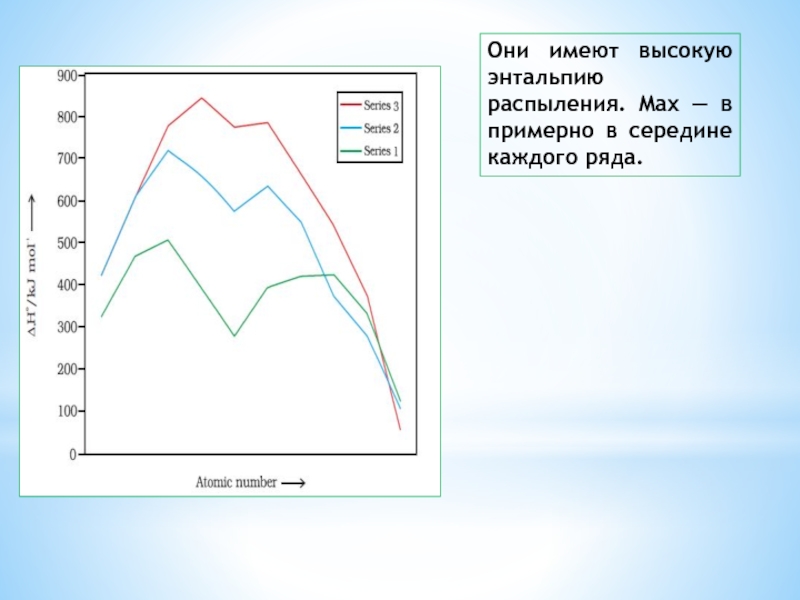
Слайд 12ТОЧКИ ПЛАВЛЕНИЯ И КИПЕНИЯ (ЭНТАЛЬПИИ РАСПЫЛЕНИЯ
высокие температуры плавления
и кипения. Большое число неспаренных электронов принимают участие в склеивания,
поэтому они имеют очень прочные металлические и следовательно высокую точку плавления и кипения
Слайд 13Они имеют высокую энтальпию распыления. Max — в примерно в
середине каждого ряда.
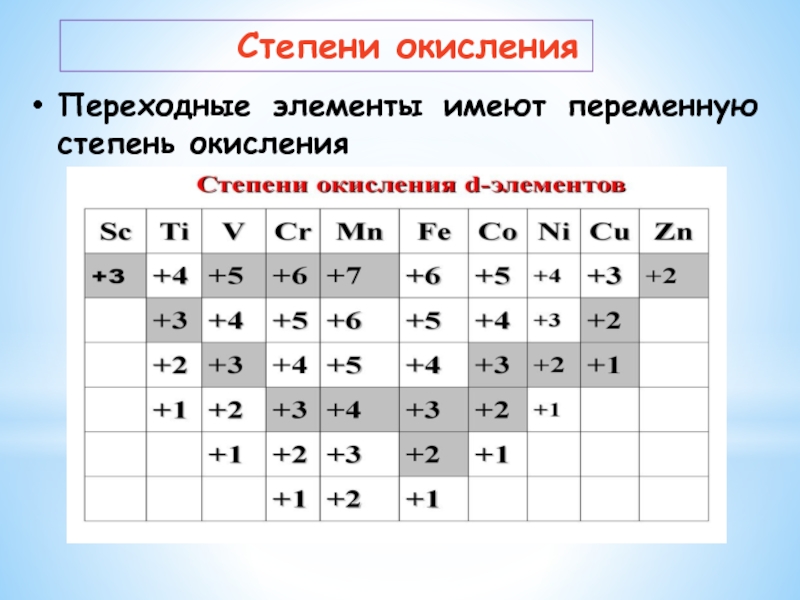
Слайд 14Переходные элементы имеют переменную степень окисления
Степени окисления
Слайд 15Большинство соединений переходных металлов (ионный а также ковалентные) окрашены как
в твердом состоянии и в водном растворе. Обычно элементы/ионов, непарные
электронов производят цветные соединения.
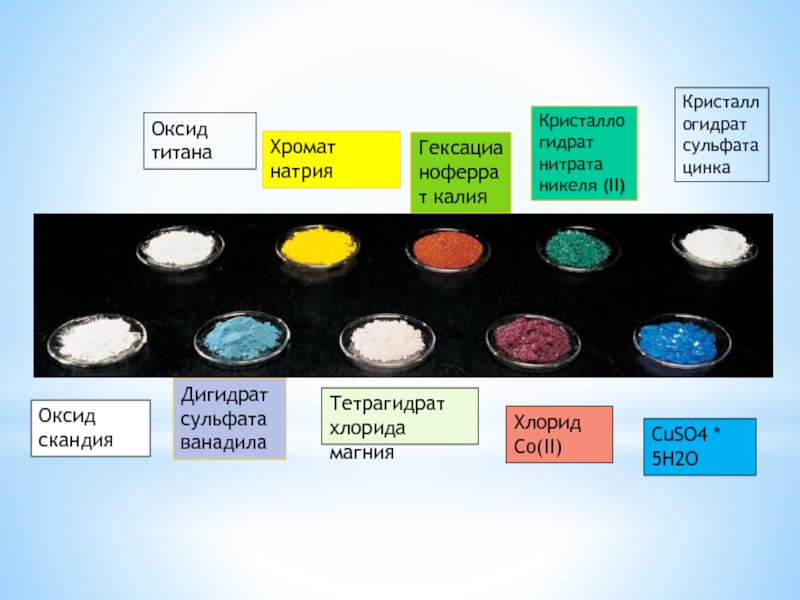
ЦВЕТНЫЕ ИОНЫ
Слайд 16
Оксид скандия
Дигидрат сульфата ванадила
Оксид титана
Хромат натрия
Гексацианоферрат калия
Кристаллогидрат нитрата никеля
(II)
Кристаллогидрат сульфата цинка
Тетрагидрат хлорида магния
Хлорид Co(II)
CuSO4 *
5H2O
Слайд 17Химические свойства d-элементов
Сравнение d- и р-элементов в высших СО
Группа
р-элементы
d-элементы
VII
VI
V
HClO4
H2SO4
HPO3 (HNO3)
HMnO4
H2CrO4
HVO3
Слайд 18VIIB
Mn: II, IV, VI, VII
TcRe
(IV,V) VII
VIB
Cr: II, III, VI
MoW
(IV, V),
VI
VB
V: II, III, IV, V
Nb Ta
(III,IV), V
Устойчивость высшей степени окисления
в В-подгруппах
В отличии от s- и p-элементов у d-элементов устойчивость высшей СО возрастает вниз по подгруппе:
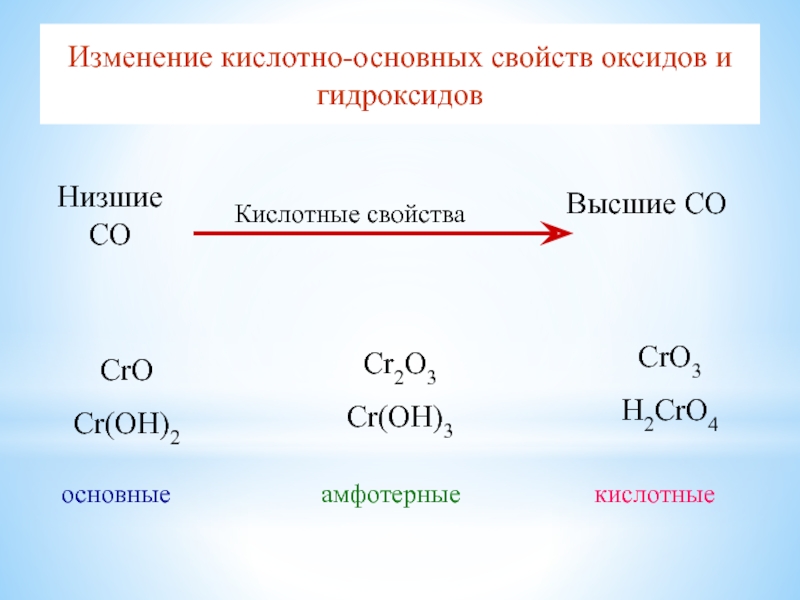
Слайд 19Изменение кислотно-основных свойcтв оксидов и гидроксидов
CrO
Cr(OH)2
основные
Cr2O3
Cr(OH)3
CrO3
H2CrO4
амфотерные
кислотные
Низшие СО
Высшие СО
Кислотные свойства
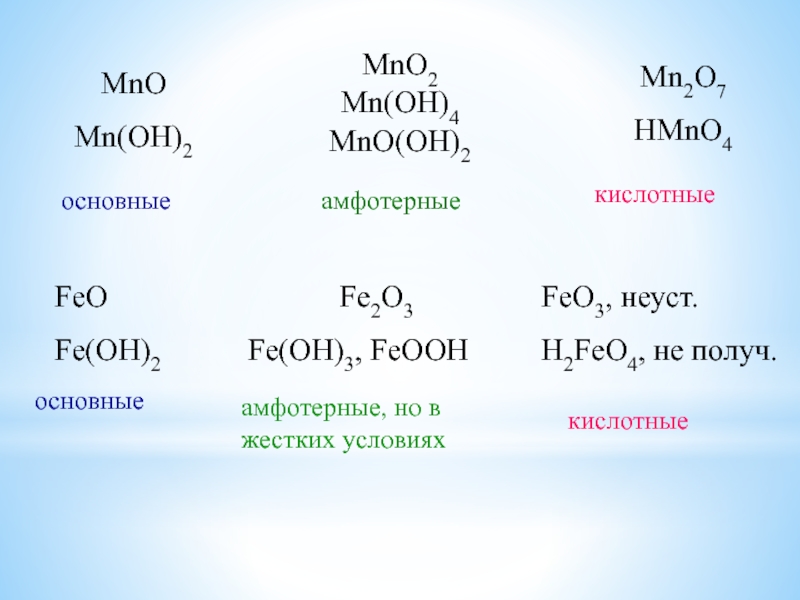
Слайд 20MnO
Mn(OH)2
MnO2
Mn(OH)4
MnO(OH)2
Mn2O7
HMnO4
основные
амфотерные
кислотные
FeO
Fe(OH)2
Fe2O3
Fe(OH)3, FeOOH
FeO3, неуст.
H2FeO4, не получ.
основные
амфотерные, но в жестких условиях
кислотные
Слайд 21Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O
Cr(OH)3 + NaOH =
Na[Cr(OH)4]
тетрагидроксохромит натрия
Cr2O3 + NaOH = NaCrO2 + H2O
хромит натрия
t
СrO3
-
кислотный оксид
CrO3 + KOH = K2CrO4 + H2O
хромат калия
В кислой среде хроматы переходят в дихроматы:
СrO42- + H+ = Cr2O72- + H2O
Слайд 22Fe2O3
- обладает амфотерными свойствами, но в жестких условиях:
Fe2O3 +
HCl = FeCl3 + H2O
Fe2O3 + KOH = KFeO2 +
H2O
феррит калия
t
Ферриты - соли
железистой кислоты HFeO2
Zn + HCl = ZnCl2 + H2
Амфотерными являются оксид и гидроксид цинка: ZnO, Zn(OH)2
Zn + NaOH + H2O = Na2[Zn(OH)4] + H2
ZnO + NaOH = Na2[Zn(OH)4]
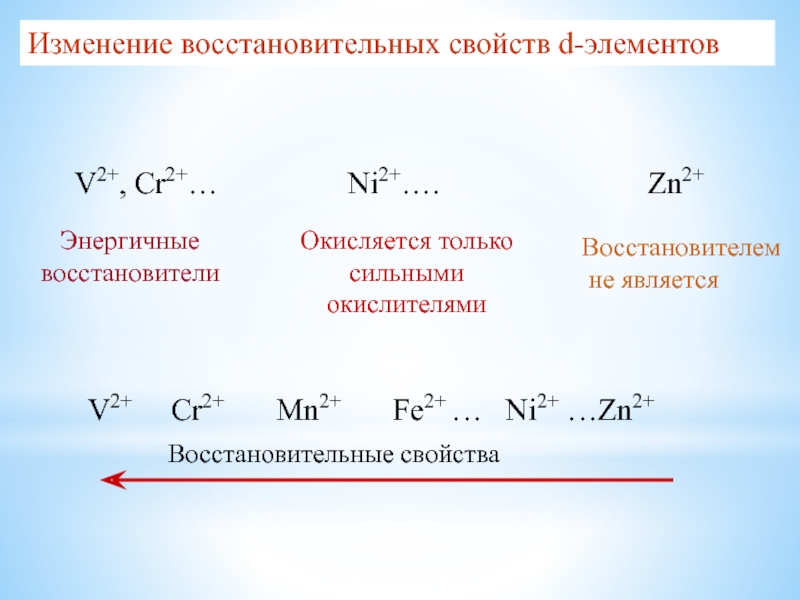
Слайд 23V2+, Cr2+…
Ni2+….
Zn2+
Энергичные восстановители
Окисляется только сильными окислителями
V2+ Cr2+
Mn2+ Fe2+
… Ni2+ …Zn2+
Восстановительные свойства
Изменение восстановительных свойств d-элементов
Восстановителем
не является
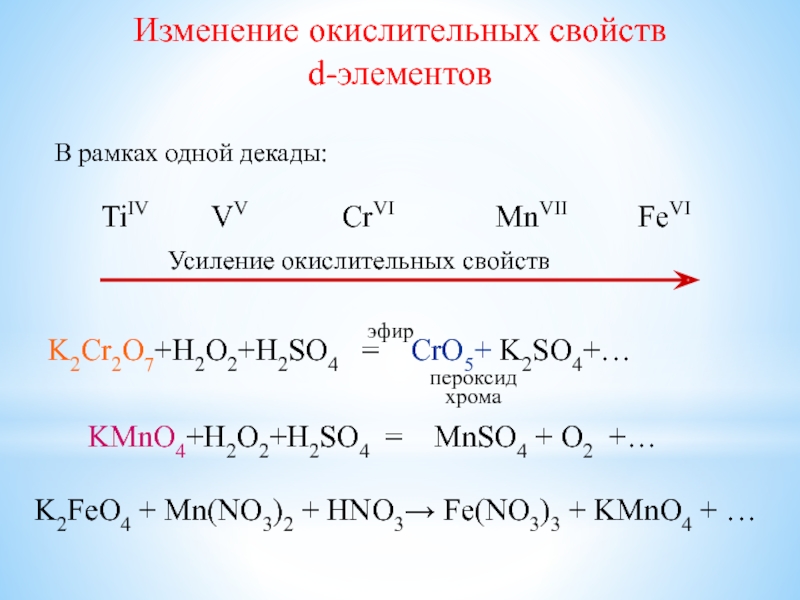
Слайд 24Изменение окислительных свойств
d-элементов
В рамках одной декады:
TiIV
VV CrVI
MnVII FeVI
Усиление окислительных свойств
K2Cr2O7+H2O2+H2SO4 = CrO5+ K2SO4+…
KMnO4+H2O2+H2SO4 = MnSO4 + O2 +…
эфир
пероксид хрома
K2FeO4 + Mn(NO3)2 + HNO3 Fe(NO3)3 + KMnO4 + …
Слайд 25Cr(OH)2 + H2O + O2 = Cr(OH)3
В степени +II соединения
хрома являются сильными восстановителями:
Cоли Fe(II) легко окисляются и переходят в
Fe(III)
FeSO4 + Cl2 = FeCl3 + Fe2(SO4)3
Окисление солей железа (III) в щелочной среде приводит к образованию ферратов - соединений железа (VI)
Fe2O3 + Cl2 + KOH = K2FeO4 + KCl + H2O
t
окислительно-щелочное плавление
Слайд 26Дихроматы и хроматы являются сильными окислителями:
K2Cr2O7 + KJ + H2SO4
= J2 + Cr2(SO4)3 + K2SO4 + H2O
Перманганаты - сильнейшие
окислители:
MnO4-
Mn2+
MnO2
MnO42-
(pH 7)
(pH 7)
(pH 7)
Ферраты - сильнейшие окислители
Слайд 27CoCl2 + 4KSCN K2[Co(SCN)4] + 2KCl
Эту способность используют:
1) для
очистки d-элементов от примесей
Ni + 4CO = [Ni(CO)4]
Тетракарбонил никель
Для d-элементов
характерно образование комплексных соединений.
Карбонилы являются особым типом комплексных соединений.
[Fe(CO)5]
[Co(CO)4]
тетракарбонил кобальта
пентакарбонил железа
Слайд 28РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Li Cs Ca Na Mg Al Zn Fe
Ni Pb H2 Cu Ag Hg Au
Усиление восстановительной способности атомов
Усиление
окислительной способности ионов
Li+Ca2+Na+Mg2+Al3+Zn2+Fe2+Ni2+Pb2+H+Cu2+Ag+Hg2+Au3+
Слайд 29Растворение металлов в кислотах и щелочах
1. Кислоты неокислители: HCl, H2SO4,
HBr…
Zn + HCl = H2 + ZnCl2
2. Кислоты окислители: HNO3,
H2SO4конц, …
Hg + HNO3изб = Hg(NO3)2 + NO + H2O
Cd + H2SO4конц = CdSO4 + SO2 + H2O
Sn + HNO3конц = H2SnO3 + NO2 + H2O
Fe + HCl = H2+ FeCl2
- оловянная кислота
Слайд 303. Смеси кислот: HNO3 + HCl – «царская водка»
HNO3 +
HF
Nb + HNO3 + HF = H2[NbF7] + NO +
H2O
4. Взаимодействие с щелочами:
Zn + NaOH + H2O = Na2[Zn(OH)4] + H2
Ge + O2 + 2NaOH + 2H2O = Na2[Ge(OH)6]
Ag + HNO3 + HCl = H[AgCl2] + NO + H2O
Слайд 315. Взаимодействие с гидратом аммиака:
Zn + NH3·H2O = [Zn(NH3)4](OH)2
+ H2↑
Cd + O2 + NH3· H2O = [Cd(NH3)4](OH)2 +
H2O
6. Окислительное щелочное плавление (V,Nb, Ta, Cr, MO, W…):
V + O2 + Na2CO3 = Na3VO4 + CO2
Cr + O2 + NaOH = Na2 Cr O4 + H2O
Полученные соли легко растворяются в воде
Слайд 321. Пирометаллургия – окислительный обжиг сульфидов и восстановление металлов из
оксидов при высокой температуре.
Fe2O3 + CO
Fe + CO2
FeS2 +
O2 = Fe2O3 + SO2
Cпособы получения металлов
Определяются характером сырья (рудой)
2. Электрометаллургия - электролиз расплавов или растворов солей
ZnSO4 + H2O Zn + O2 + H2SO4
электролиз
Слайд 33
3. Гидрометаллургия - выделение металлов из растворов их солей
более активными металлами
CdSO4 + Zn
Cd+ ZnSO4
цементация
Слайд 34Au + KCN + O2 + H2O = K[Au(CN)2] +
KOH
K[Au(CN)2] + Zn = K2[Zn(CN)4] + Au
цементация золота
Гидрометаллургический способ извлечения
золота
1.
2. Растворение золота в ртути с последующей разгонкой амальгамы.
Амальгама – сплав Hg с металлами (Zn, Cu, щелочные металлы).
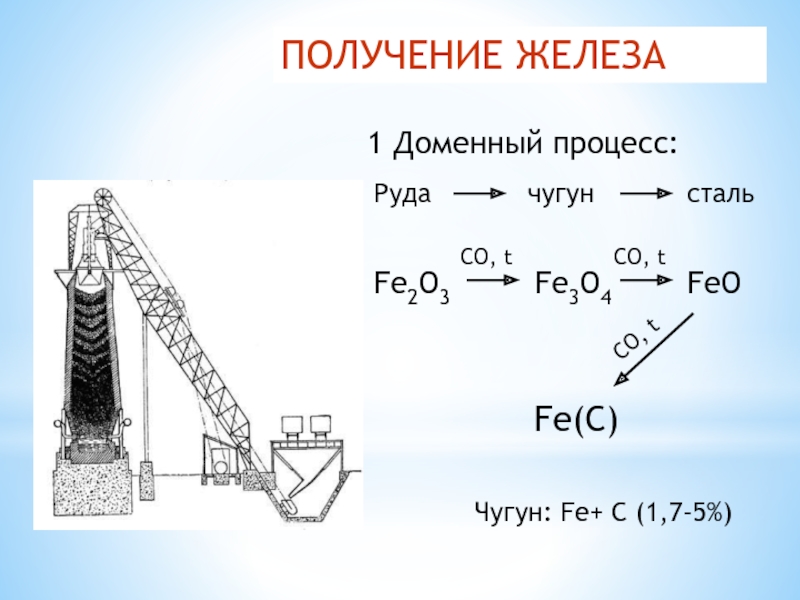
Слайд 35ПОЛУЧЕНИЕ ЖЕЛЕЗА
1 Доменный процесс:
Руда
чугун
сталь
Fe3O4
Fe2O3
CO, t
CO, t
FeO
Fe(C)
CO, t
Чугун: Fe+ C
(1,7-5%)
Слайд 361. Разложение карбонильных комплексов (Ni, Co,
Cr…)
Fe + 5CO =
Fe(CO)5
Порошок желтая жидкость
пентакарбонил железо
Pt, t
Получение металла высокой чистоты
[Fe(CO)5] Fe + 5CO
160-200оС
Железо высокой чистоты
2. Иодидное рафинирование.
3. Электролиз водных растворов солей.












![F элементы Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит натрияCr2O3 + NaOH = NaCrO2](/img/thumbs/c9b04168f5c425fda47fc8eec1f8d687-800x.jpg)



![F элементы CoCl2 + 4KSCN K2[Co(SCN)4] + 2KClЭту способность используют:1) для очистки CoCl2 + 4KSCN K2[Co(SCN)4] + 2KClЭту способность используют:1) для очистки d-элементов от примесейNi + 4CO =](/img/thumbs/08699cfa58096301edfd2dd971193f84-800x.jpg)


![F элементы 3. Смеси кислот: HNO3 + HCl – «царская водка»HNO3 + HFNb 3. Смеси кислот: HNO3 + HCl – «царская водка»HNO3 + HFNb + HNO3 + HF = H2[NbF7]](/img/thumbs/7746935ffd38f321bcd3a46b21abe184-800x.jpg)
2 + 5. Взаимодействие с гидратом аммиака: Zn + NH3·H2O = [Zn(NH3)4](OH)2 + H2↑Cd + O2 + NH3· H2O](/img/thumbs/c5d09ea104db5504d6f881ea8db41fc2-800x.jpg)


![F элементы Au + KCN + O2 + H2O = K[Au(CN)2] + KOHK[Au(CN)2] Au + KCN + O2 + H2O = K[Au(CN)2] + KOHK[Au(CN)2] + Zn = K2[Zn(CN)4] + Auцементация](/img/thumbs/8fe4f4304613cef95f65f4e3ec96882f-800x.jpg)