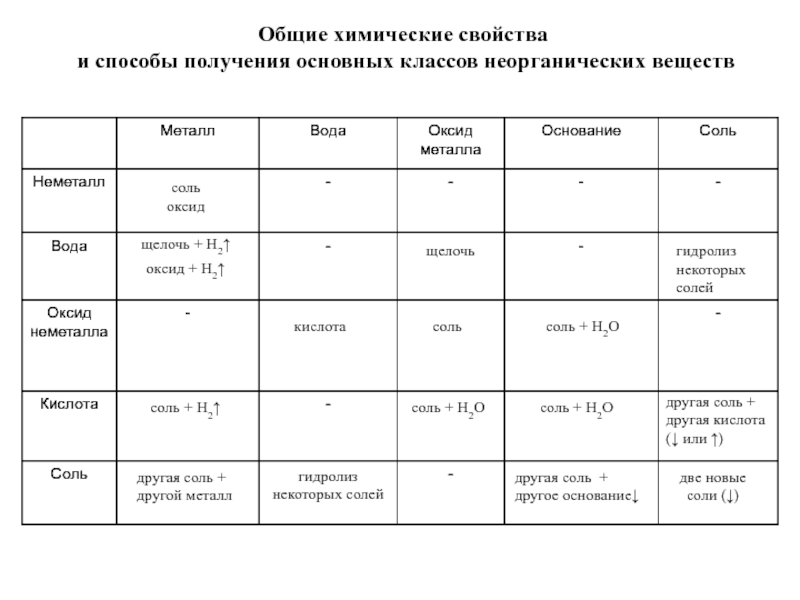
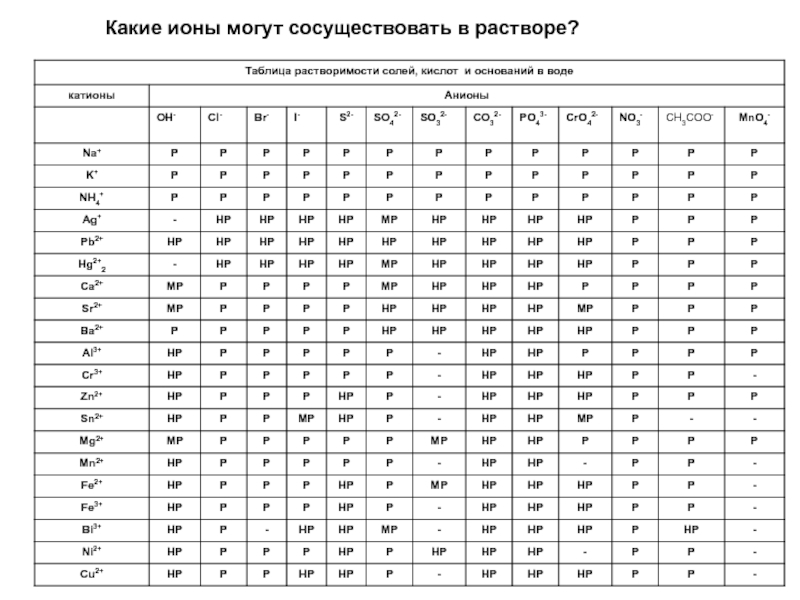
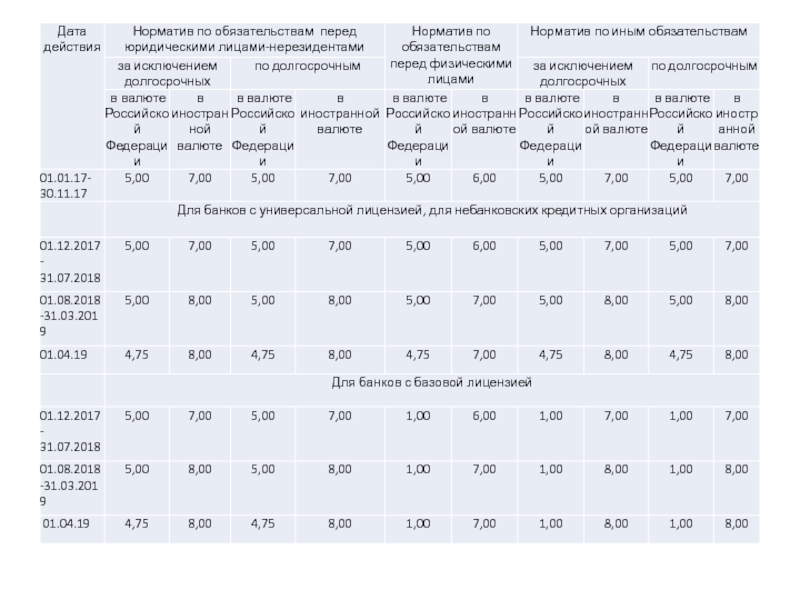
элемента). В химических реакциях не могут разлагаться с образованием других
веществ.Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.





![Тема № 2
Основные классы
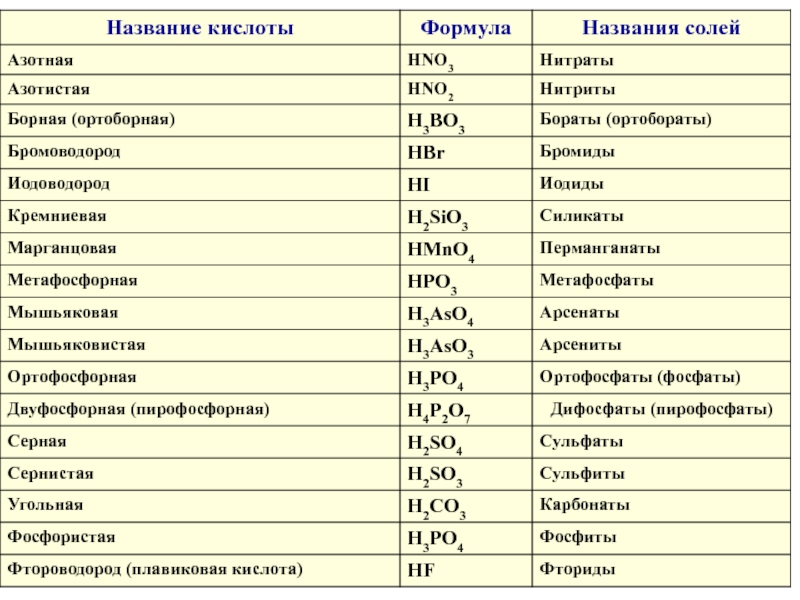
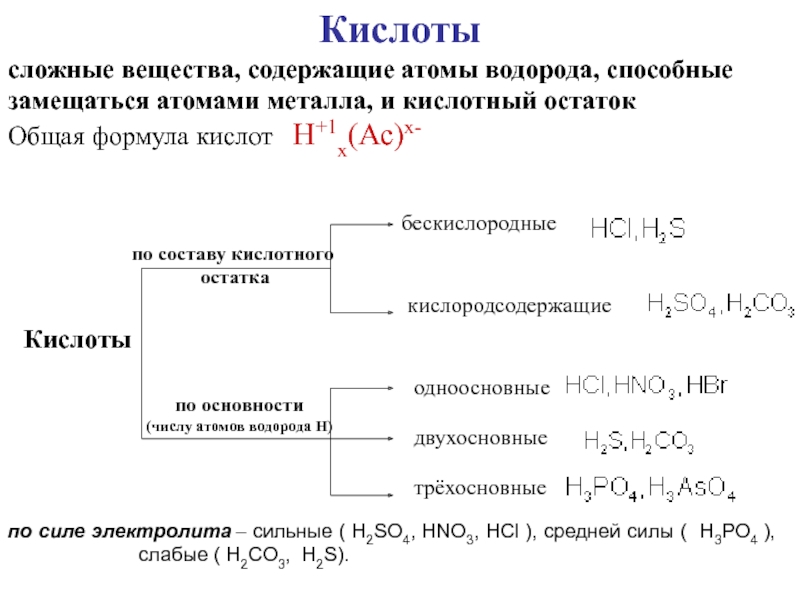
неорганических соединений НОМЕНКАТУРА КИСЛОТБЕСКИСЛОРОДНЫЕ КИСЛОТЫ (Н+1nЭ-n)Э + [o] + водородная кислота HCl – НОМЕНКАТУРА КИСЛОТБЕСКИСЛОРОДНЫЕ КИСЛОТЫ (Н+1nЭ-n)Э + [o] + водородная кислота HCl – хлороводородная кислота](/img/thumbs/5ab12ccc6a3bb53d8130d5b707aa9106-800x.jpg)