Слайд 1Тема урока
«Скорость химических реакций. Факторы, влияющие на скорость химической реакции»
Слайд 2Цель
Выяснить, какие условия необходимо создать, чтобы началась химическая реакция;
научиться
определять скорость химической реакции;
рассмотреть единицу измерения скорости химической реакции;
выяснить от каких факторов зависит скорость химических реакций.
Слайд 3Химические реакции протекают
с различными скоростями
- Мгновенно ( при взрыве;
в водных растворах, например, при смешивании растворов хлорида бария и
сульфата натрия образуется сульфат бария в виде белого осадка);
Быстро ( растворение цинка в соляной кислоте; горение магния);
- Медленно (образование ржавчины на железных предметах; окисление меди).
Слайд 4Условие возникновения химической реакции
Соприкосновение веществ
Слайд 5Химические реакции
Гетерогенные
химические реакции
Гомогенные
химические
реакции
Слайд 6Гомогенные химические реакции
- химические реакции, протекающие в однородной среде, например
в растворе или газовой фазе, то взаимодействие реагирующих веществ происходит
во всём объёме
Слайд 7Гетерогенные
химические реакции
Если реакция идет между веществами, находящихся в разных
агрегатных состояниях или между веществами, неспособными образовывать гомогенную среду (между
несмешивающимися жидкостями), то она происходит только на поверхности соприкосновения веществ.
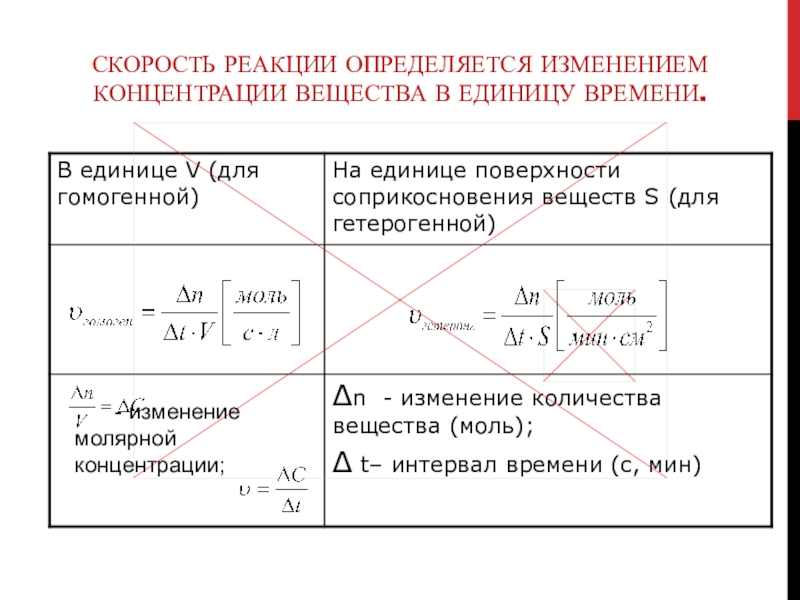
Слайд 8Скорость реакции определяется изменением концентрации вещества в единицу времени.
- изменение
молярной концентрации;
Слайд 9Анализ таблицы, выводы:
по приведённым формулам можно рассчитать лишь некоторую среднюю
скорость данной реакции в выбранном интервале времени (ведь для большинства
реакций скорость уменьшается по мере их протекания);
Значение скорости реакции зависит от того, по какому веществу её определяют
Например, для реакции Н2 +CI2 = 2НCI
из 1 моль Н2 образуется 2 моль НCI
скорость реакции увеличится в 2 раза ( по изменению концентрации HCI )
Слайд 10Задача на применение знаний по «Скорости химических реакций»
Химическая реакция протекает
в растворе, согласно уравнению: А+В = С. Исходные концентрация: вещества
А – 0,80 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л.
Определите:
среднюю скорость реакции за этот промежуток времени;
Слайд 12Факторы, влияющие на скорость химической реакции
- природа реагирующих веществ;
- температура;
-
концентрация реагирующих веществ;
- действие катализаторов;
- поверхность соприкосновения реагирующих веществ (в
гетерогенных реакциях).
Слайд 13Изменение количества вещества, по которому определяют скорость реакции – внешний
фактор
Суть: реакции происходят при столкновении частиц реагентов, которые обладают определённой
энергией.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
Суть: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией.
Чем больше частиц реагентов, чем ближе они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.

Слайд 141. Природа реагирующих веществ.
Под природой реагирующих веществ понимают их
состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Величина
энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Слайд 15Зависимость скорости реакции от природы реагирующих веществ.
Слайд 16Задание на применение знаний
Объясните разную скорость взаимодействия цинка и магния
с уксусной кислотой; цинка с соляной и уксусной кислотой.
Напишите
соответствующие реакции
Слайд 172. Температура
При увеличении температуры на каждые 10° С скорость реакции
увеличивается в 2-4 раза.
Число, показывающее, во сколько раз увеличивается скорость
реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
где –скорость реакции при температуре t2,
– скорость реакции при температуре t1,
– температурный коэффициент.
Слайд 18Задача на применение знаний:
Определите, как изменится скорость некоторой реакции:
при повышении температуры от 10° до 50° С;
Температурный коэффициент реакции
равен 3.
Слайд 19Самопроверка
подставить данные задачи в формулу:
скорость реакции увеличится в 81
раз
Слайд 203. Концентрация
реагирующих веществ.
На основе большого экспериментального материала в 1867
г. норвежские учёные К. Гульдберг, и П Вааге и независимо
от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ:
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции.
Этот закон ещё называют
законом действующих масс.
Слайд 21Математическое выражение
закона действующих масс.
По закону действующих масс скорость реакции,
уравнение которой А+В=С может быть вычислена по формуле:
v1= k1CACB,
а скорость реакции, уравнение которой А+2В=D, может быть вычислена по формуле:
v2= k2CACB.
В этих формулах: CA и CB – концентрации веществ А и В (моль/л), k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей реакции. Эти формулы также называют кинетическими уравнениями.
Слайд 22Задача на применение знаний:
1.Составьте кинетические уравнения для следующих реакций:
А) H2+I2=2HI;
Б) 2 Fe + 3CI2=
2 FeCI3.
2. Как изменится скорость реакции, имеющей кинетическое уравнение
2A + B = C,
если
концентрацию вещества А увеличить в 3 раза;
Слайд 23Самопроверка.
Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций.
скорость реакции увеличится в
9 раз.
Слайд 244. Действие катализатора
Обсуждение вопросов:
1.Что такое катализатор и каталитические
реакции?
2. Приведите примеры известных вам каталитических реакций из органической и
неорганической химии. Укажите названия веществ – катализаторов.
3. Выскажите предположение о механизме действия катализаторов (на основе теории столкновений).
4. Каково значение каталитических реакций?
Слайд 255.Поверхность соприкосновения реагирующих веществ.
Скорость реакции увеличивается благодаря:
-увеличению площади
поверхности соприкосновения реагентов (измельчение);
-повышению реакционной способности частиц на поверхности
образующихся при измельчении микрокристаллов;
-непрерывному подводу реагентов и хорошему отводу продуктов с поверхности, где идёт реакция.
Фактор связан с гетерогенными реакциями, которые протекают на поверхности соприкосновения реагирующих веществ: газ - твердое вещество, газ - жидкость, жидкость - твердое вещество, жидкость - другая жидкость, твердое вещество - другое твердое вещество, при условии, что они не растворимы друг в друге.
Приведите примеры гетерогенных реакций.
Слайд 26Выводы по теме урока
Химические реакции протекают с различными скоростями. Величина
скорости реакции зависит от объёма в гомогенной системе и от
площади соприкосновения реагентов – в гетерогенной.
На пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер, равный энергии активации Eа.
Скорость реакции зависит от факторов:
-природа реагирующих веществ;
-температура;
-концентрация реагирующих веществ;
- действие катализаторов;
-поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Слайд 27Выводы по теме урока
Величина энергии активации веществ – это фактор,
посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Чем меньше энергия активации, тем больше эффективных соударений реагирующих частиц.
При увеличении температуры на 10º С общее число активных соударений увеличивается в 2-4 раза.
Чем больше концентрации реагентов, тем больше соударений реагирующих частиц, а среди них и эффективных соударений.
Катализатор изменяет механизм реакции и направляет её по энергетически более выгодному пути с меньшей энергией активации. Ингибитор замедляет ход реакции.
Гетерогенные реакции протекают на поверхности соприкосновения реагирующих веществ. Нарушение правильной структуры кристаллической решётки приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.