Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тема занятия Основные положения молекулярно-кинетическ ой теори и
Содержание
- 1. Тема занятия Основные положения молекулярно-кинетическ ой теори и
- 2. МКТ молекулярно-кинетическая теория объясняет физические
- 3. На уроках физики изучают физические явления: механические,
- 4. 1. Молекулярная физикаМолекулярная физика рассматривает строение и свойства вещества на основе МКТ.
- 5. 2. Из истории развития МКТ Фундаментом МКТ
- 6.
- 7. М.В.Ломоносов
- 8. . Основные положения МКТI. Все вещества состоят из мельчайших частиц (молекул, атомов)
- 9. Хотя существование молекул и атомов было установлено
- 10. Молекула вещества – это мельчайшая частица данного
- 11. Слайд 11
- 12. Каждому веществу соответствует определенный вид
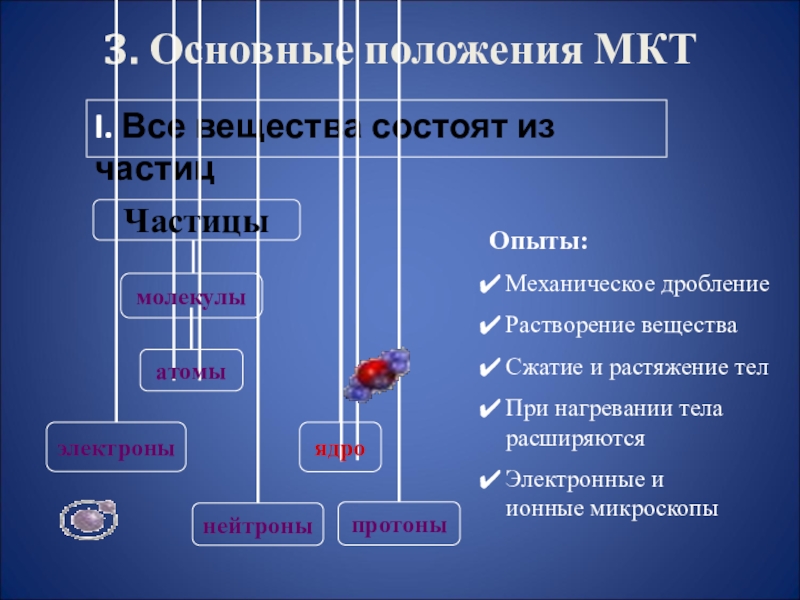
- 13. 3. Основные положения МКТI. Все вещества состоят
- 14. Основные положения МКТII. Частицы непрерывно и хаотически движутсяОпыты:ДиффузияБроуновское движение
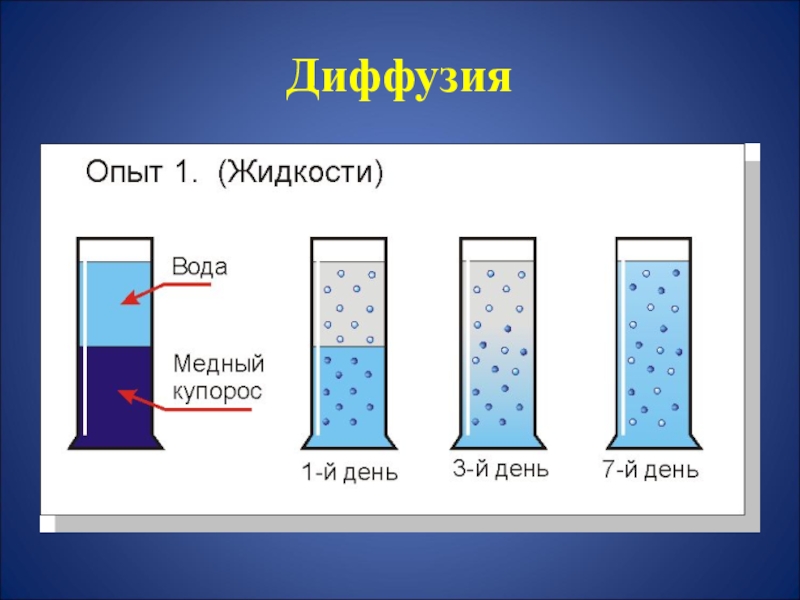
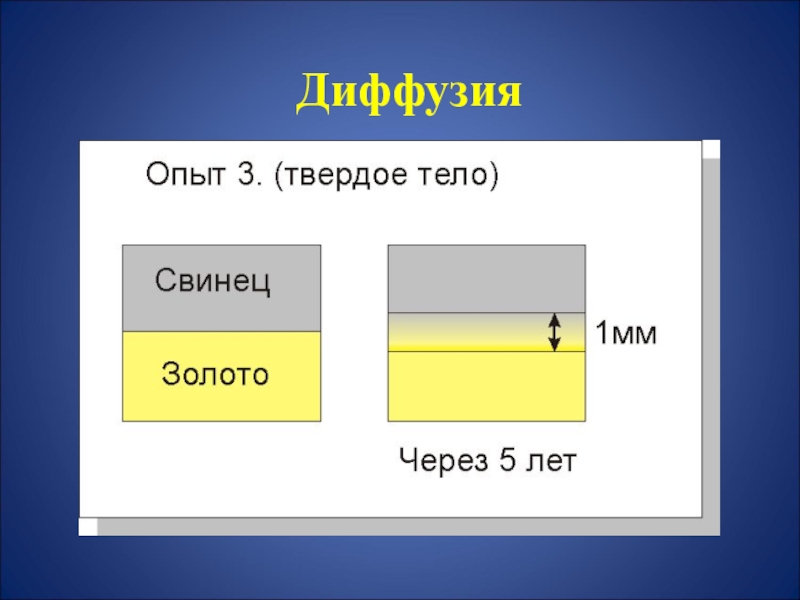
- 15. ДиффузияДиффузия – это процесс взаимного cамопроизвольного
- 16. Диффузия
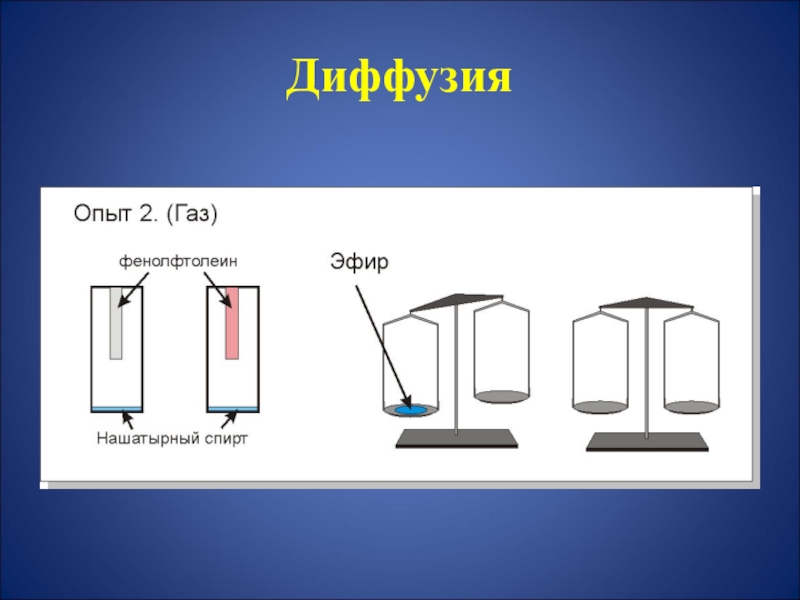
- 17. Диффузия
- 18. Диффузия
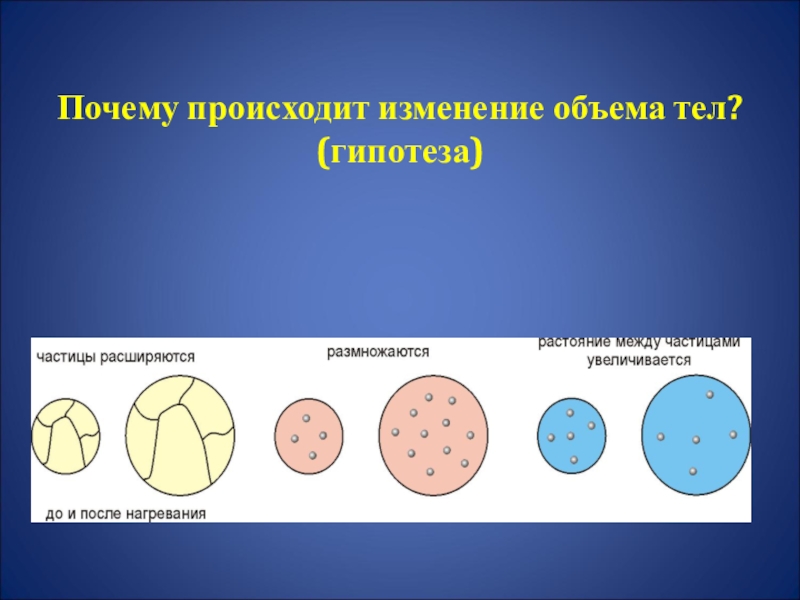
- 19. Почему происходит изменение объема тел? (гипотеза)
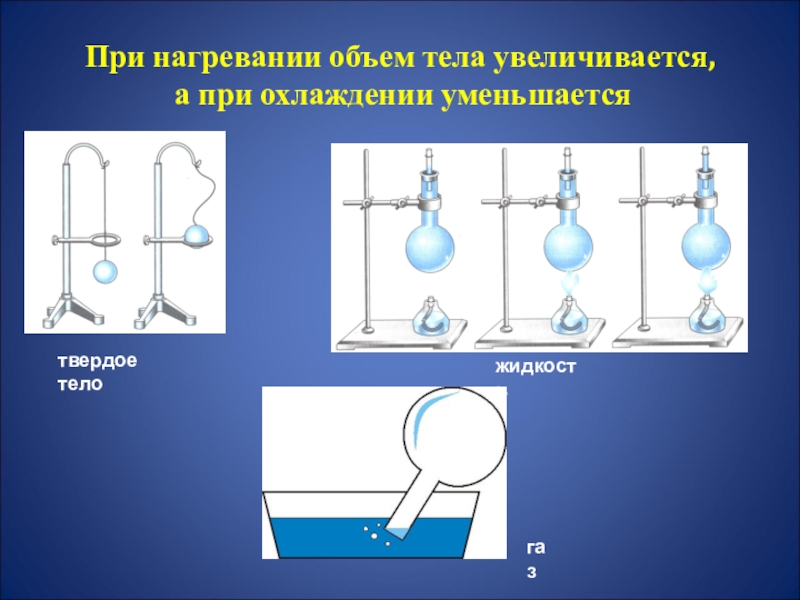
- 20. При нагревании объем тела увеличивается, а при охлаждении уменьшаетсятвердое теложидкостьгаз
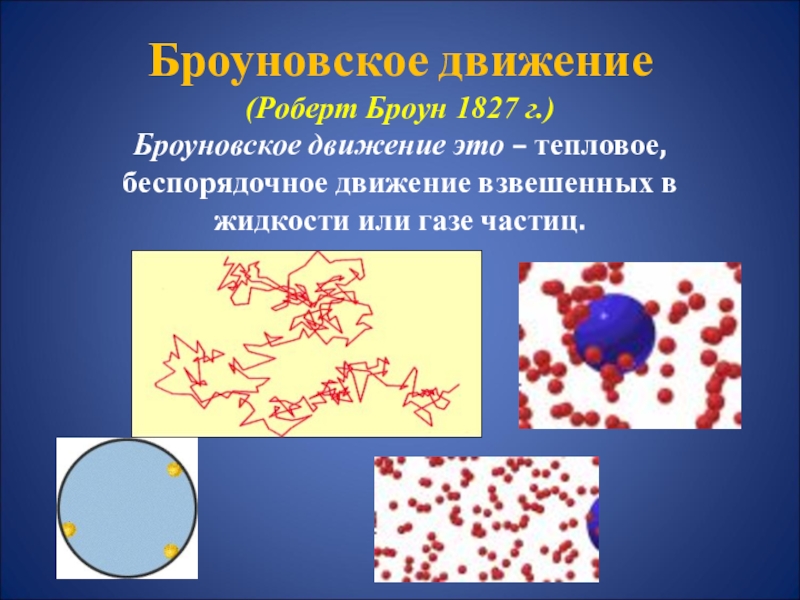
- 21. Броуновское движение (Роберт Броун
- 22. Причина: удары молекул жидкости о частицу
- 23. III. Частицы, взаимодействуя друг с другом, притягиваются
- 24. Если бы между молекулами не существовало сил
- 25. Взаимодействие молекулr0 = d Fпр
- 26. Основные положения МКТВещество состоит из мельчайших частицЧастицы вещества непрерывно хаотически движутсяЧастицы вещества взаимодействуют друг с другом
- 27. Молекулы разных веществ по-разному взаимодействуют между собой.
- 28. Частицы вещества беспрерывно и беспорядочно движутся.
- 29. Агрегатные состояния веществатвёрдоежидкоегазообразное
- 30. КонтрольНа каком физическом явлении основан процесс
- 31. Домашнее задание Заполнить таблицу
- 32. Масса и размеры молекул. Постоянная Авогадро Протоны,
- 33. Масса и размеры молекул. Постоянная АвогадроЗаполнить таблицу:
- 34. Масса и размеры молекул. Постоянная Авогадро
- 35. В одном моле любого вещества содержится одно
- 36. ν - количество вещества [ ν
- 37. Молярная масса (М) – масса вещества, взятого
- 38. Mr – относительная молекулярная (атомная) масса вещества
- 39. N = vNA = NAm/М
- 40. Слайд 40
- 41. Решить задачу:1. Рассчитать массу молекулы Н2SО4.
- 42. 2. Сколько молекул содержится в 50г Аℓ?
- 43. Слайд 43
- 44. Дано:С2H2М - ?m0 - ?Ответ: 26 кг/моль; 4,3∙10-23кг=4,3∙10-23 кг
- 45. Задача Сколько молекул содержится в 10 г углекислого газа?
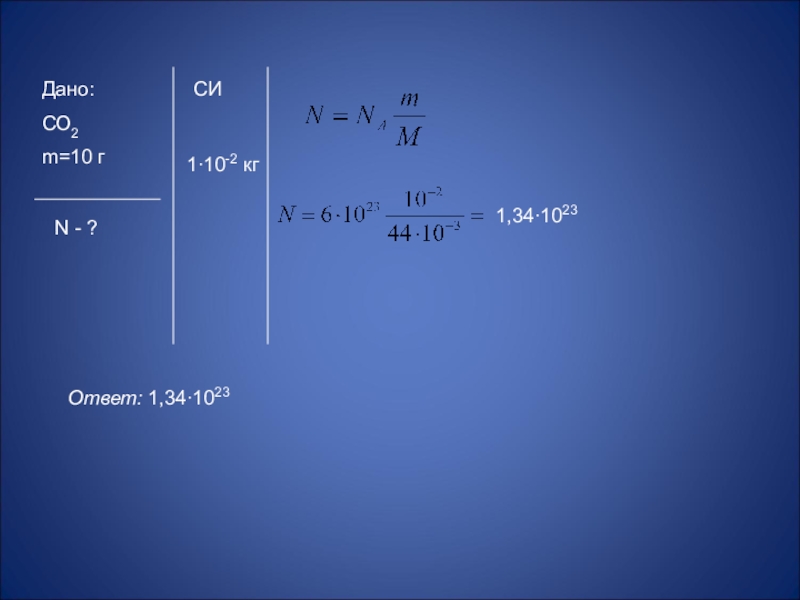
- 46. Дано:СО2m=10 гN - ?СИ1∙10-2 кгОтвет: 1,34∙1023 1,34∙1023
- 47. Решите самостоятельно задачу Сколько молекул содержится в 10 г кислорода?
- 48. Дано:О2m=10 гN - ?СИ1∙10-2 кгОтвет: 1,875∙1023 1,875∙1023
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2МКТ
молекулярно-кинетическая теория
объясняет физические явления и свойства тел
с точки зрения их внутреннего микроскопического строения.
Слайд 3На уроках физики изучают физические явления: механические,
электрические,
оптические.
В
окружающем нас мире наряду с ними распространены тепловые явления.
Тепловые
явления изучает молекулярная физика.Слайд 41. Молекулярная физика
Молекулярная физика
рассматривает строение и
свойства вещества на
основе МКТ.
Слайд 52. Из истории развития МКТ
Фундаментом МКТ является атомистическая гипотеза:
все тела в природе состоят из мельчайших
структурных единиц –
атомов и молекул. Слайд 9 Хотя существование молекул и атомов было установлено давно и даже
были определены их размеры. Лишь в 1945г. А.А.Лебедев с помощью
«электронного микроскопа», позволяющего исследовать объекты очень малых размеров, сумел сфотографировать некоторые крупные молекулы белка (альбумин).Слайд 10Молекула вещества – это мельчайшая частица данного вещества
Молекулы состоят
из еще более мелких частиц - атомов
Слайд 12 Каждому веществу соответствует определенный вид молекул. У разных
веществ молекулы могут состоять из одного атома (инертные газы) из
нескольких одинаковых или различных атомов или даже из сотен тысяч атомов (полимеры). Молекулы различных веществ могут иметь форму треугольника, пирамиды и других геометрических фигур, а также быть линейными.Слайд 133. Основные положения МКТ
I. Все вещества состоят из частиц
Опыты:
Механическое дробление
Растворение вещества
Сжатие и растяжение тел
При нагревании тела расширяются
Электронные и
ионные
микроскопыСлайд 14Основные положения МКТ
II. Частицы непрерывно и хаотически движутся
Опыты:
Диффузия
Броуновское движение
Слайд 15 Диффузия
Диффузия – это процесс взаимного cамопроизвольного проникновения
различных
веществ друг в друга,
обусловленный
тепловым движением молекул.
Диффузия возникает в:
газах
жидкостях,
твердых телах.
Скорость движения молекул:
Vгаз > Vжидкость > Vтвердое тело
Слайд 20При нагревании объем тела увеличивается,
а при охлаждении уменьшается
твердое тело
жидкость
газ
Слайд 21 Броуновское движение (Роберт Броун 1827 г.) Броуновское движение это – тепловое,
беспорядочное движение взвешенных в жидкости или газе частиц.
Слайд 22Причина: удары молекул жидкости
о частицу не компенсируют друг друга.
Характер
движения зависит от вида жидкости, размера и формы частиц,
температуры.Броуновская частица
Слайд 23III. Частицы, взаимодействуя друг с другом,
притягиваются и отталкиваются, т
е между ними существуют силы притяжения и отталкивания
Опыты:
Склеивание
Смачивание
Твердые
тела и жидкости трудно сжатьСлайд 24Если бы между молекулами не существовало сил притяжения, то вещество
бы при любых условиях находилось в газообразном состоянии, только благодаря
силам притяжения молекулы могут удерживаться около друг друга и образовывать жидкости и твердые тела. Если бы не было сил отталкивания, то мы свободно могли бы проткнуть пальцем толстую стальную плиту. Более того, без проявления сил отталкивания вещество не могло бы существовать. Молекулы проникли бы друг в друга и сжались бы до объема одной молекулы.Слайд 25Взаимодействие молекул
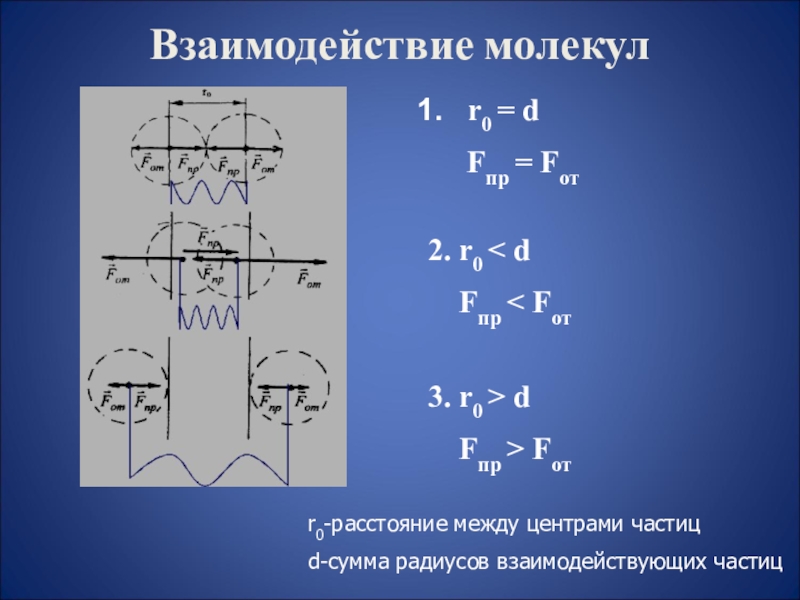
r0 = d
Fпр = Fот
2. r0
< d
Fпр < Fот
3. r0 > d
Fпр > Fотr0-расстояние между центрами частиц
d-сумма радиусов взаимодействующих частиц
Слайд 26Основные положения МКТ
Вещество состоит из мельчайших частиц
Частицы вещества непрерывно хаотически
движутся
Частицы вещества взаимодействуют друг с другом
Слайд 27Молекулы разных веществ по-разному взаимодействуют между собой. Взаимодействие зависит от
типа молекул и расстояния между ними. Этим объясняется наличие различных
агрегатных состояний веществ (жидкое, твердое, газообразное )Слайд 30 Контроль
На каком физическом явлении основан
процесс засолки овощей, рыбы, мяса?
В каком случае процесс происходит быстрее – если рассол холодный
или горячий?На каком явлении основано консервирование
фруктов и овощей?
Почему сладкий сироп приобретает со временем
вкус фруктов?
Почему сахар и другие пористые продукты
нельзя хранить вблизи пахучих веществ?
Слайд 32Масса и размеры молекул. Постоянная Авогадро
Протоны, нейтроны и электроны, взаимодействуя
между собой, образуют сложные и очень устойчивые и химически неделимые
частицы, получившие название атомов вещества.Атомы химических элементов в результате электромагнитного взаимодействия соединяются между собой и образуют еще более сложные частицы вещества – молекулы.
Молекула – наименьшая частица вещества, несущая основные свойства этого вещества и способная к самостоятельному существованию.
Массы отдельных молекул и атомов очень малы ( mH 0≈3·10−26 кг) , поэтому в расчетах используют не абсолютные, а относительные значения масс.
Слайд 35В одном моле любого вещества содержится одно и то же
число частиц (молекул). Это число называется постоянной Авогадро NА: NА = 6,02·1023 моль–1.
Слайд 36ν - количество вещества [ ν ] = моль
1 моль – это количество вещества, в котором содержится столько
же частиц, сколько атомов в 12 граммах углерода. ν = N/NАСлайд 37Молярная масса (М) – масса вещества, взятого в количестве одного
моля. [ М ] = кг/моль М = m/ν m –
масса веществаСлайд 38Mr – относительная молекулярная (атомная) масса вещества (табл. Менделеева) М
= Mr·10-3 М = m0NA m0 – масса одной
частицы (атома, молекулы) m0 = m/N = М/ NAСлайд 422. Сколько молекул содержится в 50г Аℓ?
М(Аℓ) = 27г/моль
N = νNA
ν = m/Mν = 50г:27г/моль = 1,85моль
N = 1,85·6·10²³ = 11·10²³
Решить задачу:

























![Тема занятия Основные положения молекулярно-кинетическ ой теори и ν - количество вещества [ ν ] = моль 1 ν - количество вещества [ ν ] = моль 1 моль – это количество](/img/tmb/7/609601/5e1b6c8fa5275a83244694031a4c2c4d-800x.jpg)
![Тема занятия Основные положения молекулярно-кинетическ ой теори и Молярная масса (М) – масса вещества, взятого в количестве одного моля. Молярная масса (М) – масса вещества, взятого в количестве одного моля. [ М ] = кг/моль](/img/tmb/7/609601/9360059312124bcb24ee7762abed437d-800x.jpg)