Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД)
Содержание
- 1. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД)
- 2. Сванте Август Аррениус (1859 - 1927)Шведский физико-химик,
- 3. положения ТЭД 1. При растворении в воде
- 4. положения ТЭД 2. Под действием электрического тока
- 5. положения ТЭД 3. Электролитическая диссоциация – процесс
- 6. Теория кислот и оснований Кислоты – это
- 7. Теория кислот и оснований Диссоциация многоосновных кислот
- 8. Теория кислот и оснований Основания – это
- 9. Теория кислот и оснований Если основание содержит
- 10. Теория кислот и оснований Диссоциацию растворенной части
- 11. Теория кислот и оснований Соли – это
- 12. Механизм электролитической диссоциации
- 13. Процесс растворения вещества К+А– в воде может
- 14. Как правило, механизм электролитической диссоциации не раскрывают,
- 15. степень диссоциации
- 16. КОНСТАНТА ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИгде [K+], [A–] – концентрации
- 17. Связь между константой К и степенью диссоциации
- 18. Концентрация недиссоциированных молекул КА в растворе равна:[КА] = (1 - α)∙СОткуда:данное уравнение выражает закон разбавления Оствальда
- 19. Если α мала, то 1-α ≈ 1 и тогда:
- 20. Диссоциация слабого электролита протекает по стадиям (ступенчатая диссоциация).Например:
- 21. Ионное произведение воды Образование водородных ионов и
- 22. где К – константа диссоциации воды.[Н3О+] ∙
- 23. Водородный показатель рН = – lg[Н+][Н+] =
- 24. Нейтральная среда [Н3О+] = [ОН–] = 10–
- 25. Скачать презентанцию
Сванте Август Аррениус (1859 - 1927)Шведский физико-химик, создатель теории электролитической диссоциации, академик Королевской академии наук Швеции. В 1903 году был удостоен Нобелевской премии за чрезвычайные заслуги в химии.
Слайды и текст этой презентации
Слайд 2Сванте Август Аррениус
(1859 - 1927)
Шведский физико-химик, создатель теории электролитической диссоциации,
академик Королевской академии наук Швеции.
Нобелевской премии за чрезвычайные заслуги в химии.Слайд 3положения ТЭД
1. При растворении в воде (или расплавлении) электролиты
распадаются на положительно (катионы) и отрицательно (анионы) заряженные ионы (т.е.
подвергаются электролитической диссоциации).КА К+ + А–
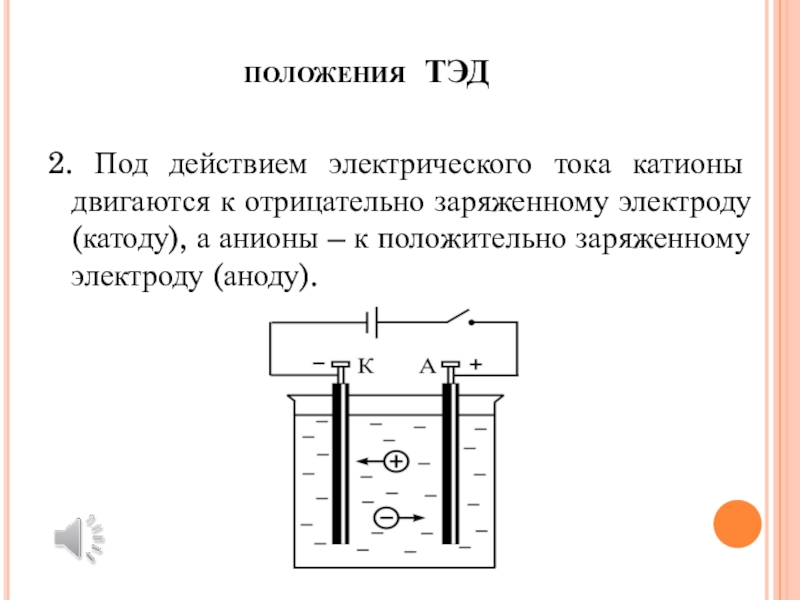
Слайд 4положения ТЭД
2. Под действием электрического тока катионы двигаются к
отрицательно заряженному электроду (катоду), а анионы – к положительно заряженному
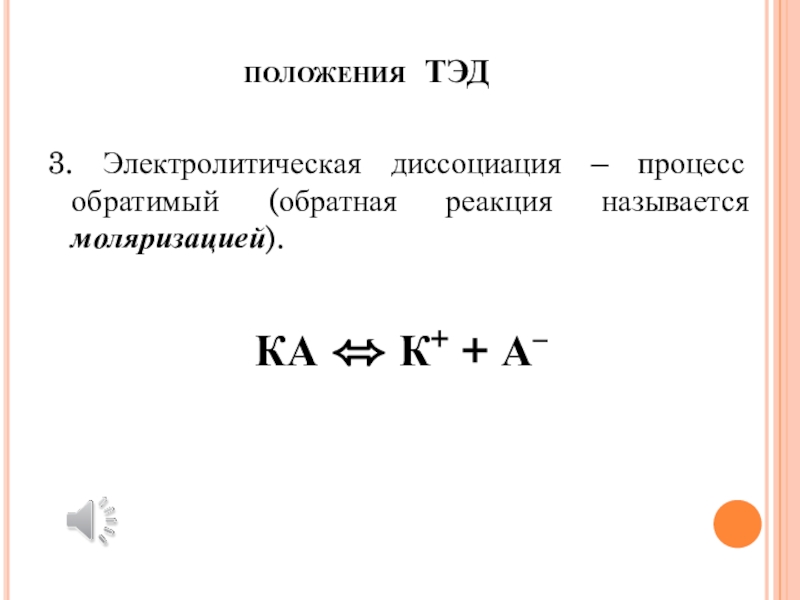
электроду (аноду).Слайд 5положения ТЭД
3. Электролитическая диссоциация – процесс обратимый (обратная реакция
называется моляризацией).
КА К+ + А–
Слайд 6Теория кислот и оснований
Кислоты – это электролиты, диссоциирующие с образованием
катионов водорода Н+:
HNO3 = H+ + NO3ˉ
Слайд 7Теория кислот и оснований
Диссоциация многоосновных кислот протекает по ступеням:
H3PO4 =
H+ + H2PO4ˉ I ступень
H2PO4ˉ = H+ +
HPO42ˉ II ступеньHPO42ˉ = H+ + PO43ˉ III ступень
Слайд 8Теория кислот и оснований
Основания – это электролиты, диссоциирующие с образованием
гидроксид-ионов ОНˉ:
NaOH = Na+ + OHˉ
Слайд 9Теория кислот и оснований
Если основание содержит в молекуле несколько гидроксильных
групп, то диссоциация будет происходить ступенчато:
Сa(OH)2 =СаОН+ + OHˉ
I ступеньСaOH+ =Сa2+ + OHˉ II ступень
Уравнение полной диссоциации имеет вид:
Сa(OH)2 = Сa2+ + 2OHˉ
Слайд 10Теория кислот и оснований
Диссоциацию растворенной части амфотерного гидроксида можно представить
следующей схемой:
H+ + МеO– = МеOH = Ме+ +
OH–Слайд 11Теория кислот и оснований
Соли – это электролиты, диссоциирующие с образованием
катионов, отличных от ионов Н+, и анионов, отличных от ионов
ОНˉ:NaCl = Na+ + Clˉ
KHCO3 = K+ + HCO3ˉ
AlOHCl2 = AlOH2+ + 2Clˉ
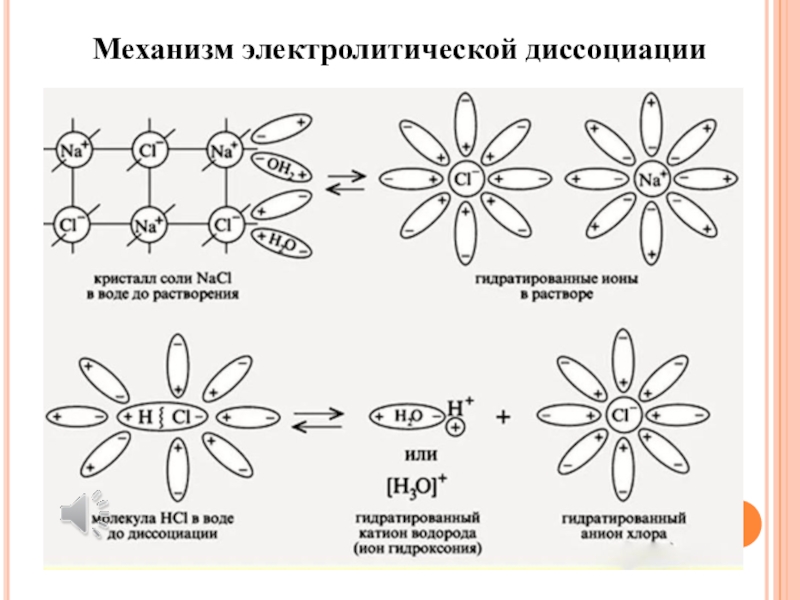
Слайд 13Процесс растворения вещества К+А– в воде может быть записан следующим
образом:
К+А– + хН2О → К+(Н2О) + А–(Н2О)
Слайд 14Как правило, механизм электролитической диссоциации не раскрывают, и процесс растворения
записывают, опуская растворитель, хотя он является основным участником:
CaCl2 =
Ca2+ + 2ClˉHNO3 = H+ + NO3ˉ
Ba(OH)2 = Ba2+ + 2OHˉ
Слайд 16КОНСТАНТА ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
где [K+], [A–] – концентрации в растворе ионов
К+ и А– (г-ион/л);
[КА] – концентрация недиссоциированного соединения
КА (моль/л).Слайд 17Связь между константой К и степенью диссоциации α может быть
найдена следующим образом:
[K+] = [A–] = α∙С
где С – исходная
молярная концентрация;α – степень электролитической диссоциации электролита.
Слайд 18Концентрация недиссоциированных молекул КА в растворе равна:
[КА] = (1 -
α)∙С
Откуда:
данное уравнение выражает
закон разбавления Оствальда
Слайд 21Ионное произведение воды
Образование водородных ионов и гидроксид-ионов:
Н2О Н+ +
ОН–
Гидратация водородного иона с образованием иона гидроксония:
Н+ + Н2О
Н3О+Слайд 22
где К – константа диссоциации воды.
[Н3О+] ∙ [ОН–] = К
∙ [Н2О]2
Так как [Н2О] = const, то получим:
[Н3О+] ∙ [ОН–]
= КWКW - ионное произведение воды
Слайд 23Водородный показатель
рН = – lg[Н+]
[Н+] = 10– рН
на практике принимается
Кw = 10– 14
отсюда:
[Н+] = 10– 7 г-ион/л
рН = 7
Слайд 24Нейтральная среда
[Н3О+] = [ОН–] = 10– 7 г-ион/л, рН
= 7
Кислая среда
[Н3О+] > [ОН–] > 10– 7 г-ион/л,
рН < 7Щелочная среда
[Н3О+] < [ОН–] < 10– 7 г-ион/л, рН > 7












![ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) КОНСТАНТА ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИгде [K+], [A–] – концентрации в растворе ионов К+ КОНСТАНТА ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИгде [K+], [A–] – концентрации в растворе ионов К+ и А– (г-ион/л);[КА] – концентрация недиссоциированного](/img/tmb/6/587238/0ef4f145391ce0c8c23234b673401f5f-800x.jpg)
![ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) Связь между константой К и степенью диссоциации α может быть найдена Связь между константой К и степенью диссоциации α может быть найдена следующим образом:[K+] = [A–] = α∙Сгде](/img/tmb/6/587238/8b403362100ab376a1b59f057d275cd4-800x.jpg)
![ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) Концентрация недиссоциированных молекул КА в растворе равна:[КА] = (1 - α)∙СОткуда:данное уравнение выражает закон разбавления Оствальда Концентрация недиссоциированных молекул КА в растворе равна:[КА] = (1 - α)∙СОткуда:данное уравнение выражает закон разбавления Оствальда](/img/tmb/6/587238/b9aef9317efaa4602057cf7b21784a11-800x.jpg)
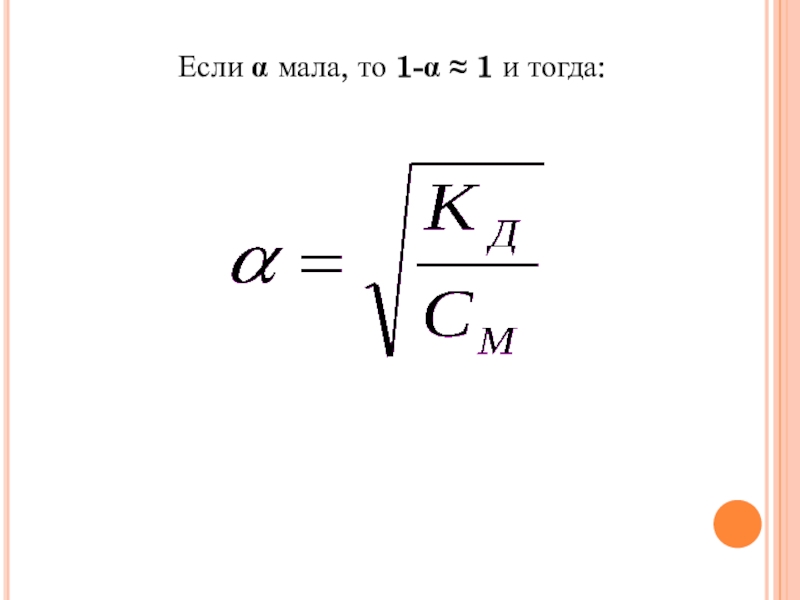


![ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) где К – константа диссоциации воды.[Н3О+] ∙ [ОН–] = К ∙ где К – константа диссоциации воды.[Н3О+] ∙ [ОН–] = К ∙ [Н2О]2Так как [Н2О] = const, то](/img/tmb/6/587238/cd2d0bafd10877c987d5f3c598c7ede0-800x.jpg)
![ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) Водородный показатель рН = – lg[Н+][Н+] = 10– рНна практике принимается Водородный показатель рН = – lg[Н+][Н+] = 10– рНна практике принимается Кw = 10– 14 отсюда: [Н+]](/img/tmb/6/587238/f8fbaebfaa5a1e5eda60137bdfdcaed3-800x.jpg)
![ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД) Нейтральная среда [Н3О+] = [ОН–] = 10– 7 г-ион/л, рН = Нейтральная среда [Н3О+] = [ОН–] = 10– 7 г-ион/л, рН = 7Кислая среда [Н3О+] > [ОН–] >](/img/tmb/6/587238/05f631b8eba38ffceaff7e664f87eb7c-800x.jpg)



















