Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория отталкивания электронных пар
Содержание
- 1. Теория отталкивания электронных пар
- 2. Теория отталкивания электронных парСиджвик и Пауэлл, 1940
- 3. Слайд 3
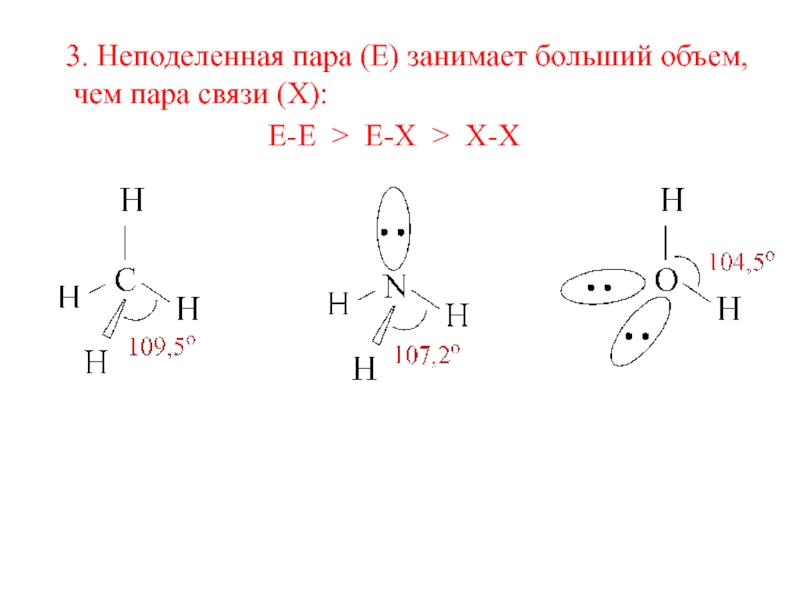
- 4. 3. Неподеленная пара (E) занимает больший объем,
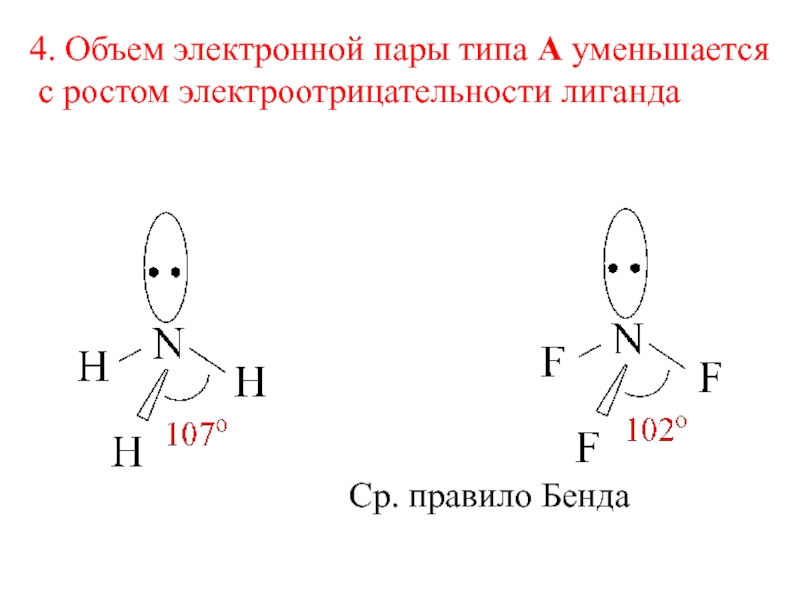
- 5. 4. Объем электронной пары типа А уменьшается с ростом электроотрицательности лигандаСр. правило Бенда
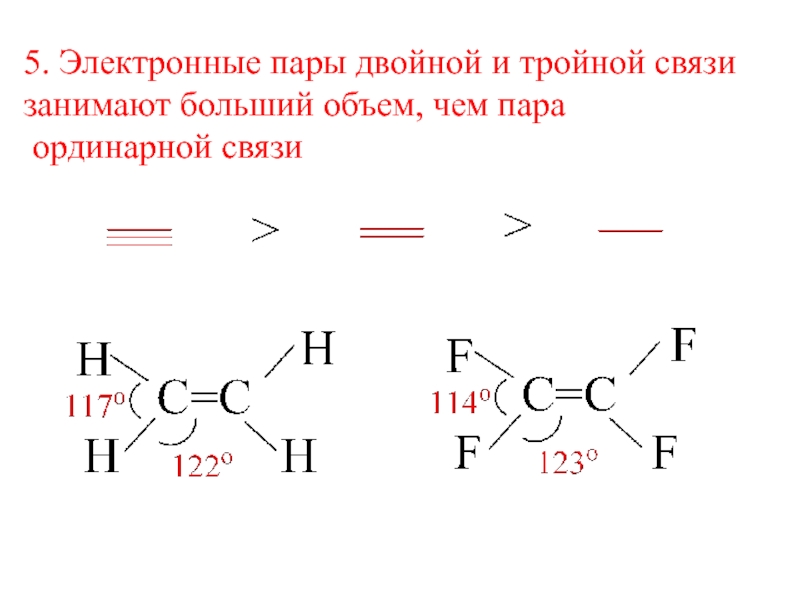
- 6. 5. Электронные пары двойной и тройной связизанимают больший объем, чем пара ординарной связи
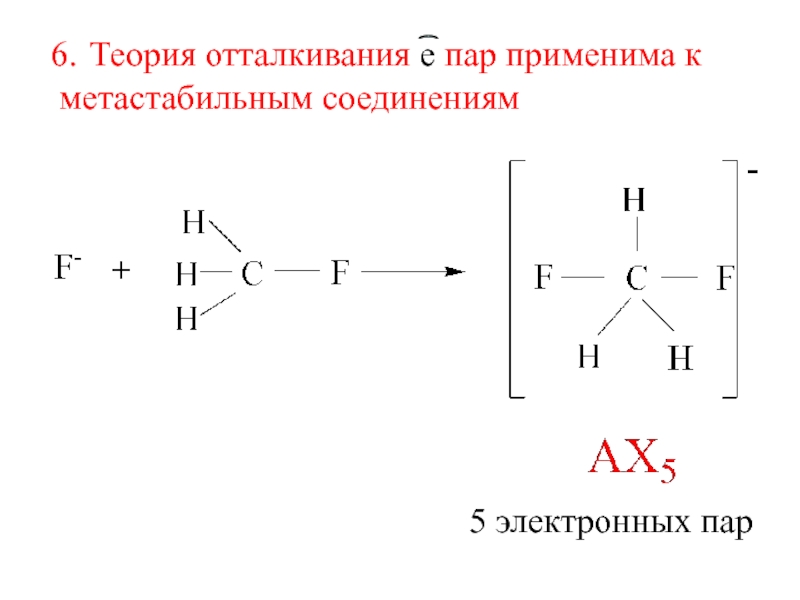
- 7. Теория отталкивания е пар применима к метастабильным соединениям5 электронных пар
- 8. Слайд 8
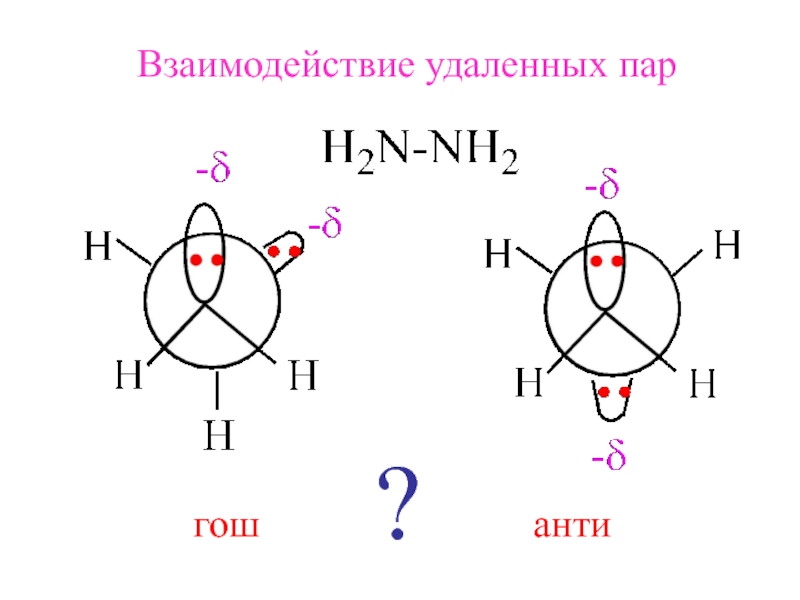
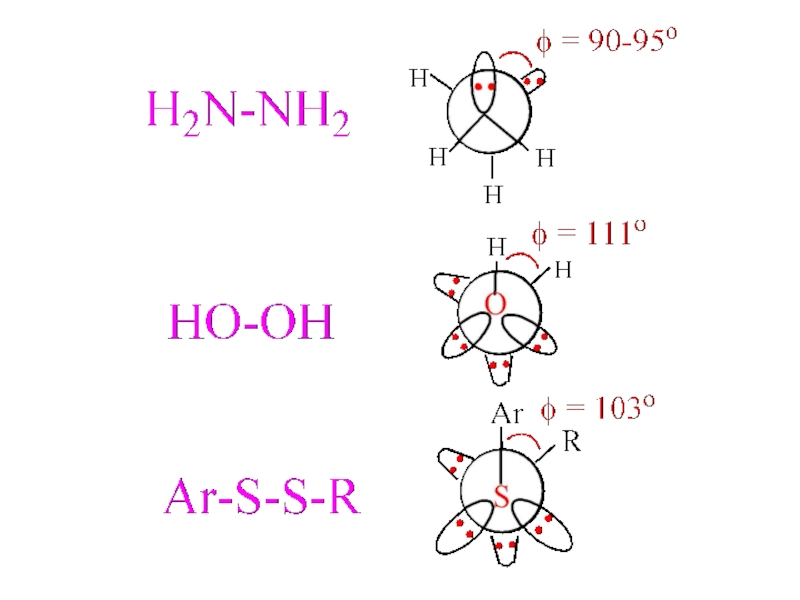
- 9. Взаимодействие удаленных паргошанти?
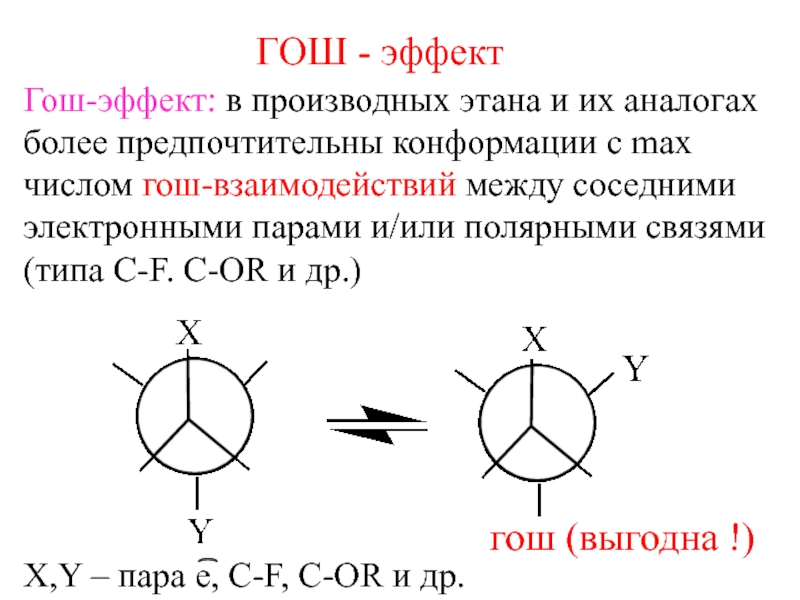
- 10. ГОШ - эффектГош-эффект: в производных этана и
- 11. Слайд 11
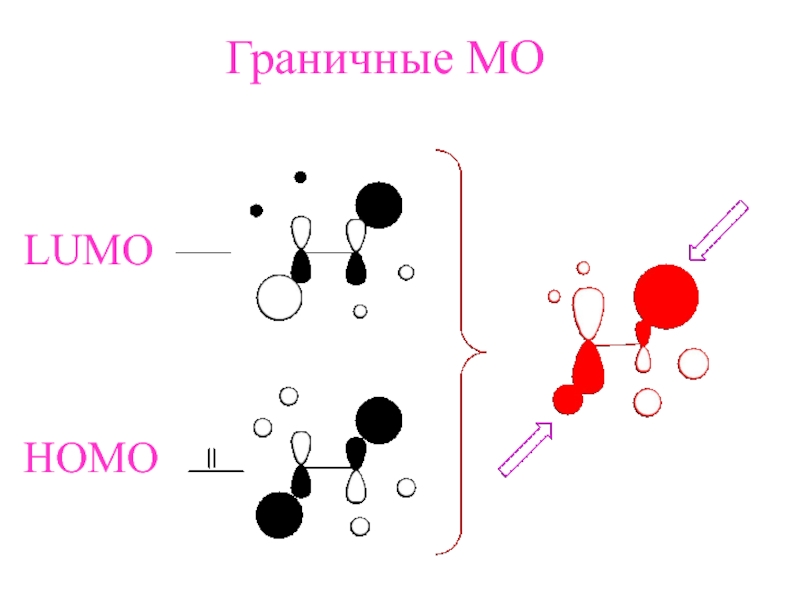
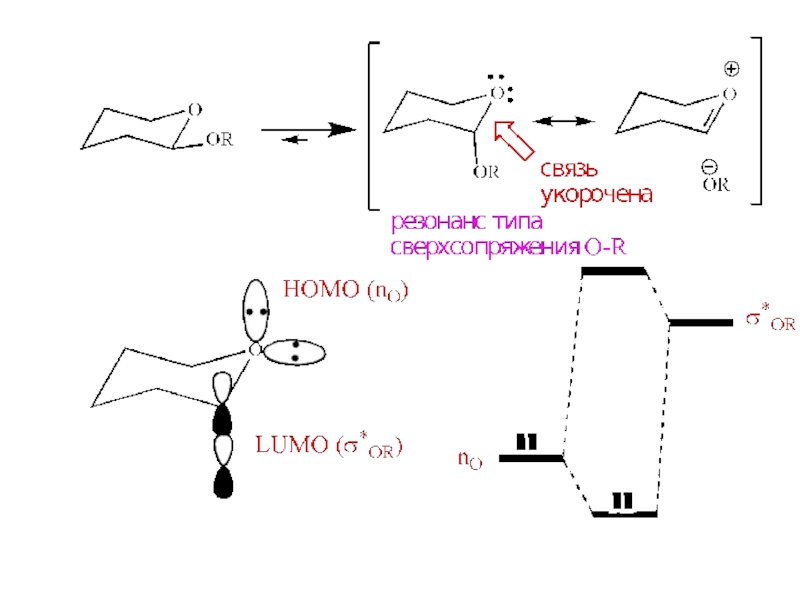
- 12. LUMOHOMOГраничные МО
- 13. Слайд 13
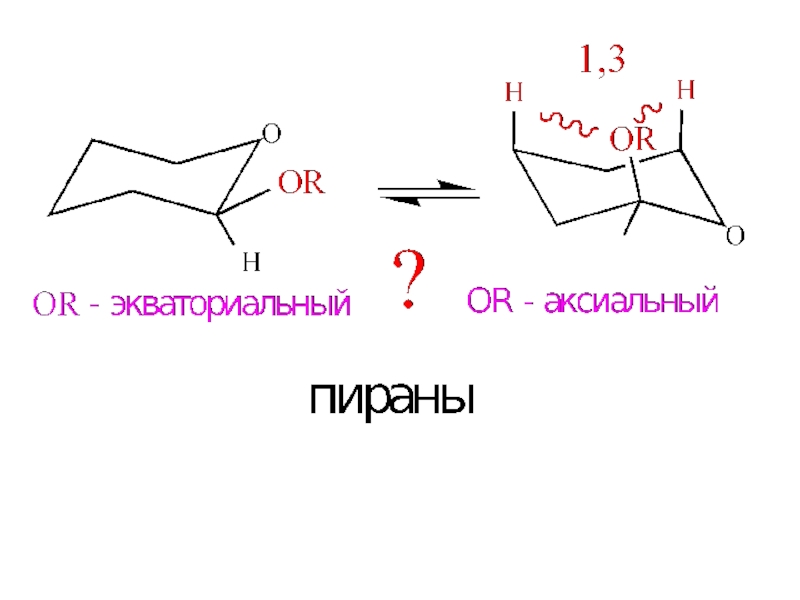
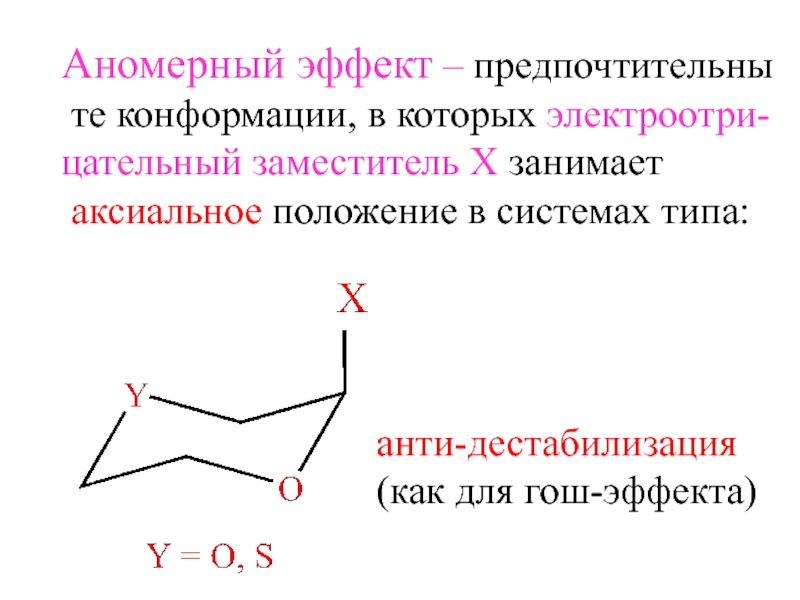
- 14. Аномерный эффект – предпочтительны те конформации, в
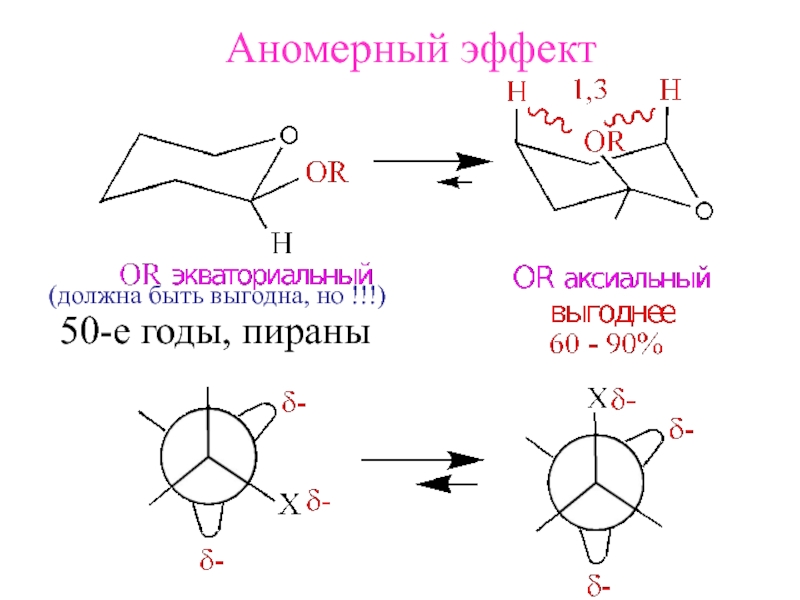
- 15. Аномерный эффект(должна быть выгодна, но !!!)50-е годы, пираны
- 16. Слайд 16
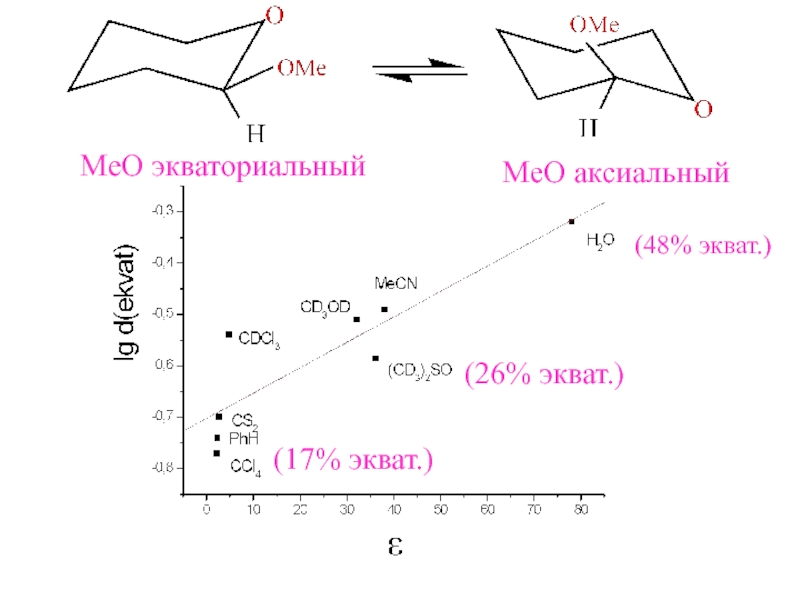
- 17. MeO экваториальныйMeO аксиальный(48% экват.)(26% экват.)(17% экват.)
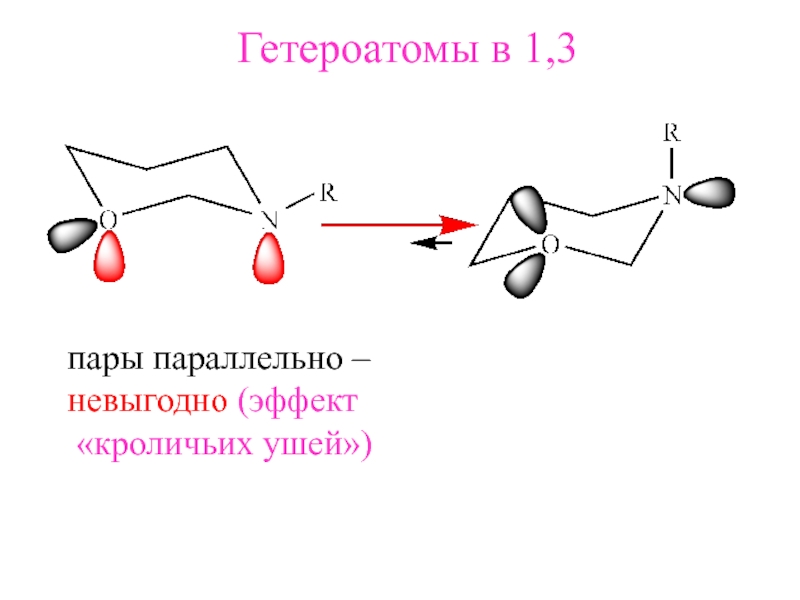
- 18. Гетероатомы в 1,3пары параллельно –невыгодно (эффект «кроличьих ушей»)
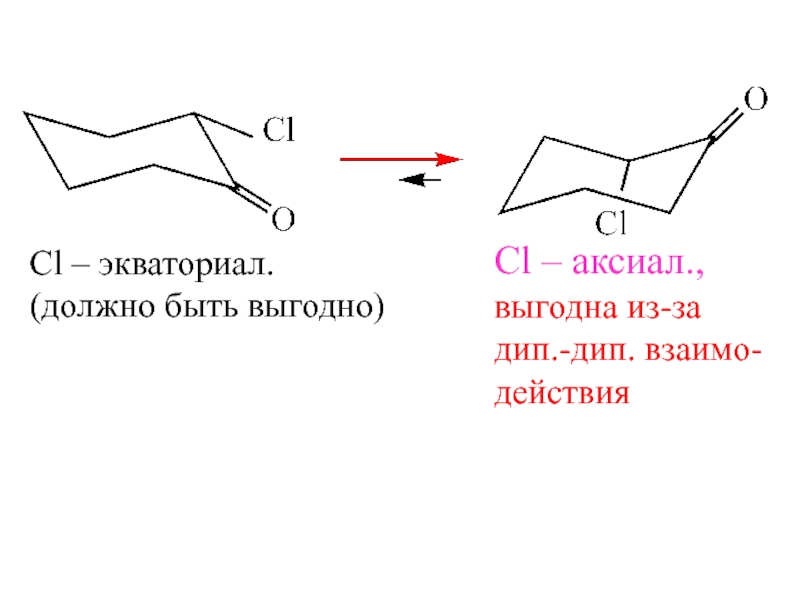
- 19. Сl – экваториал.(должно быть выгодно)Сl – аксиал.,выгодна из-задип.-дип. взаимо-действия
- 20. Слайд 20
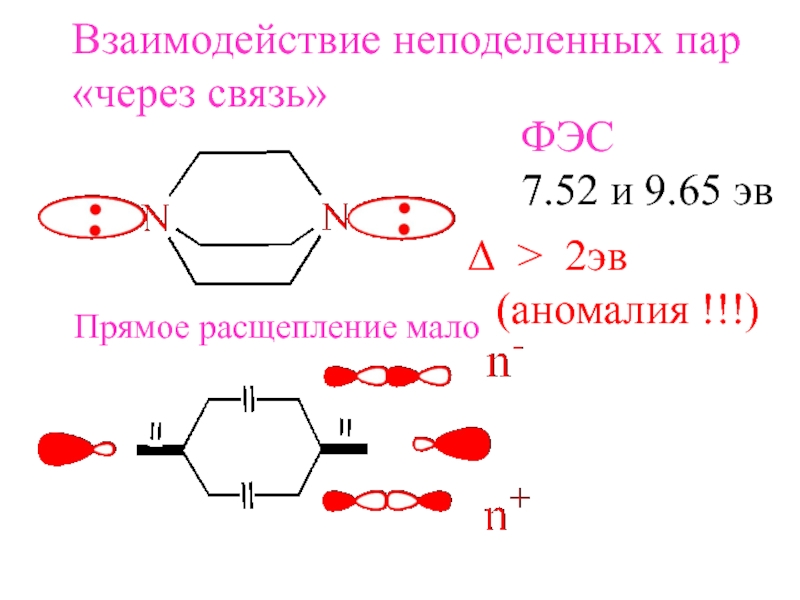
- 21. Взаимодействие неподеленных пар«через связь»Прямое расщепление малоФЭС7.52 и 9.65 эв > 2эв(аномалия !!!)
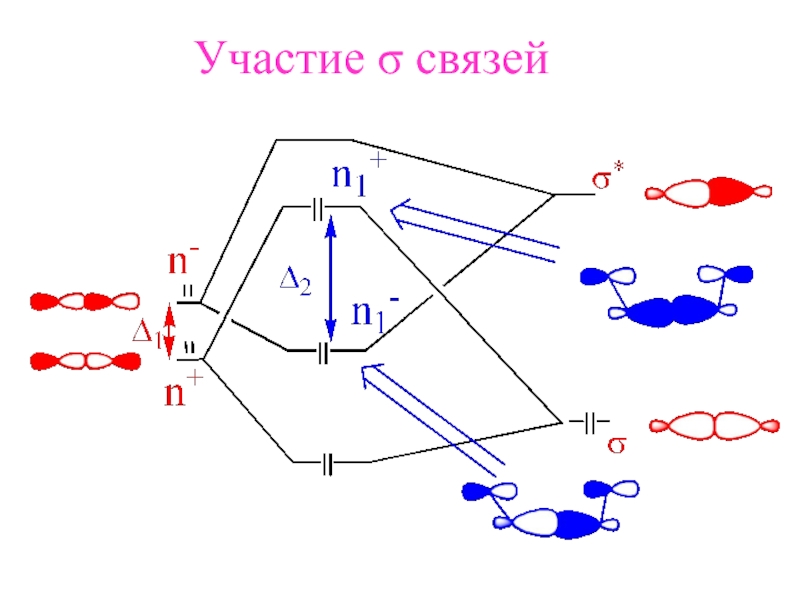
- 22. Участие σ связей
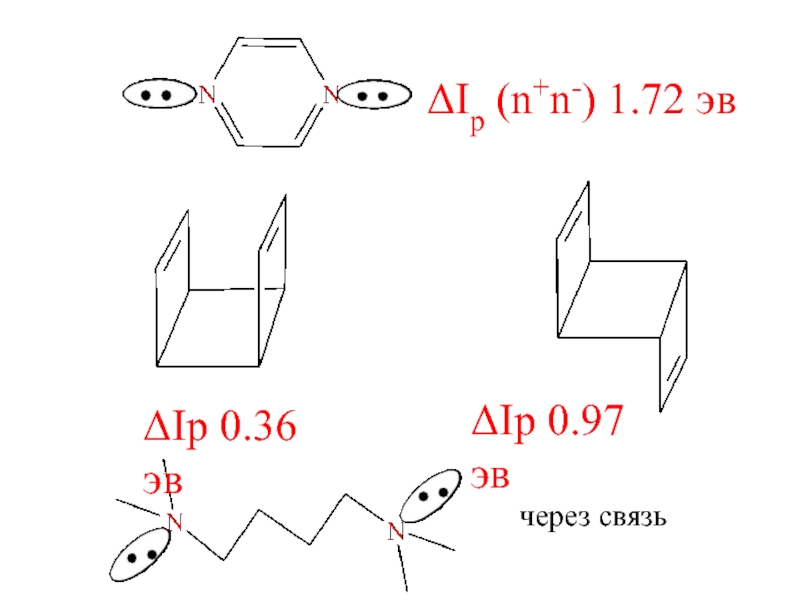
- 23. ΔIp (n+n-) 1.72 эвΔIp 0.36 эвΔIp 0.97 эвчерез связь
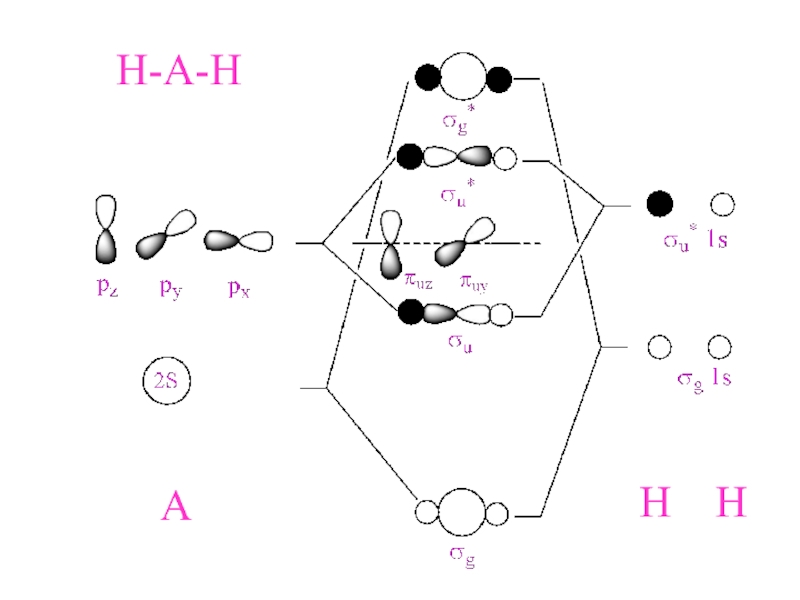
- 24. Диаграммы Уолша Форма МО и порядок их
- 25. H-A-HA H H
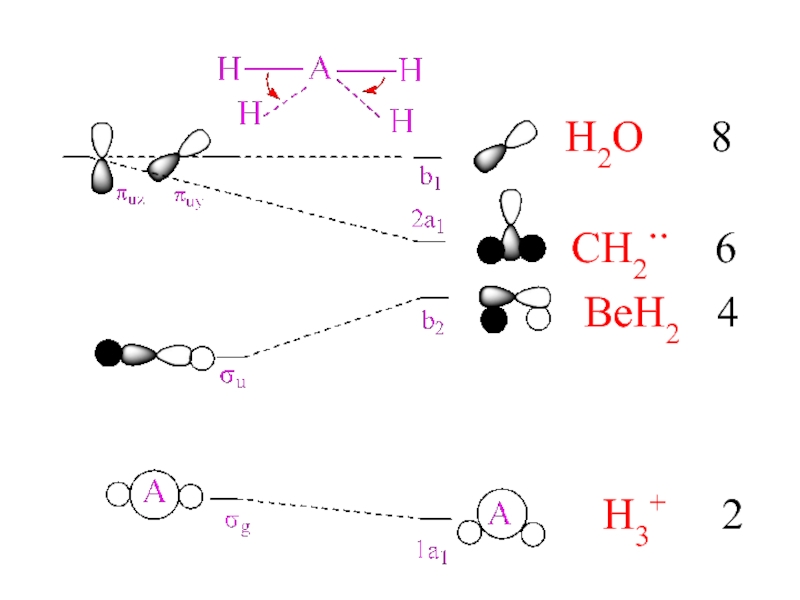
- 26. H3+ 2BeH2 4CH2.. 6H2O 8
- 27. Скачать презентанцию
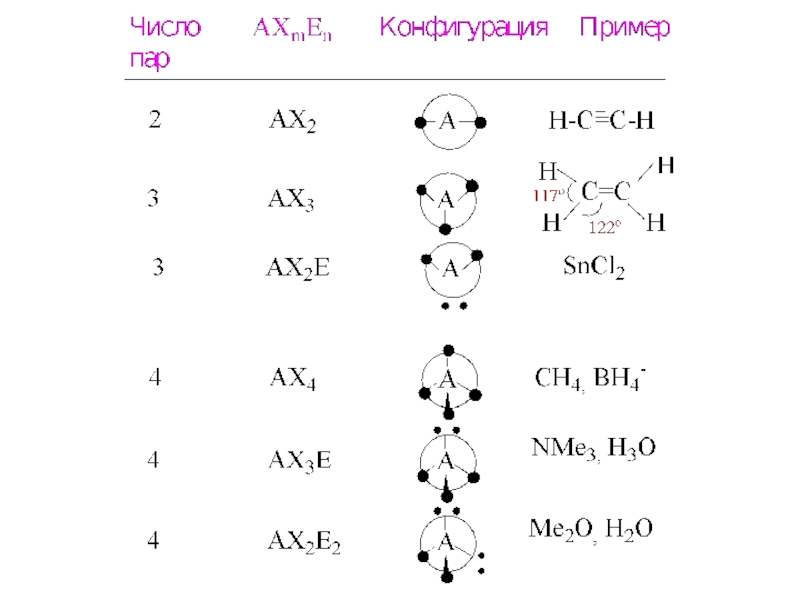
Теория отталкивания электронных парСиджвик и Пауэлл, 1940 г.; развитие ГиллеспиПоложения:Конфигурация связей многовалентного атома или иона обусловлена числом электронных пар в его валентной оболочке2. Ориентация облаков электронных пар валентныхорбиталей определяется min
Слайды и текст этой презентации
Слайд 1Теоретические основы органической
химии
Теория отталкивания электронных пар.
Стереоэлектронные эффекты и метод МО.
Лекция
7
Слайд 2Теория отталкивания электронных пар
Сиджвик и Пауэлл, 1940 г.; развитие
Гиллеспи
Положения:
Конфигурация связей многовалентного атома
или иона обусловлена числом электронных пар
в его валентной оболочке2. Ориентация облаков электронных пар валентных
орбиталей определяется min отталкиванием электронов
F ~ 1/rn , r – расстояние между
«парами» е
Слайд 54. Объем электронной пары типа А уменьшается
с ростом электроотрицательности
лиганда
Ср. правило Бенда
Слайд 8 Недостатки
теории ОЭП
Теория не приложима к молекулам с переходными
элементами
(отклонение от сферической симметрии е).2. Участие d-орбиталей в связях, образуемых элементами
низших периодов, приводит к отклонениям.
3. В соединениях типа АХ6Е и других с высоким
координационным числом атома неподеленная пара является стереохимически инертной (анионы SbCl63-, ТеСl62-).
4. Большие расхождения наблюдаются для соединений с высокополярными связями (Li2O – линеен).
5. В теории ОЭП характеристики заместителей X
фактически не принимаются во внимание(π-сопряженние)
(C(CN)3-, C(NO2)3- плоские).
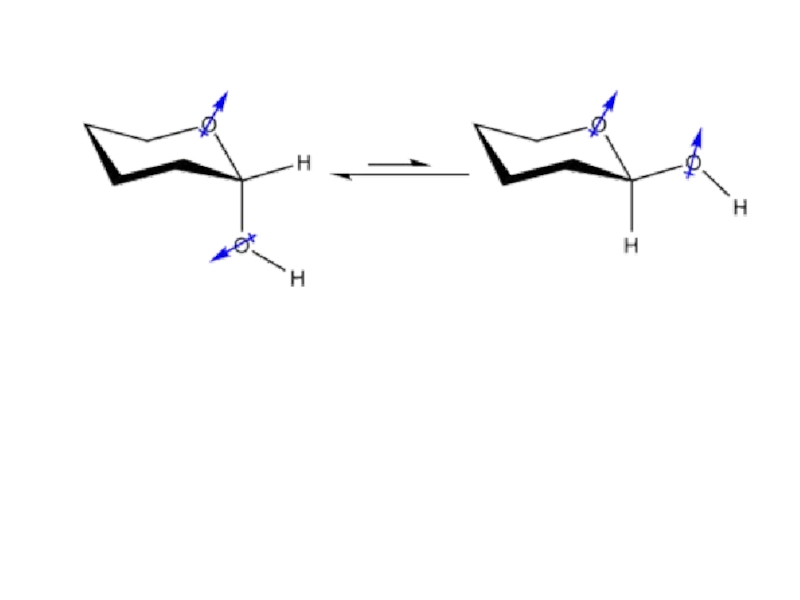
Слайд 10ГОШ - эффект
Гош-эффект: в производных этана и их аналогах
более предпочтительны
конформации с max
числом гош-взаимодействий между соседними
электронными парами и/или полярными связями
(типа
C-F. C-OR и др.) гош (выгодна !)
X,Y – пара е, С-F, C-OR и др.
Слайд 14Аномерный эффект – предпочтительны
те конформации, в которых электроотри-
цательный заместитель
Х занимает
аксиальное положение в системах типа:
анти-дестабилизация
(как для гош-эффекта)
Слайд 21Взаимодействие неподеленных пар
«через связь»
Прямое расщепление мало
ФЭС
7.52 и 9.65 эв
>
2эв
(аномалия !!!)
Слайд 24Диаграммы Уолша
Форма МО и порядок их расположения по
энергии однотипен
для молекул одного ряда
(AX2, AX3 и т.д.)
2. Eполн. энергия
= Σ Ei3. Если при изменении геометрии формы
молекулы увеличивается положительное
перекрывание между 2-мя и более АО
в составе i-МО, энергия данной МО
понижается.