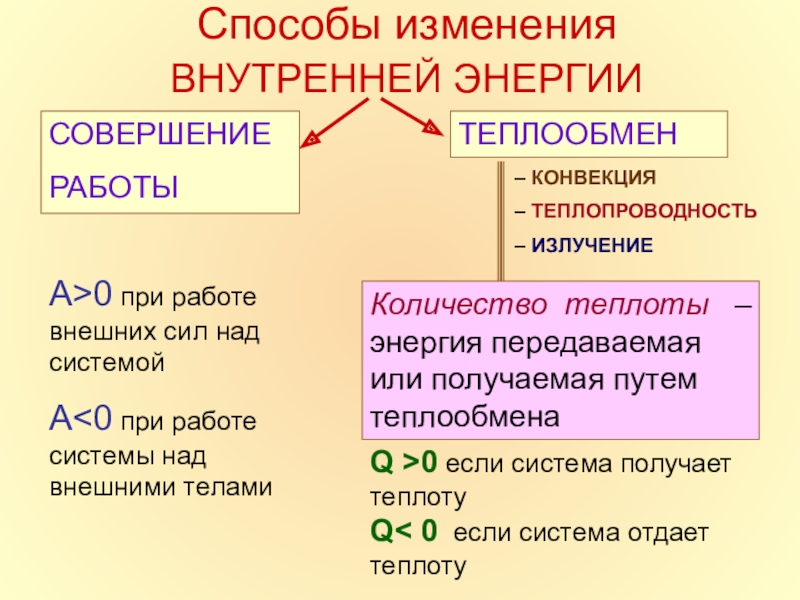
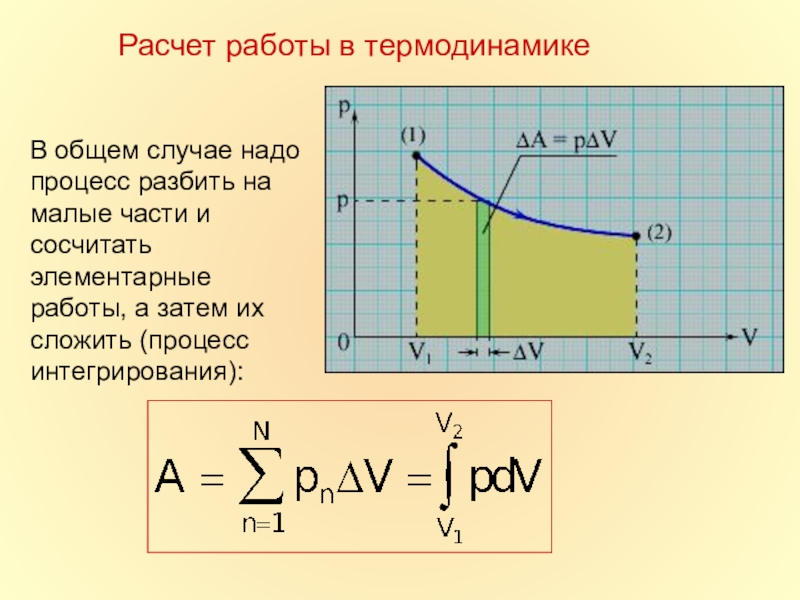
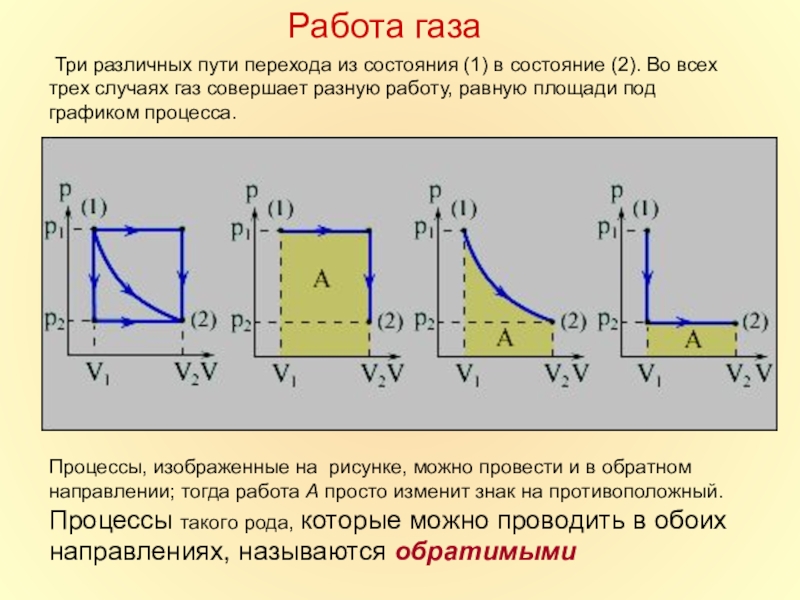
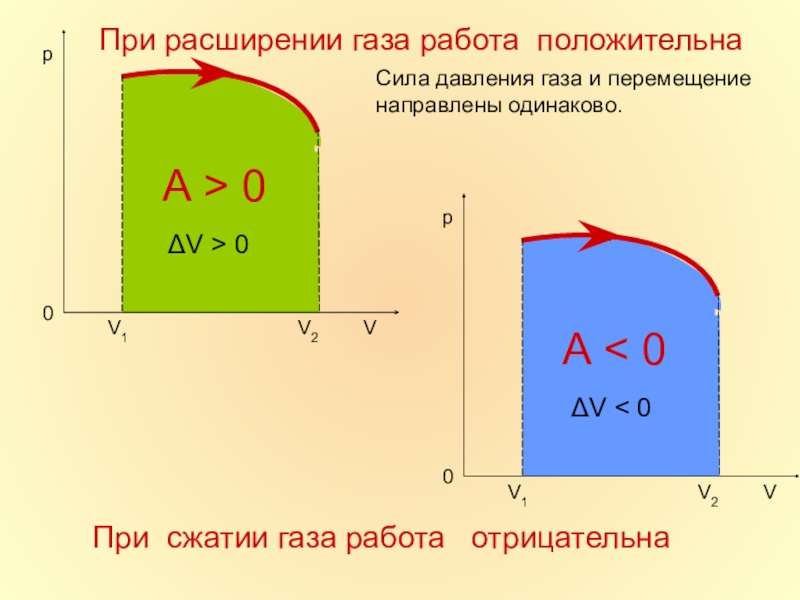
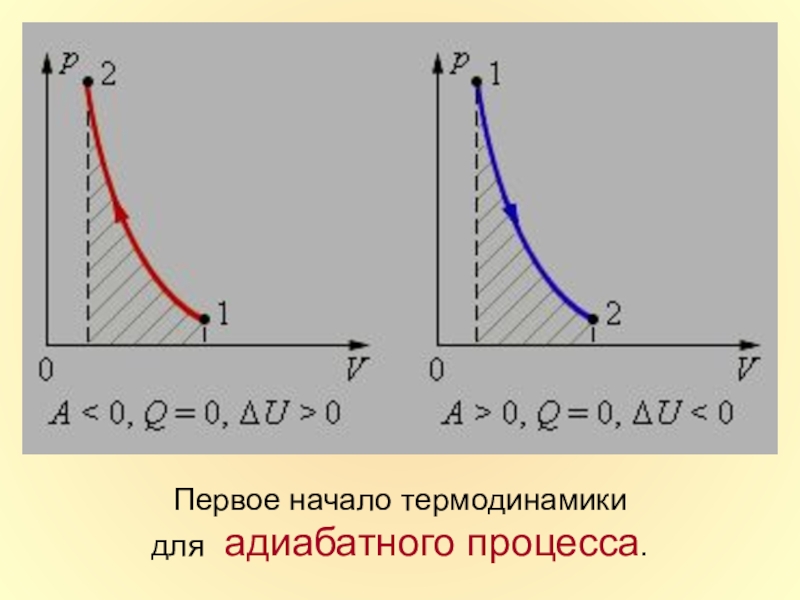
в которой
не учитывается молекулярное строение тел.Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно-кинетические модели для иллюстрации своих выводов.
В противоположность молекулярно-кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества