Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика и статистическая физика
Содержание
- 1. Термодинамика и статистическая физика
- 2. Лекция № 11 Энтропия
- 3. Статистический смысл энтропии
- 4. Термодинамическая вероятность состояния системы -
- 5. Макросостояние – это состояние вещества, характеризуемое
- 6. Так как молекулы движутся хаотически, то имеется
- 7. Термодинамической вероятностью или статистическим весом макросостояния
- 8. Чтобы пояснить понятие статистичес-кого веса (термодинамической
- 9. Слайд 9
- 10. Ω
- 11. Слайд 11
- 12. Аналогичная ситуация при числе молекул 24Ω
- 13. Обратный процесс,
- 14. Из сказанного следует, что
- 15. Изолированная система будет самопроизвольно переходить
- 16. Слайд 16
- 17. Статистический вес Ω обычно выражается огромными числами.
- 18. В основе статистической физики
- 19. Эргодическая гипотеза заключаетсяв утверждении, что
- 20. Предположим, что эти подсистемы находятся
- 21. Но оказывается
- 22. В связи с
- 23. В экспериментальной физике от
- 24. Согласно Больцману, энтропия системы и
- 25. В состоянии равновесия в термодинамике и вероятность
- 26. Связь между S и
- 27. Второе начало надо понимать так, что если
- 28. Второе начало термодина-мики есть
- 29. Энтропия – вероятностная статисти-ческая величина. Утверждение
- 30. Энтропия выступает, как мера беспорядочности,
- 31. Клаузиус в 1867 г. выдвинул гипотезу
- 32. Российские физики Я.Б. Зельдович и
- 33. При стремлении температуры к абсолют-ному нулю
- 34. Принцип Нернста был
- 35. Слайд 35
- 36. Основные свойства энтропии:1.
- 37. 5. Максимальное значение энтропии соот-ствует равновесное состояние.6.
- 38. Уве Бремер«Возрастающая энтропия»
- 39. Виктор Бурмин«Энтропия в пространстве не ограниченная во времени»
- 40. Лекция закончена !
- 41. Скачать презентанцию
Лекция № 11 Энтропия и вероятность. 1. Статистический вес макросостояния.2. Формула Больцмана для энтропии равновесного состояния3. Статистический характер закона возрастания энтропии. Флуктуации. Наиболее вероятное распределение системы по
Слайды и текст этой презентации
Слайд 2 Лекция № 11
Энтропия и вероятность.
1.
Статистический вес макросостояния.
Статистический характер закона возрастания энтропии. Флуктуации. Наиболее вероятное распределение системы по микросостояниям.Слайд 3 Статистический смысл энтропии
Посмотрим на
энтропию с другой стороны. Более глубокий смысл энтропии вскрывается в
статистической физике: энтропия связывается с термодинамической вероятностью состояния системы или статистическим весом.Слайд 4Термодинамическая вероятность состояния системы - это число способов,
которыми может быть реализовано данное состояние макроскопической системы, или число
микросостояний, осуществляющих данное макросостояние (т.е. термодинами-ческая вероятность не есть вероятность в математическом смысле).Слайд 5 Макросостояние – это состояние вещества, характеризуемое его термодинамическими парамет-рами
(объемом, давлением, температурой и т. д.) . Состояние системы, характеризуемое состоянием
каждой входящей в систему молекулы, называют микросостоянием.Слайд 6Так как молекулы движутся хаотически, то имеется много микросостояний, соот-ветствующих
одному макросостоянию. Обозначим Ω число микросостояний соответствующее данному макросостоянию
(как правило Ω >> 1).Термодинамической вероятностью или статистическим весом макросостояния Ω называется число микросостояний, осуществляющих данное макросостояние.
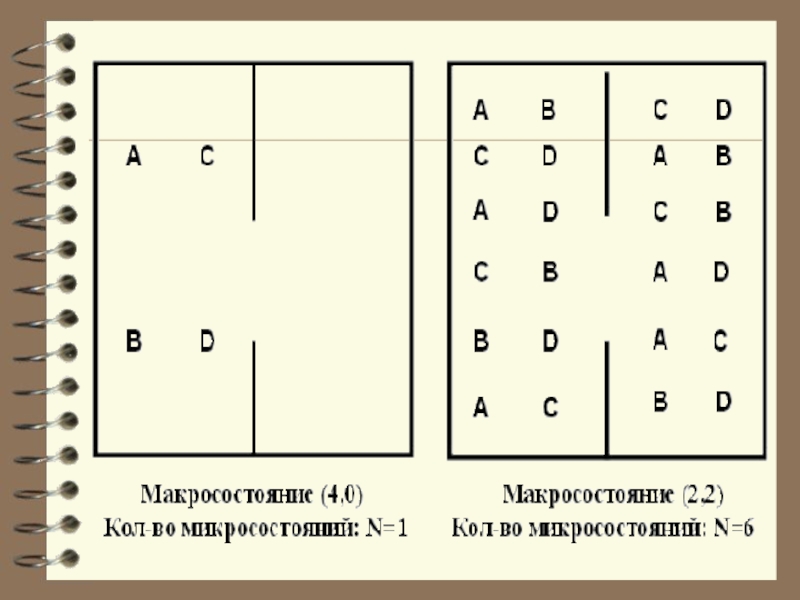
Слайд 7 Термодинамической вероятностью или статистическим весом макросостояния Ω называется
число перестановок одноименных элементов, при которых сохраняется данное макросостояние.
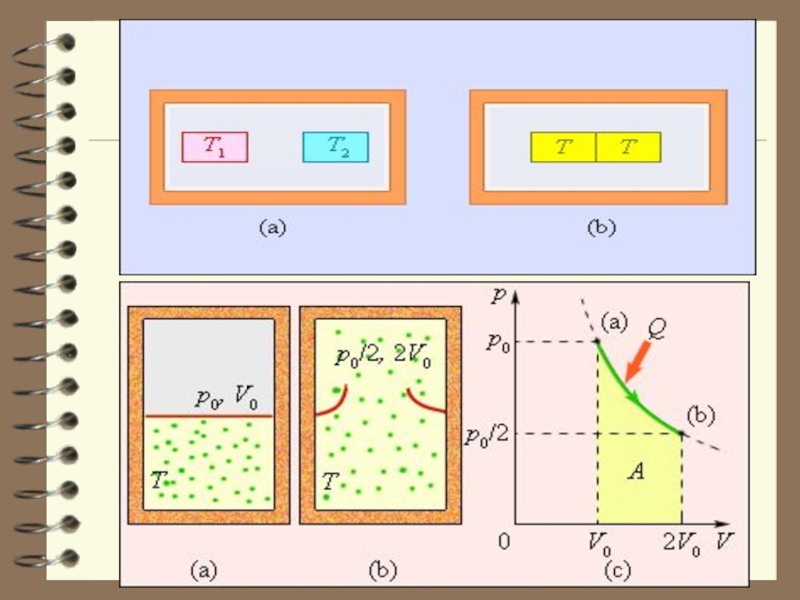
Термодинамическая вероятность Ω максимальна, когда система находится в равновесном состоянии.Слайд 8 Чтобы пояснить понятие статистичес-кого веса (термодинамической вероят-ности), рассмотрим способы,
которыми молекулы газа могут распределиться между двумя половинами сосуда.
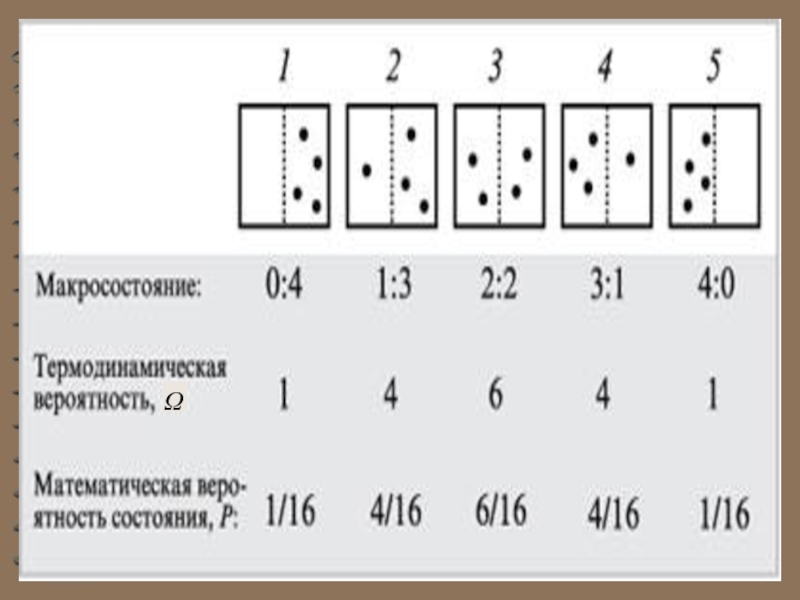
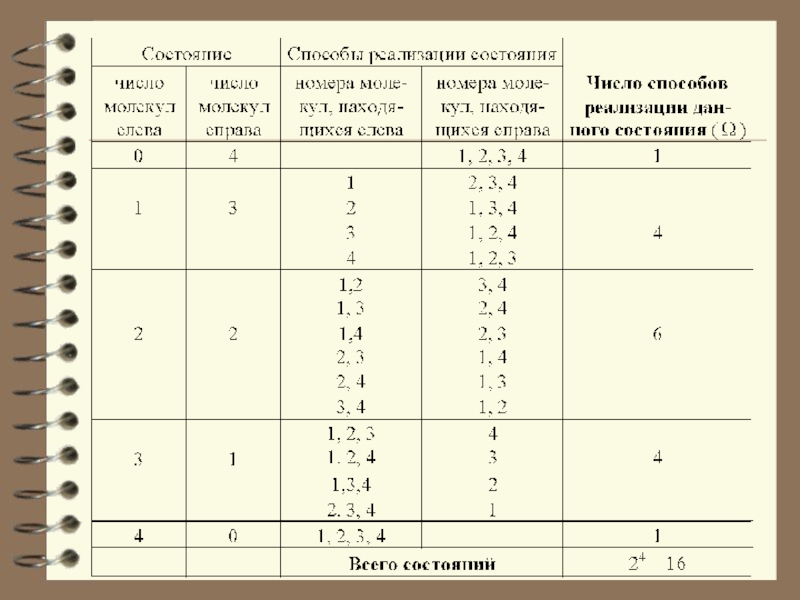
В начале сосуд разделен перегородкой и все молекулы собраны только в одной половинке. Далее удаляется перегород-ка и изучается распространение газа в сосуде. Рассмотрим ситуацию с 4-мя молекулами.
Слайд 13 Обратный процесс, в результате которого
газ самопроизвольно собрался бы в одной из половин сосуда, невозможен.
Это обусловлено тем, что вероятность состояния, при котором молекулы газа распределены поровну между обеими половинами сосуда, очень велика, а вероятность состояния, при котором все молекулы газа находились бы в одной из половин сосуда, практически равна нулю.Слайд 14 Из сказанного следует, что для того чтобы
определить, какие процессы могут протекать в изолированной термодинамической системе, нужно
знать вероятность различных состояний этой системы. Величина, которая служит для характеристики вероятности состояний, получила название энтропии. Эта величина является, подобно внутренней энергии, функцией состояния системы.Слайд 15 Изолированная система будет самопроизвольно переходить из менее вероятных
в более вероятные состояния либо преимущественно находиться в состоянии, вероятность
которого максимальна.Для того, чтобы определить, какие
процессы могут протекать в изолированной термодинамической системе, нужно знать вероятность различных состояний системы.
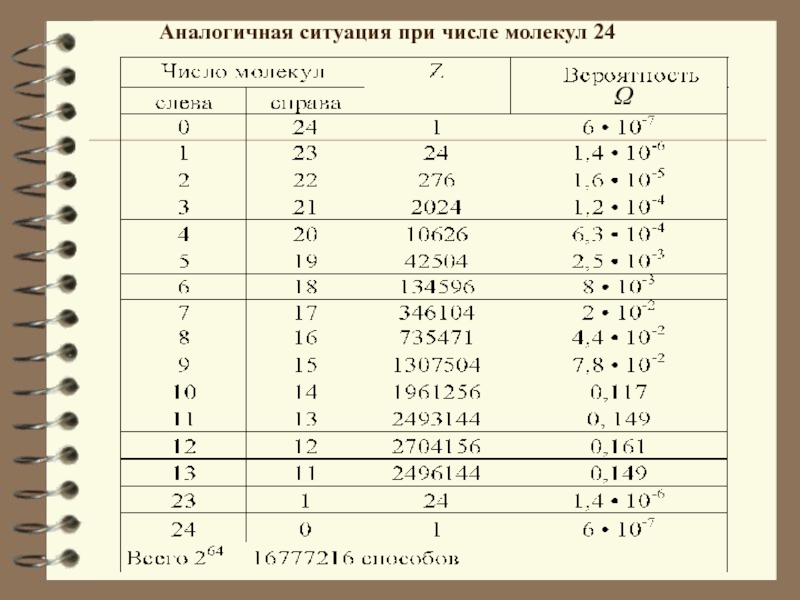
Слайд 17Статистический вес Ω обычно выражается огромными числами. Так, например, для
одного моля кислорода при атмосферном давлении и комнатной температуре:
Слайд 18 В основе статистической физики лежит предположение о
том, что все микросостояния данной термодина-мической системы равновероятны.
Отсюда следует, что вероятность макросостояния пропорциональна его статистическому весу Ω .Утверждение о равновероятности всех микросостояний носит название эргодической гипотезы.
Слайд 19 Эргодическая гипотеза заключается
в утверждении, что все микросостояния
данной
термодинамической системы
равновероятны. Следовательно, веро-ятность макросостояния пропорцио-нальна его статистическому весу.
Использовать статистический вес в качестве величины определяющей
вероятность состояния неудобно, так
как он неаддитивен.
Разобъем данную систему на две не взаимодействующие подсистемы.
Слайд 20 Предположим, что эти подсистемы находятся в состояниях с
весами
и Каждое из
микросостояний первой подсистемы может реализовы-ваться совместно с каждым из
микросостояний второй подсистемы. Всего возможно различных комбинаций микросостояний под-систем, каждая из которых является микросостоянием системы. То есть
статистический вес состояния системы равен Т.е. статистичес-кий вес не аддитивен.
Слайд 21 Но оказывается свойством аддитивности обладает
логарифм статистического веса. А иметь дело с аддитивными величинами много
проще и удобнее. Аддитивной величиной является логарифм Ω:Слайд 22 В связи с этим в качестве
характеристики вероятности состояния системы принимается величина:
называемая энтропией системы. Определенная
так энтропия используется в теоретической физике, где обычно не приходится иметь дело с числовыми значениями величин. Слайд 23 В экспериментальной физике от величины
переходят к величине
, которая также называется энтропией: Для одного моля кислорода при комнатной температуре и атмосферном давлении указанному ранее значению соответствует
Слайд 24 Согласно Больцману, энтропия системы и термодинамическая вероятность связаны
между собой следующим образом (формула Больцмана):
где k - постоянная Больцмана.
Слайд 25 В состоянии равновесия в термодинамике и вероятность максимальна и энтропия
максимальна. Из этого можно сделать вывод, что между ними существует
связь. Энтропия S – аддитивная величина: , т.е. она равна сумме энтропий тел, входящих в систему.Слайд 26 Связь между S и Ω позволяет несколько иначе
сформулировать второе начало термодинамики: всякий процесс в природе протекает так,
что система переходит в состояние вероятность которого больше.Слайд 27Второе начало надо понимать так, что если система находится в
каком-то состоянии с данной энтропией, то с подавляющей вероятностью следует,
что она перейдёт в состояние с боль-шей энтропией, т.е. что наиболее вероятным изменением энтропии является ее возрастание.Этот закон возрастания энтропии оп-равдывается практически с абсолют-ной достоверностью.
Слайд 28 Второе начало термодина-мики есть статистический закон, согласно
которому отступления от термодинами-ческого равновесия – флуктуации – не только
возможны, но и неизбежны.Слайд 29 Энтропия – вероятностная статисти-ческая величина. Утверждение о возрастании энтропии
потеряло свою категоричность. Её увеличение вероятно, но не исключаются флуктуации.
Случайные отклонения значений ка-кой-то физической величины x от её от среднего значения < x > называют флуктуациями этой величины:Слайд 30 Энтропия выступает, как мера беспорядочности, хаотичности состояния.
Например, в ящике сиреневые и белые шары. Они порознь, есть
порядок и Ω невелика. После встряхивания – шары перемещаются и Ω– увеличивается и энтропия тоже увеличивается. И сколько бы не встряхивать потом ящик, никогда сиреневые шары не соберутся у одной стенки, а белые у другой, хотя эта вероятность не равна нулю.Слайд 31 Клаузиус в 1867 г. выдвинул гипотезу о тепловой смерти
Вселенной.
Л. Больцман один из первых опроверг эту гипотезу и
показал, что закон возрастания энтропии – статистический закон, т.е. возможны отклонения. Слайд 32 Российские физики Я.Б. Зельдович и И.Д. Новиков, так
же опровергли эту теорию, и показали, что Р. Клаузиус не
учел, что Вселенная не стационарна и в будущем не перейдет к одному состоянию, так как она эволюционирует, остается не статичной. Энтропия системы – максимальна, при достижении замкнутой системой равновесного состояния.Слайд 33 При стремлении температуры к абсолют-ному нулю ( Т= 0
К ) уменьшается хаотич-ность системы. В пределе всякое тело будет
находиться в состоянии, статистический вес которого равен единице ( Ω = 1).Вывод: энтропия любого тела стремится
к нулю при стремлении к нулю температу-ры: Это утверждение называется теоремой Нернста или третьим началом термодинамики.
Слайд 34 Принцип Нернста был развит Планком, предположившим,
что при абсолютном нуле температуры энергия системы минимальна (но не
равна нулю). Тогда можно считать, что при абсолютном нуле система имеет одно квантовое состояние: значит термодинамическая вероятность Ω при Т = 0 К должна быть равна единице, что недостижимо (прин-цип недостижимости абсолютного нуля температур)Слайд 36 Основные свойства энтропии:
1. Энтропия является функцией
состояния.
Для вычисления энтропии системы в дан-ном состоянии относительно какого-ни-будь состояния,
принятого за нулевое, нужно вычислить значение при обратимом процессе.
3. Энтропия изолированной системы оста-ётся постоянной, если система претерпе-вает обратимое изменение состояния.
4. Энтропия изолированной системы, необ-ратимо изменяющей своё состояние, воз-растает.