Слайд 1Термодинамика и статистическая физика
Слайд 2 Лекция № 8
Закон распределения скоростей
Максвелла.
1. Пространство скоростей. Принцип
деталь-ного равновесия.
2. Распределение молекул газа по скоростям
в условиях термодинамического равновесия.
3. Закон распределения скоростей Максвелла. Характерные скорости молекул.
Слайд 3 Возьмём газ, состоящий из очень большого числа
N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при
определённой температуре ( т.е. в условиях термодинамического равновесия ). Предполагается, что силовые поля, действующие на газ, отсутствуют.
В газе в состоянии хаотического движения должны компенсировать
Слайд 4друг друга всякие два противоположно направленные процесса. Скорости таких противоположно
направленных процессов должны быть одинаковыми. Это положение называется принципом детального
равновесия. Если бы оно не выполнялось, то тепловое движение молекул в какой-то мере устранило бы беспорядочный характер и приобрело бы черты, свойственные упорядоченному Принцип детального равновесия справед-лив для любых систем в состоянии хаоса.
Слайд 5 Закон распределения скоростей молекул при тепловом равновесии
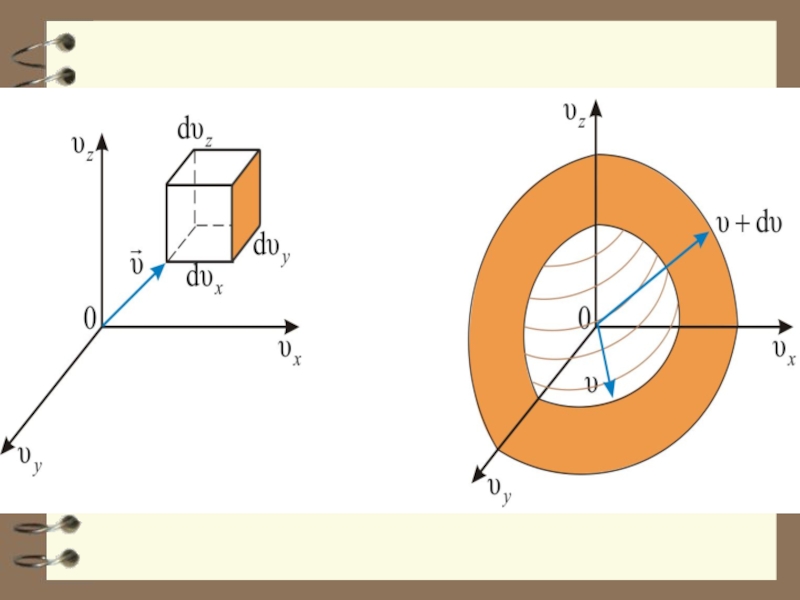
Возьмём
в воображаемом пространстве, которое назовём υ – пространством (пространством
скоростей), прямоуго-льные координатные оси, по которым будем откладывать значения отдельных молекул (имеются в виду компоненты скорости по осям x, y, z, взятым в обычном пространстве).
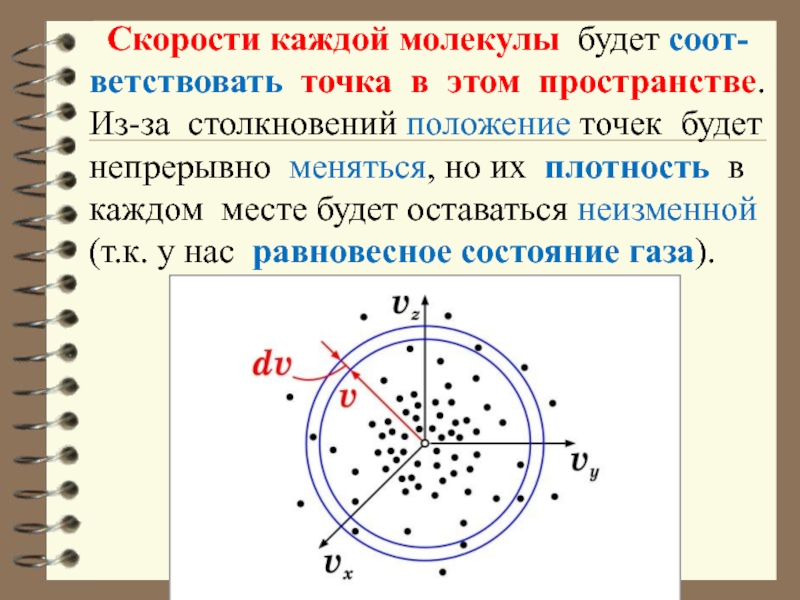
Слайд 6 Скорости каждой молекулы будет соот-ветствовать точка в этом пространстве.
Из-за столкновений положение точек будет непрерывно меняться, но их плотность
в каждом месте будет оставаться неизменной (т.к. у нас равновесное состояние газа).
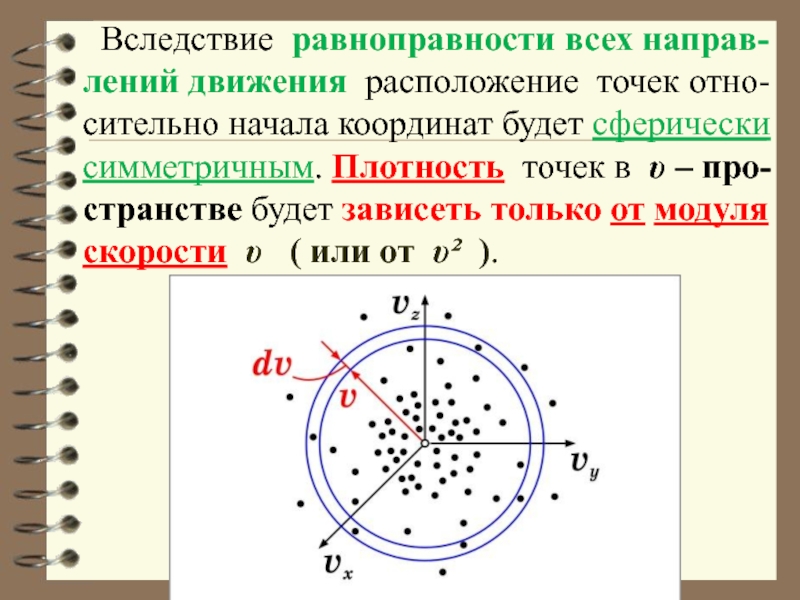
Слайд 7 Вследствие равноправности всех направ-лений движения расположение точек отно-сительно начала
координат будет сферически симметричным. Плотность точек в υ – про-странстве
будет зависеть только от модуля скорости υ ( или от υ² ).
Слайд 8 Определить распределение моле-кул по скоростям вовсе не значит, что нужно
определить число молекул, обладающих той, ли иной заданной скоростью. Ибо
число молекул, приходящихся на долю каждого значения скорости равно нулю.
Вопрос должен быть поставлен так: «Сколько молекул обладает скоростями, лежащими в интервале, включающем заданную скорость».
Слайд 9 Итак, молекулы движутся хаотически. Среди них есть и
очень быстрые, и очень медленные. Благодаря беспорядочному движению и случайному
характеру их взаимных столкновений, молекулы определённым образом распределяются по скоростям. Это распределение оказывается однозначным и единственно возможным, и не только не противоречит хаотическому движению, но именно им и обусловлено.
Слайд 10 Мы будем искать число частиц (n) скорости
которых лежат в определён-ном интервале значения скорости υ ( т.е.
от υ до ).
Здесь n – число благоприятных частиц, попавших в этот интервал.
Очевидно, что в единице объёма число таких благоприятных частиц тем больше, чем больше υ.
Слайд 11 Ясно так же, что n должно быть пропорционально концентрации молекул
n . Число n зависит и от самой скорости, так
как в одинаковых по величине интервалах, но при разных абсолютных значениях скорости, число молекул будет различным.
Смысл сказанного легко понять из простого примера: неодинаково, число людей в возрасте от 20 до 21 года и от 90 до 91 года.
И так:
Здесь f (υ) – функция распределения молекул по скоростям, n – концентрация молекул и υ - интервал значений скоростей.
В пределе, получим:
Физический смысл f(υ) в том, что это отношение числа молекул, скорости которых лежат в определенном интерва-ле скоростей, к общему числу молекул в единичном интервале
скоростей:
Слайд 13 Таким образом, f(υ) – имеет смысл
вероятности, то есть показывает, какова вероятность любой молекулы газа в
единице объёма иметь скорость, заключён-ную в единичном интервале, вклю-чающем заданную скорость υ.
В данном случае f(υ) называют плотностью вероятности.
Слайд 14Функция распределения Максвелла
Пусть имеется n тождественных молекул, находящихся в
состоянии беспорядочного теплового движения при определенной температуре. После каждого акта
столкновения между молекулами, их скорости меняются случайным образом.
В результате невообразимо большого числа столкновений устанавливается стационарное равновесное состояние, когда число молекул в заданном интервале скоростей сохраняется постоянным.
Слайд 15 В результате каждого столкно-вения проекции скорости молекулы
испытывают случайное изменение на υx, υy, υz, причем изменения каждой
проекции скорости незави-симы друг от друга.
Найдем в этих условиях, каково число частиц dn из общего числа n имеет скорость в интервале
от до .
Слайд 16 При этом, мы не можем ничего определенного сказать о точном
значении скорости той или иной частицы υi, поскольку за столкновениями
и движениями каждой из молекул невозможно проследить ни в опыте, ни в теории. Такая детальная информация вряд ли имела бы практическую ценность.
Распределение молекул идеального газа по скоростям впервые было получено знаменитым английским ученым
Дж. Максвеллом в 1860 году с помощью методов теории вероятностей.
Максвелл Джеймс Клерк
(1831 – 1879) –
английский физик.
Работы посвящены
электродинамике,
молекулярной физике,
общей статике, оптике,
механике, теории упругос-
ти. Установил статистический закон,
описывающий распределение молекул
газа по скоростям.
Слайд 18 Скорость – векторная величина. Для проекции скорости на ось х
(x-ой составляющей скорости ), имеем:
или
где А1 из условия нормировки.
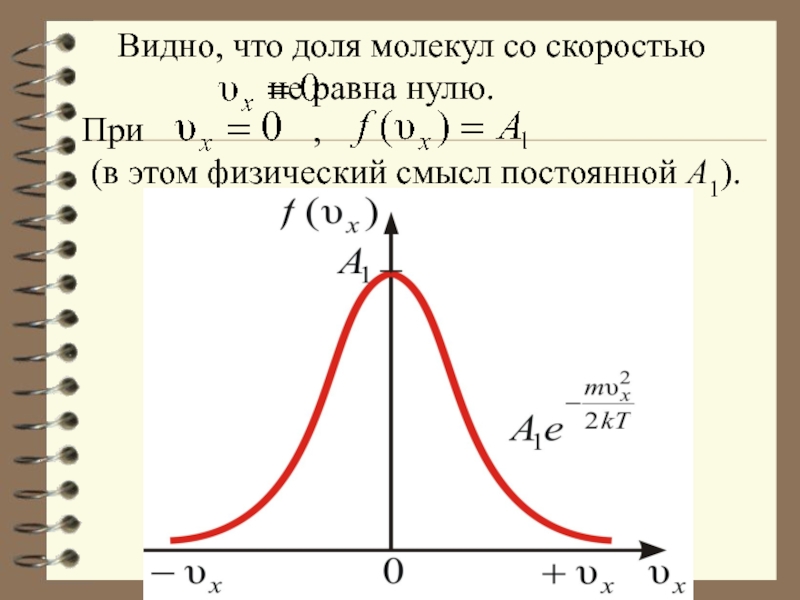
Слайд 19 Видно, что доля молекул со скоростью
не равна нулю.
При ,
(в этом физический смысл постоянной А1).
Слайд 20 Приведённое выражение и график справедливы для распределения молекул газа по
x-ым компонентам скорости. Очевидно, что и по y–ым и z–ым
компонентам скорости также можно получить:
Слайд 21 Вероятность того, что скорость молекулы одновременно удовлетворяет трём
условиям: x – компонента скорости лежит в интервале от υх
до ; y – компонента, в интервале от υy до ; z – компонента, в интервале от υz до будет равна произведению вероятностей каждого из условий в отдельности:
где ,
Этой формуле можно дать геометричес-кое истолкование: dnxyz – это число моле-кул в параллелепипеде со сторонами dυx, dυy, dυz, то есть в объёме , находящемся на
расстоянии от
начала координат
в пространстве
скоростей.
Слайд 23 Величина dnxyz не может зависеть от направления вектора
скорости. Поэтому надо получить функцию распределения молекул по скоростям независимо
от их направления, то есть по абсолютному значению скорости.
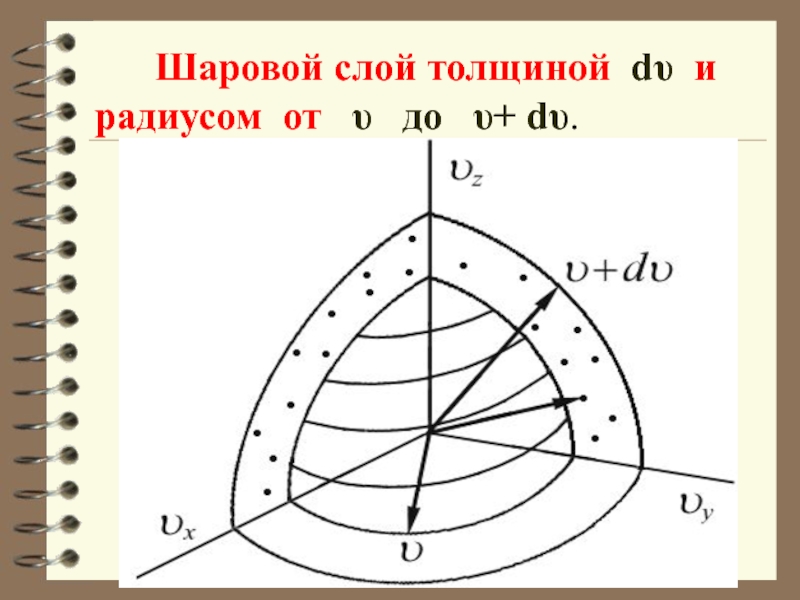
Если собрать вместе все молекулы в единице объёма, скорости которых заключены в интервале от υ до по всем направлениям, и выпустить их, то они окажутся через одну секунду в шаро-вом слое толщиной dυ и радиусом υ.
Слайд 24 Шаровой слой толщиной dυ и радиусом от
υ до υ+ dυ.
Слайд 26 Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось
выше.
Объём этого шарового слоя:
Общее число молекул в слое:
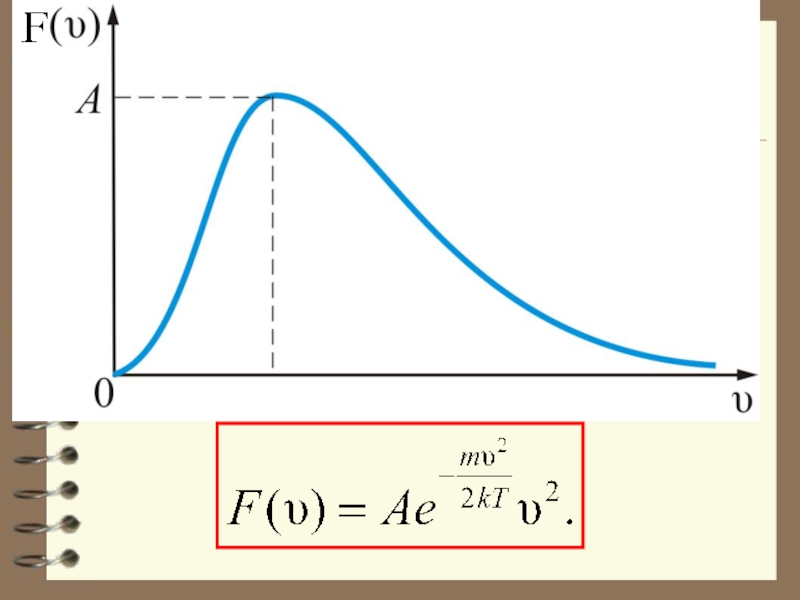
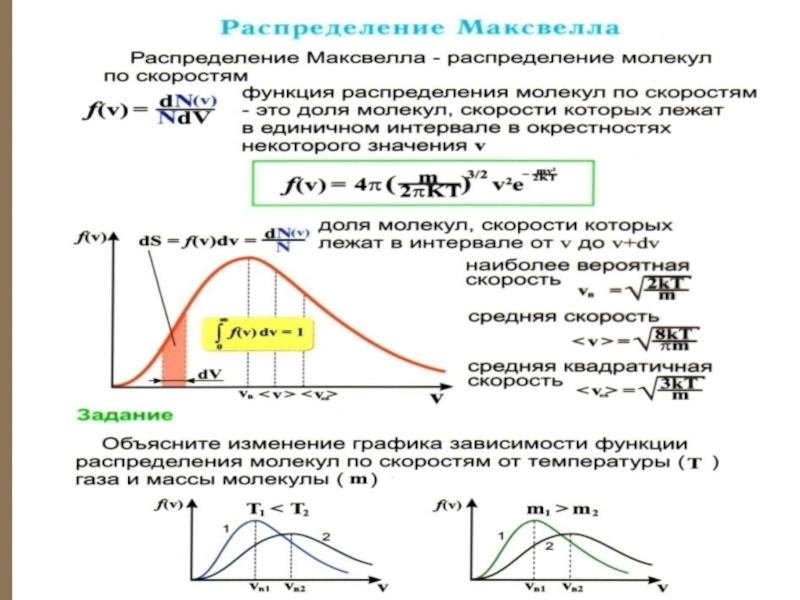
Слайд 27 Отсюда следует закон Максвелла – распределение молекул по абсолютным значениям
скоростей:
где – доля всех частиц единичного объёма, скорости которых лежат в интервале от υ до
получаем плотность вероятности, или функцию Максвелла
распределения молекул по скоростям:
Эта функция обозначает долю молекул единичного объёма газа, абсолютные скорости которых заключены в единичном интервале скоростей, включающем данную скорость.
тогда получим:
График этой функции показан на рис.
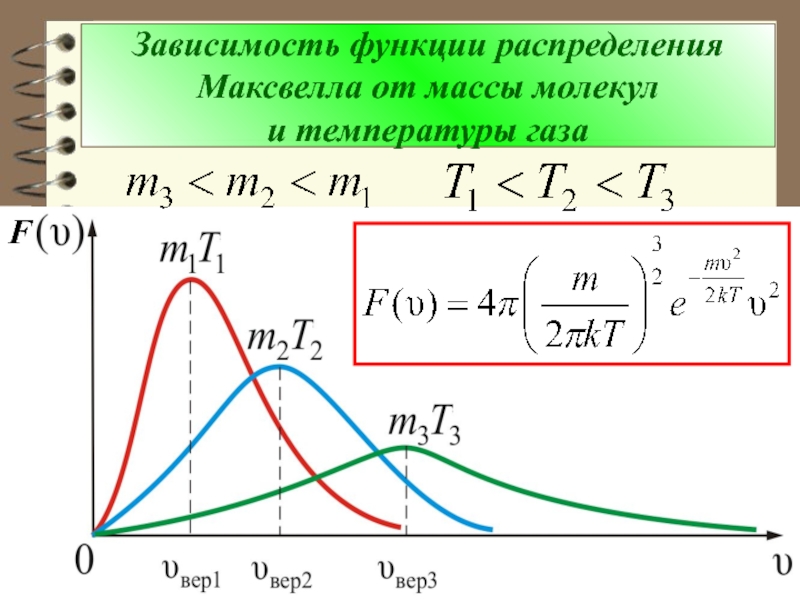
Слайд 31Выводы:
- Вид распределения молекул газа по скоростям, для каждого
газа зависит от рода газа (m) и от параметра состояния
(Т). Давление P и объём газа V на распределение молекул не влияют.
- В показателе степени стоит отношение, кинетической энергии, соответствующей данной скорости υ к средней энергии теплового движения молекул при данной температуре:
Слайд 32 Распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то
есть показывает, какова вероятность при данной температуре иметь именно такое
значение кинетической энергии).
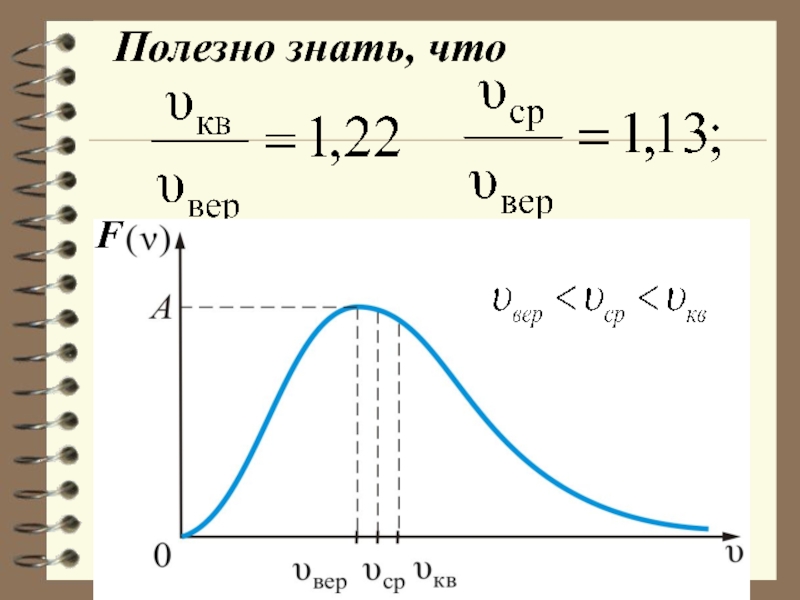
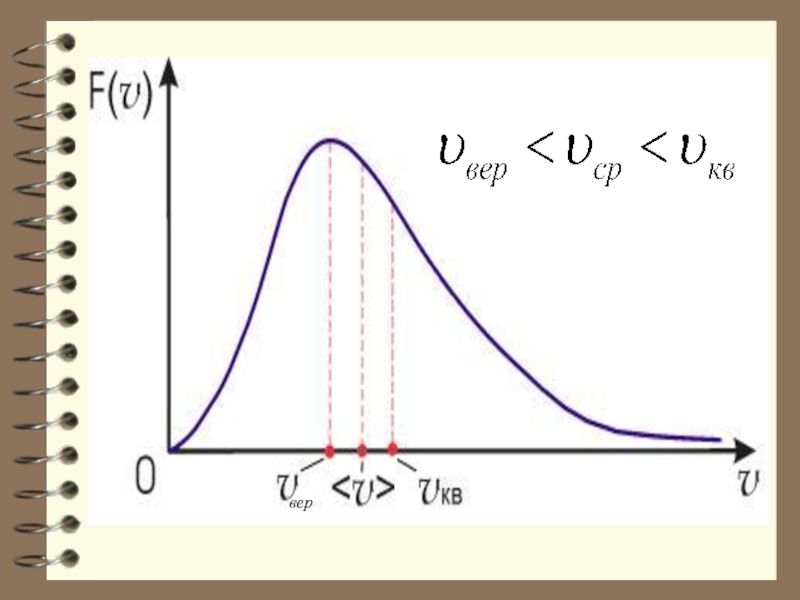
Слайд 33Характерные скорости (наиболее вероят-ная, среднеквадратичная и средняя скорости молекул газа).
Рассмотрим,
как изменяется с абсолютной величиной скорости число частиц, приходящихся на
единичный интервал скоростей, при единичной концентрации частиц.
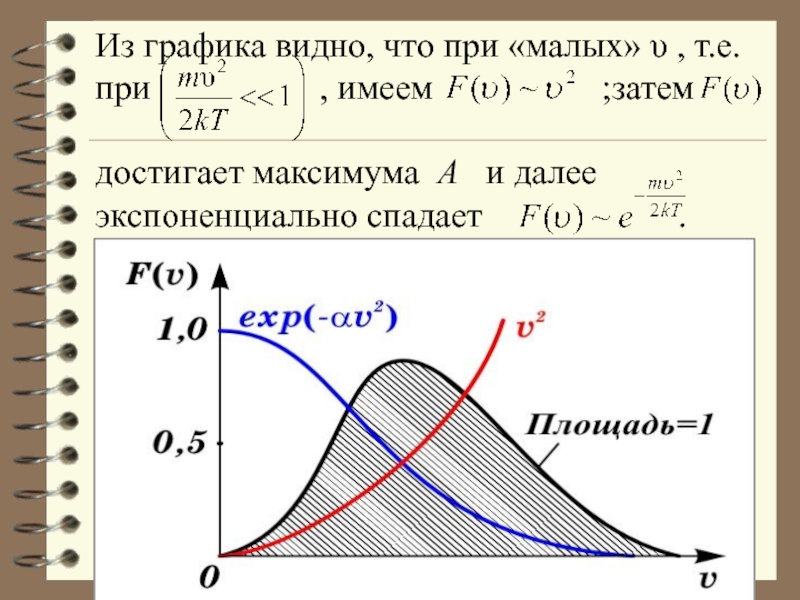
Слайд 34Из графика видно, что при «малых» υ , т.е. при
,
имеем ;затем
достигает максимума А и далее экспоненциально спадает .
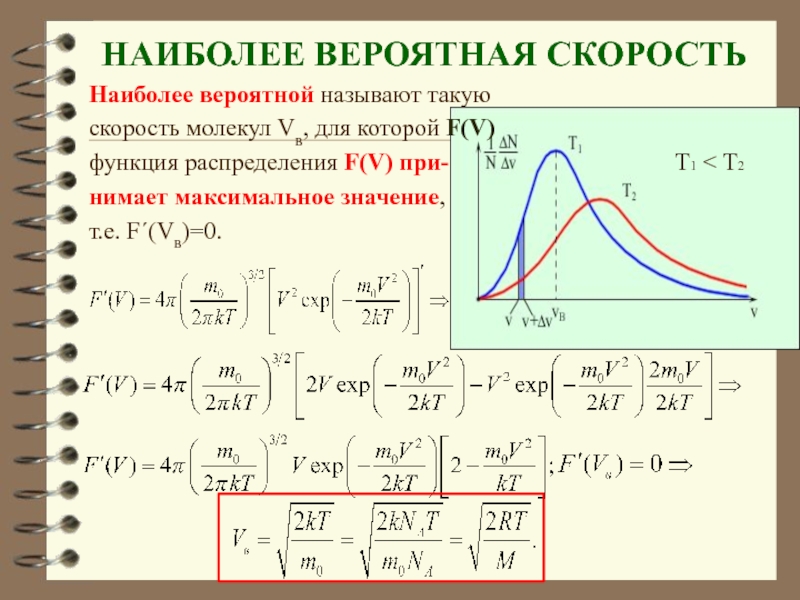
Слайд 35НАИБОЛЕЕ ВЕРОЯТНАЯ СКОРОСТЬ
Наиболее вероятной называют такую
скорость молекул Vв, для которой
F(V)
функция распределения F(V) при-
Т1 < Т2
нимает максимальное значение,
т.е. F΄(Vв)=0.
Слайд 36 Величина скорости, на которую при-ходится максимум зависимости
называют наиболее вероятной скоростью
. Величину этой скорости находят из условия равенства нулю производной:
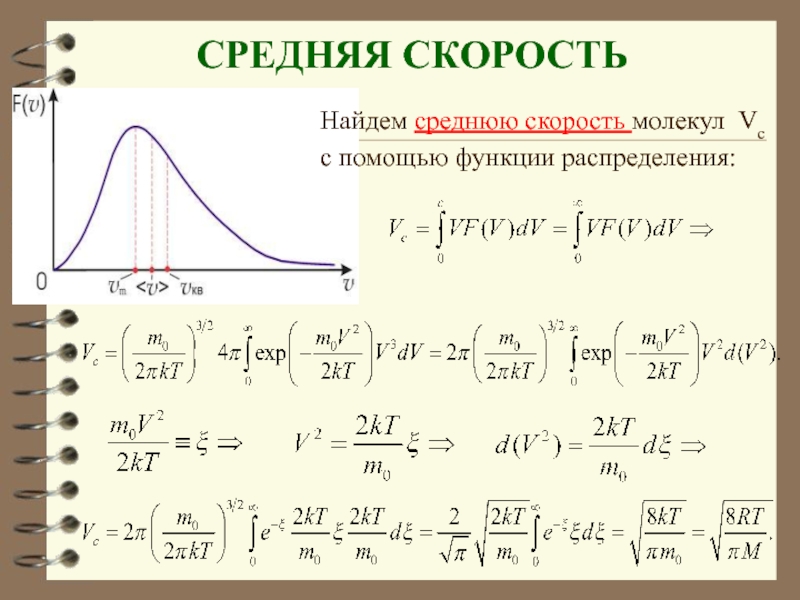
Слайд 37 СРЕДНЯЯ СКОРОСТЬ
Найдем среднюю скорость молекул Vc
с помощью функции распределения:
Слайд 38 Средняя скорость υср
где
– число молекул со скоростью от υ до . Если подставить сюда F(υ) и вычислить, то получим:
или
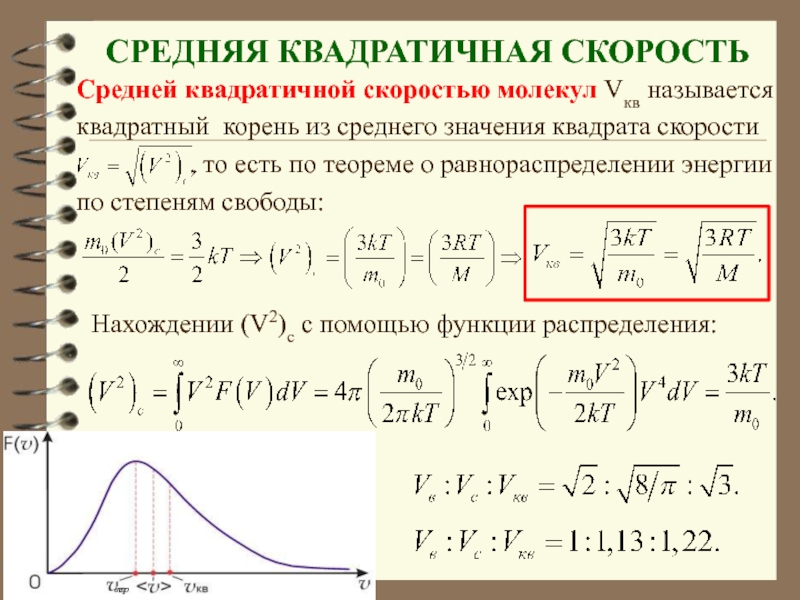
Слайд 39 СРЕДНЯЯ КВАДРАТИЧНАЯ СКОРОСТЬ
Средней квадратичной скоростью молекул Vкв называется
квадратный корень
из среднего значения квадрата скорости
, то есть по теореме о равнораспределении энергии
по степеням свободы:
Нахождении (V2)c с помощью функции распределения:
вер
Среднюю квадратичную скорость находят используя соотношение :
Слайд 43Зависимость функции распределения Максвелла от массы молекул
и температуры газа
F
Слайд 44 Из рис. можно проследить за измене-нием
при изменении m и T:
(при ) или (при
).
Площадь под кривой величина посто-янная, равная единице ( ), поэтому важно знать как будет изменяться положение максимума кривой: