Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
типы химических реакций на примере свойств воды — копия
Содержание
- 1. типы химических реакций на примере свойств воды — копия
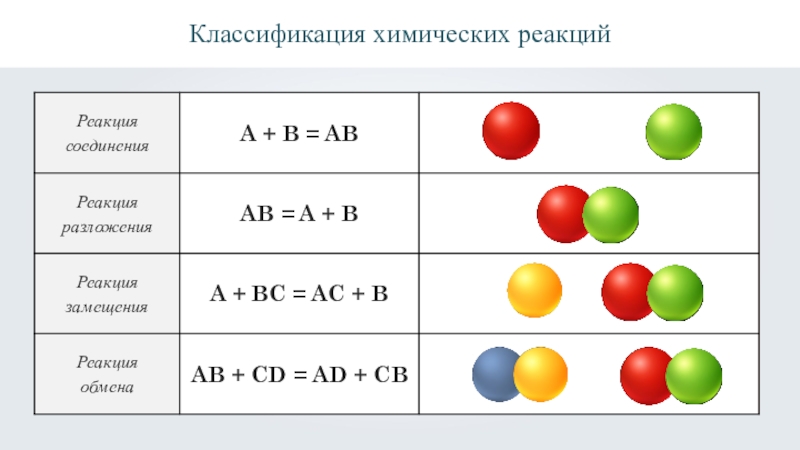
- 2. Классификация химических реакций
- 3. Слайд 3
- 4. Вода — универсальный растворитель.
- 5.
- 6. Слайд 6
- 7. Реакции разложения воды2Н2О → 2Н2↑ + О2↑
- 8. Слайд 8
- 9. фотолиз
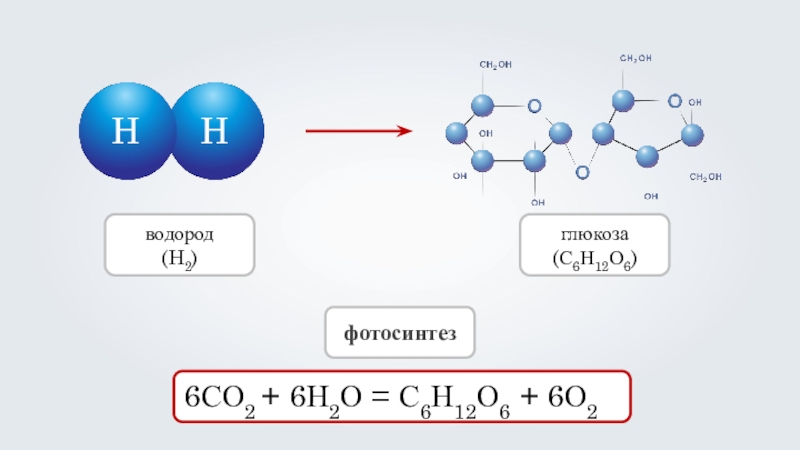
- 10. HH6СО2 + 6Н2О = С6Н12О6 + 6О2фотосинтезводород(H2)глюкоза(С6Н12О6)
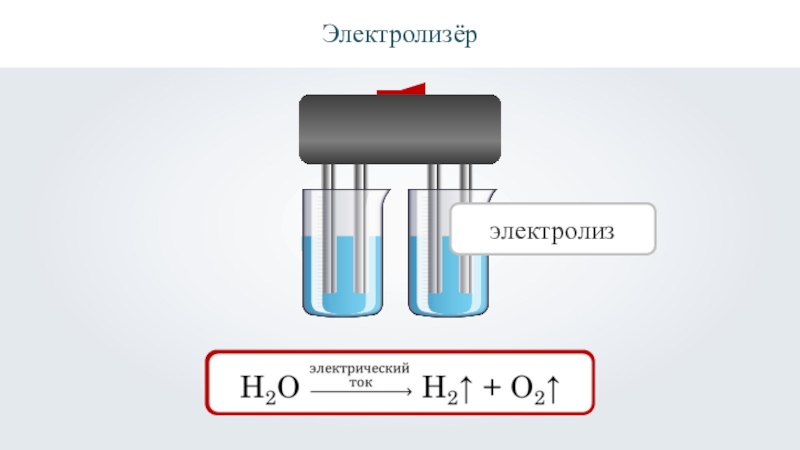
- 11. Электролизёр электролиз
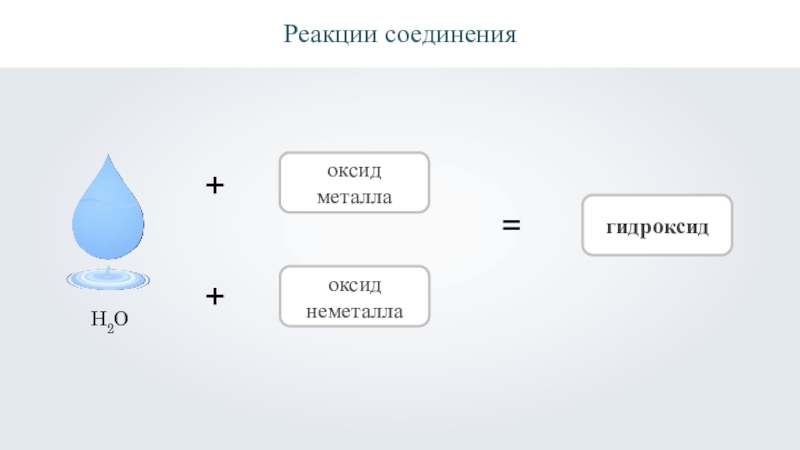
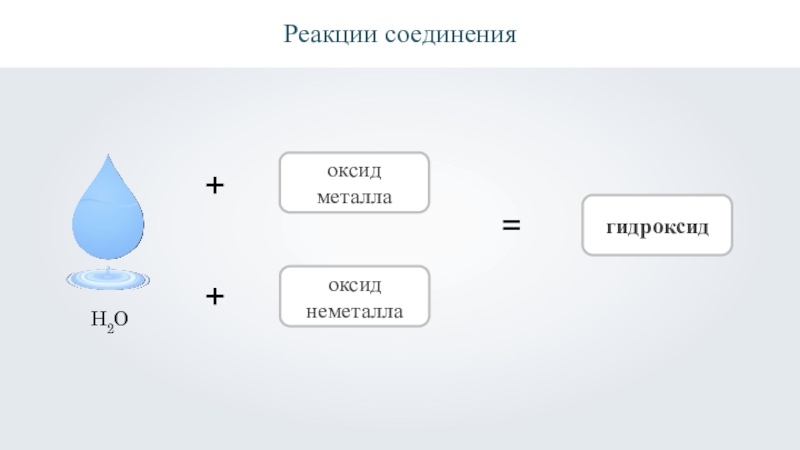
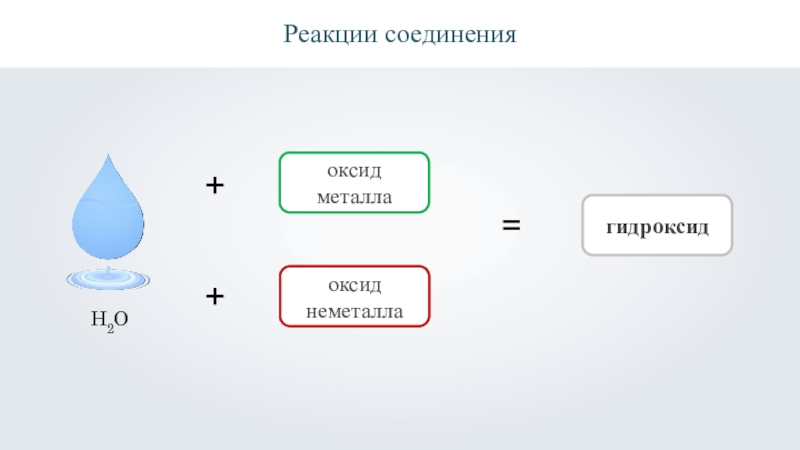
- 12. Реакции соединения++оксид металлаоксид неметалла=гидроксидH2O
- 13. Гидроксиды – это кислородосодержащие кислоты и основания.
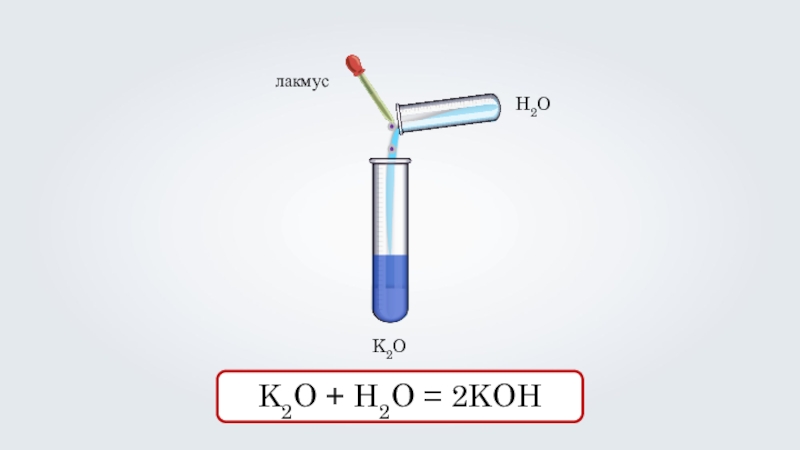
- 14. K2OH2OлакмусK2O + H2O = 2KOH
- 15. Слайд 15
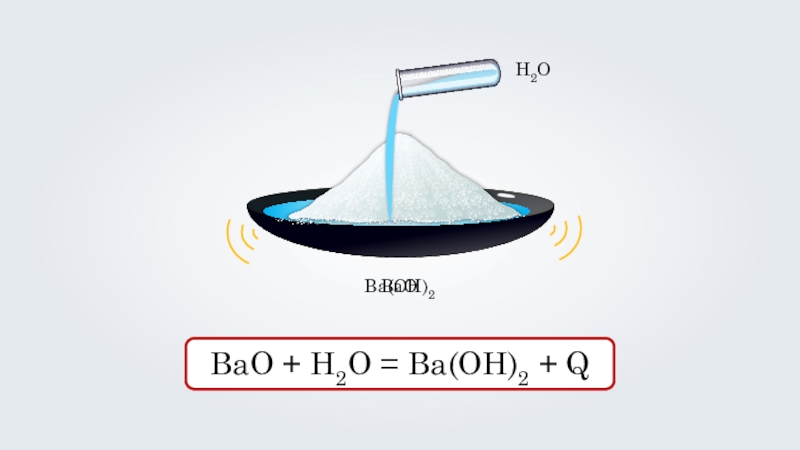
- 16. BaOBaO + H2O = Ba(OH)2 + QH2OBa(OH)2
- 17. Реакции соединения++оксид металлаоксид неметалла=гидроксидH2O
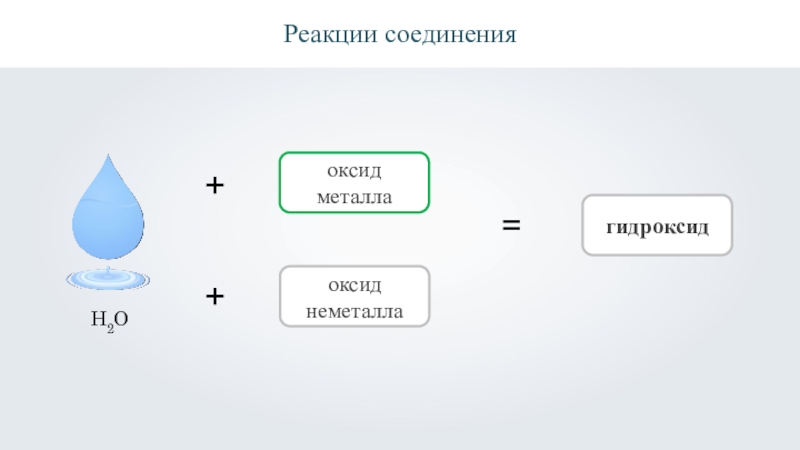
- 18. Реакции соединения++оксид металлаоксид неметалла=гидроксидH2O
- 19. Реакции соединения++оксид металлаоксид неметалла=гидроксидH2O
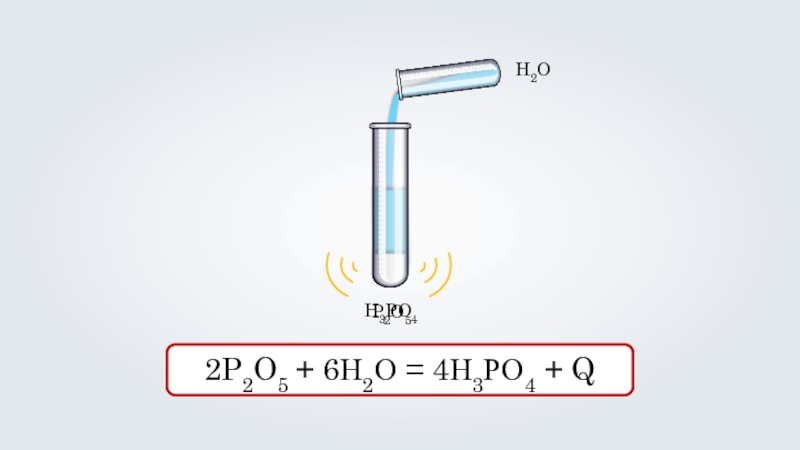
- 20. P2O5H2O2P2O5 + 6Н2О = 4Н3РО4 + Q H3PO4
- 21. кислоты
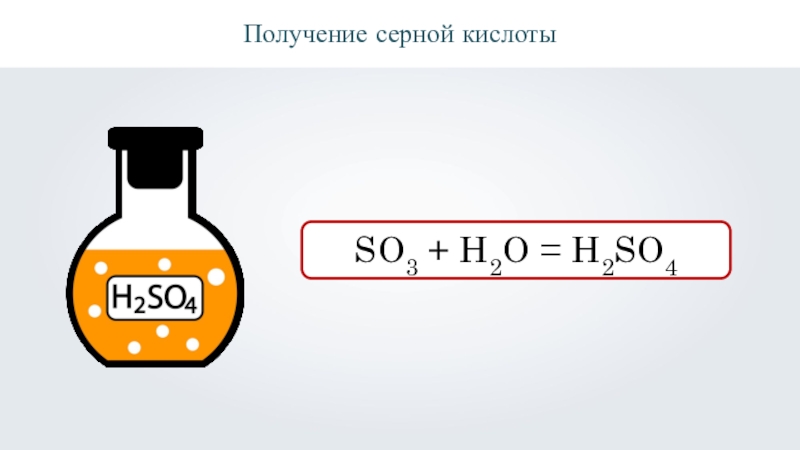
- 22. Получение серной кислотыSO3 + H2O = H2SO4
- 23. Вода реагирует с оксидами металлов и оксидами
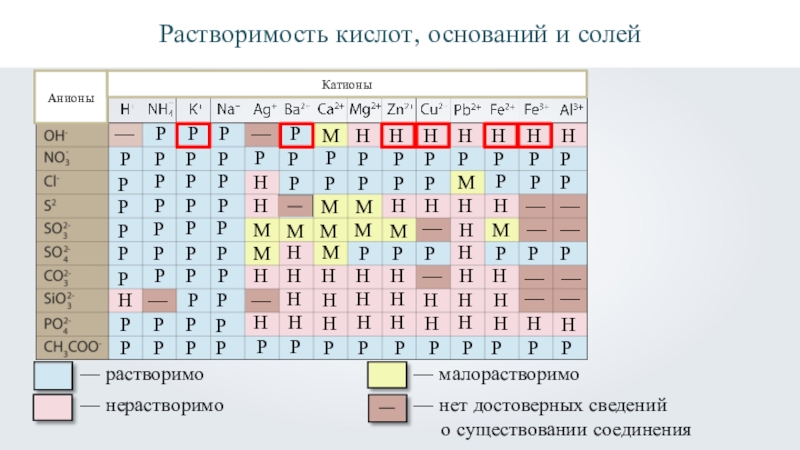
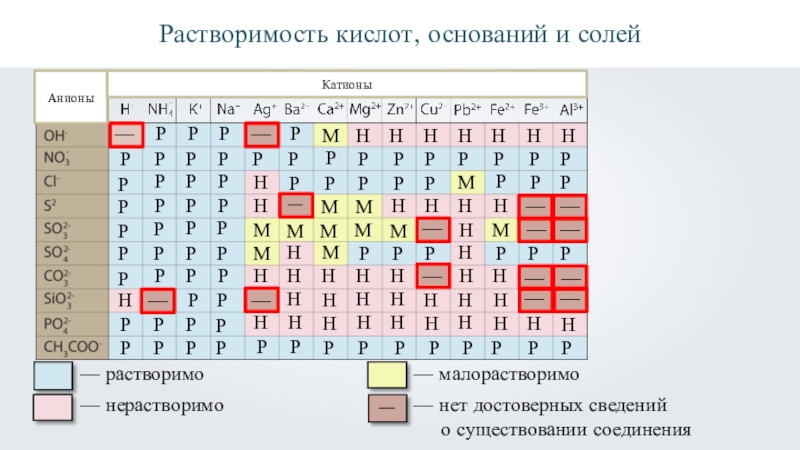
- 24. РРастворимость кислот, оснований и солейАнионыКатионы
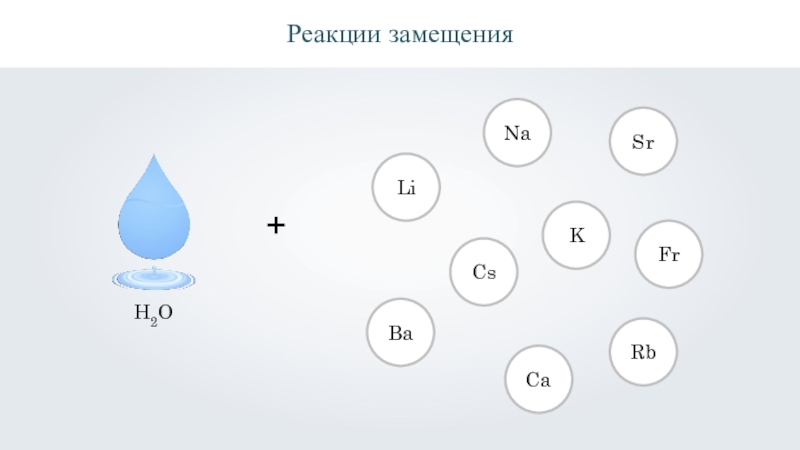
- 25. Реакции замещенияH2O+LiNaKBaCsRbFrSrCa
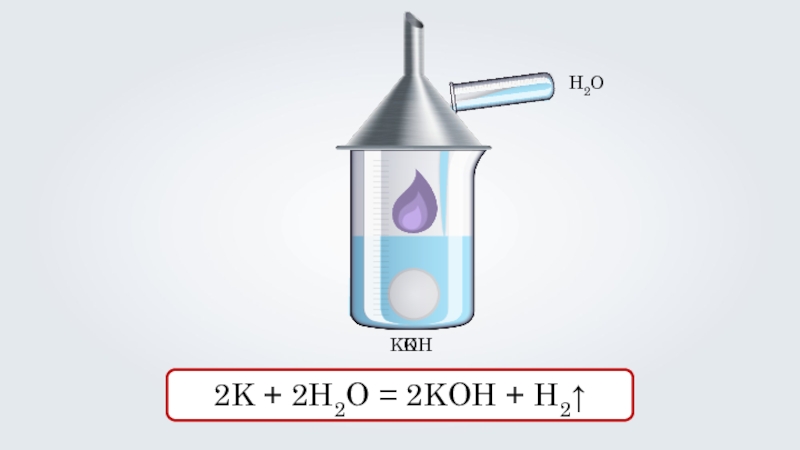
- 26. H2OKKOH2K + 2H2O = 2KOH + H2↑
- 27. H2O+LiNaKBaCsRbFrSrCa
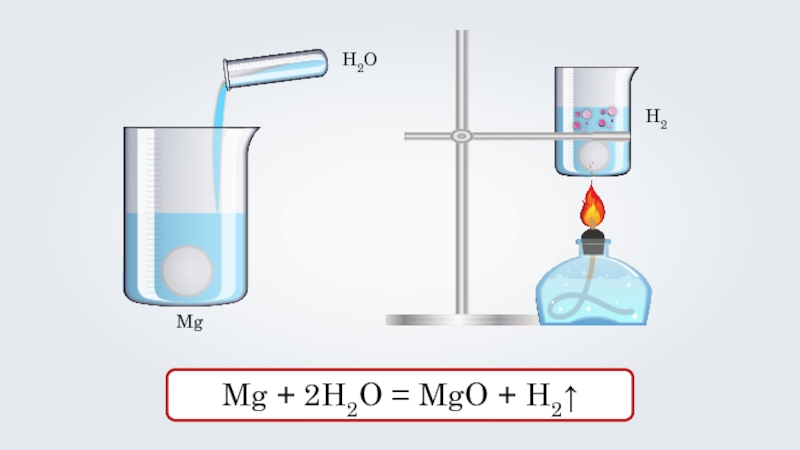
- 28. H2OMgH2Mg + 2H2O = MgO + H2↑
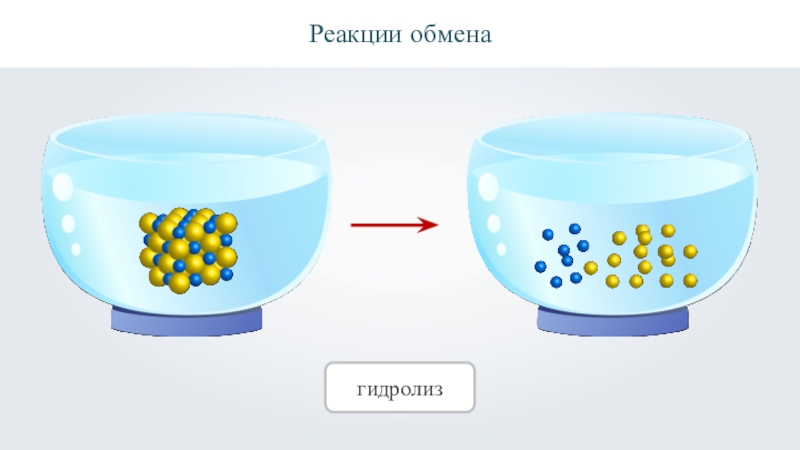
- 29. Реакции обменагидролиз
- 30. Растворимость кислот, оснований и солей АнионыКатионыР—
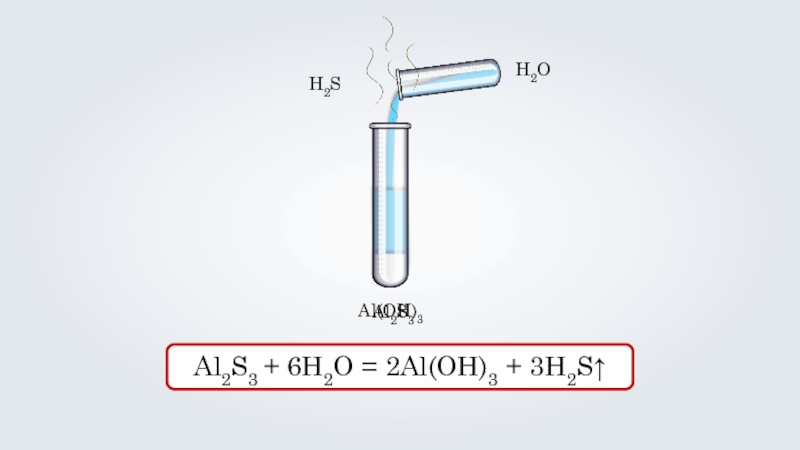
- 31. Al2S3H2OAl2S3 + 6H2O = 2Al(OH)3 + 3H2S↑ Al(OH)3H2S
- 32. Органические соединениябелкижирыуглеводы
- 33. Слайд 33
- 34. Слайд 34
- 35. Слайд 35
- 36. Скачать презентанцию
Классификация химических реакций