Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
Содержание
- 1. Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
- 2. Качественный анализ План лекции1. Предмет аналитической
- 3. 1.Предмет аналитической химии Аналитическая химия –
- 4. 2. Качественный анализ Раздел аналитической химии,
- 5. Количество исследуемого вещества5
- 6. Техника выполнения качественного микроанализа “Сухой” и “мокрый”
- 7. 7
- 8. Техника выполнения качественного анализа (продолжение)3) Метод растирания.Твердое
- 9. Реакция должна сопровождаться аналитическим признаком (аналитическим сигналом).
- 10. Те реакции, для которых необходимы очень малые
- 11. Типы химических реакций, используемых в качественном анализе1.
- 12. Специфические реакции12Примеры: K+ + Na+ + NH4+NH4+
- 13. 3. Дробный и систематический анализыДробным
- 14. Систематический анализПример: обнаружение катионов Ca2+ :CaCl2
- 15. В основу классификации катионов в аналитической химии
- 16. Таблица 1. Сульфидная классификация катионов16
- 17. Таблица 2 . Кислотно-основная классификация катионов17
- 18. Обнаружение катионов первой аналитической группы
- 19. Обнаружение катионов первой аналитической группы (продолжение)
- 20. Обнаружение катионов второй аналитической группы (см. слайд
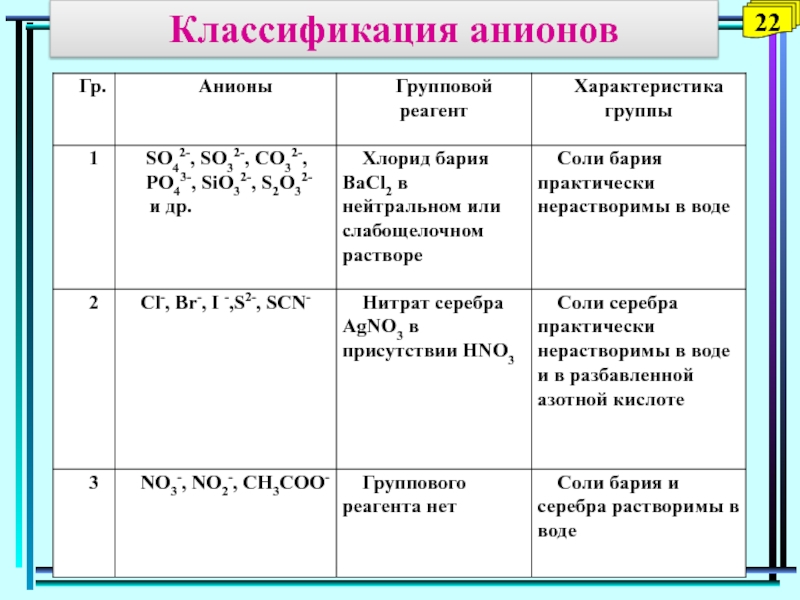
- 21. 5. Аналитическая классификация анионов Анионы - отрицательно
- 22. Классификация анионов22
- 23. Обнаружение анионов1. Анионы первой аналитической группыОткрытие сульфат-аниона
- 24. Применение катионов 1 и 2 аналитических групп
- 25. Внутриклеточная концентрация ионов натрия составляет менее 10
- 26. С ионами Nа+ связано осмотическое давление
- 27. Ионы Nа+ и К+ активируют аденозинтрифосфатазу клеточных
- 28. Ионы Nа+ и К+ оказывают существенное влияние
- 29. В медицине применяются:1. Хлорид натрия NаС1. В
- 30. Изотонический раствор применяют в качестве плазмо-замещающего раствора
- 31. 2. Гидрокарбонат натрия NаНС03 (питьевая сода). Введение
- 32. 3. Декагидрат сульфата натрия Nа2S04 • 10Н2О (глауберова соль). Назначают внутрь в качестве слабительного средства.32
- 33. 4. Декагидрат тетрабората натрия Nа2В4О7 • 10Н2О
- 34. 5. Йодид натрия NаI. Используют как препарат
- 35. 7. Йодид калия К1. Применяют как препарат
- 36. 9. Водный раствор аммиака, гидроксид аммония (нашатырный
- 37. В медицине применяются:11. Нитрат серебра АgNO3 (ляпис)
- 38. Ч.2.Аналитическая химия. Количественный анализ (титриметрия)
- 39. План1. Количественный анализ. Задачи и методы количественного
- 40. Предмет аналитической химии Аналитическая химия – наука
- 41. 1. Количественный анализ. Задачи и методы количественного
- 42. 2. Общая характеристика титриметрических методов анализа. Понятие
- 43. Титрованные растворы – растворы с известной концентрацией
- 44. Методы титриметрического анализа:В основе классификации лежат реакции,
- 45. 3. Метод осаждения - в основе метода
- 46. Условия титриметрического анализа1. Точное измерение объемов реагирующих
- 47. Требования к реакциям титрования1. Реакция должна проходить
- 48. Способы титрованияА) прямое - при титровании используется
- 49. В) титрование заместителя – используются два рабочих
- 50. 3. ИндикаторыВещества, окраска которых меняется в зависимости
- 51. 14
- 52. 4. Стандартные и стандартизированные растворы
- 53. 5. Кислотно-основное титрованиеОсновные положения методаОбъемы растворов реагирующих
- 54. 6. Вычисления в титриметрическом анализеФормулы для расчета:рН
- 55. Вычисления в титриметрическом анализе (продолжение)Расчет кривой титрования
- 56. продолжение:4-я точка. Добавим еще 0,9 мл 0,1
- 57. продолжение:6-я точка. Добавим еще 0,01 мл 0,1
- 58. Продолжение:8-я точка. Добавим еще 0,9 мл 0,1
- 59. 22
- 60. 6. Вычисления в титриметрическом анализе (продолжение)Расчет кривой
- 61. 24
- 62. Титрование25
- 63. Посуда26
- 64. Вопросы к экзаменупо аналитической химии Предмет аналитической
- 65. Вопросы к экзаменупо аналитической химии Растворимость соединений. Произведение растворимости. Насыщенный и ненасыщенные растворы. Условия выпадения осадка.
- 66. Гетерогенные ионные равновесия
- 67. Растворимость (L), моль/лМхАу(т) х
- 68. ЗадачаРассчитать растворимость сульфата серебра, если ПР(Ag2SO4) =
- 69. Слайд 69
- 70. Вопросы к экзаменупо аналитической химии Предмет аналитической
- 71. Вопросы к экзаменупо аналитической химии Растворимость соединений. Произведение растворимости. Насыщенный и ненасыщенные растворы. Условия выпадения осадка.
- 72. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Григорьевна
Аналитическая химия. ч.1.Качественный
анализ
Слайд 2Качественный анализ
План лекции
1. Предмет аналитической химии. Методы аналитической химии.
2.
Качественный химический анализ и его задачи; техника выполнения качественного
анализа; требования к аналитическим реакциям; типы используемых химических реакций.3. Дробный и систематический качественный анализ.
4. Классификация и анализ катионов.
5. Классификация и анализ анионов.
2
Слайд 3 1.Предмет аналитической химии
Аналитическая химия – наука о методах
определения качественного и количественного состава веществ или смеси веществ.
Задачи аналитической
химии: развитие теоретических основ, усовершенствование существующих, разработка новых, более совершенных методов определения элементарного состава веществ.Методы : химические, физические и физико-химические.
3
Слайд 4 2. Качественный анализ
Раздел аналитической химии, связанный с открытием
химических элементов или ионов, входящих в состав исследуемого вещества, называется
качественным анализом.Химические методы, используемые в качественном анализе, называются аналитическими реакциями.
Задачи качественного анализа: Обнаружение или идентификация отдельных элементов или ионов, входящих в состав исследуемого вещества.
4
Слайд 6Техника выполнения качественного микроанализа
“Сухой” и “мокрый” способ.
1) Образование окрашенных
перлов (стекол):
Соли и оксиды металлов при нагревании растворяют в расплавленном
тетраборате натрия Na2B4O7·10H2O. Образуются перлы (стекла) характерной окраски.Сr – изумрудно-зеленые перлы;
Со – интенсивно синие;
Mg – фиолето-аметистовые;
Fe – желто – бурые;
Ni – красно – бурые;
2) Окрашивание пламени. Соли многих металлов при внесении их в бесцветную часть пламени окрашивают пламя в характерный цвет.
6
Слайд 8Техника выполнения качественного анализа (продолжение)
3) Метод растирания.Твердое исследуемое вещество растирают
в фарфоровой ступке с равным количеством твердого реагента.
По окраске
полученного соединения судят о наличии искомого иона. CH3COONa+NaHSO4→Na2SO4+CH3COOH
запах уксусной кислоты
4) Микрокристаллоскопический способ. Реакцию проводят на предметном стекле.
CaCO3 +H2SO4→CaSO4↓+H2O+CO2
Под микроскопом видны игольчатые кристаллы CaSO4.
5) Капельный метод. Реакции выполняют с каплями растворов и реагентов, обладающих высокой чувствительностью, на фарфоровой пластинке, предметном или часовом стекле, на фильтровальной бумаге.
6) Обычно проводят “мокрый” способ – реакции в растворе.
8
Слайд 9Реакция должна сопровождаться аналитическим признаком (аналитическим сигналом). Аналитический признак должен
определяться визуально или инструментально.
К аналитическим признакам относятся
1) Образование или растворение
осадка с определенными свойствами (цвет, растворимость в определенных растворителях, форма кристаллов).2) Получение окрашенного растворимого соединения.
3) Выделение газа с известными свойствами.
:
9
Требования к химическим реакциям, применяемым в аналитической химии
Слайд 10Те реакции, для которых необходимы очень малые концентрации определяемого иона
и реагента – высокочувствительные.
Реакции, для протекания которых требуется большая концентрация
определяемого иона и реагента – низкочувствительные.Количественные характеристики чувствительности реакций:
Открываемый минимум (m) – наименьшее количество вещества (иона), которое при определенных условиях можно открыть действием данного реагента. (m не более 50 мкг в одной капле раствора – 0.05 мл)
Предельная концентрация – минимальная концентрация вещества в растворе (г/мл), при которой вещество может быть обнаружено.
:
10
Характеристики аналитических реакций. Открываемый минимум и предельная концентрация
Слайд 11Типы химических реакций, используемых в качественном анализе
1. Групповые- реакции, аналитический
эффект которых характерен для определенной группы ионов. Применяемый реактив –
групповой. Требования к групповому реактиву:- должен осаждать все ионы данной группы;
- осадок должен растворяться в кислотах для продолжения анализа;
избыток реагента не должен мешать дальнейшему анализу.
Пример: (NH4)2CO3 осаждает катионы второй группы Са2+, Ва2+, Sr2+
2. Селективные (избирательные) – реакции, которые позволяют в смеси ионов обнаружить ограниченное количество ионов.
Применяемый реагент – селективный.
Пример: Nа3 [Со(NO2)6] - образует осадки с катионами К+ и NH4+
3. Специфические - реакции, аналитический эффект которых характерен только для одного иона. Применяемый реагент – специфический, используется в дробном ходе анализа.
NH4Cl + KOH→NH3↑+KCl+H2O запах аммиака, лакмусовая
бумажка синеет.
11
Слайд 12Специфические реакции
12
Примеры: K+ + Na+ + NH4+
NH4+ + KOH→ K+
+ NH4ОH
NaHC4H4O6 + K+→NaKC4H4O6↓ + H+
гидротартрат натрия-калия, белый кристаллический осадокKH2SbO4 + Na+→NаH2SbO4↓ +K+
дигидро- белый
антимонат кристаллический
калия осадок
Слайд 133. Дробный и систематический
анализы
Дробным анализом называют обнаружение ионов
с помощью селективных и специфических реакций в отдельных порциях анализируемого
раствора, производимое в любой последовательности.Для обнаружения соответствующих ионов дробным методом необходимо применять селективные и специфические реактивы, позволяющие обнаружить искомый ион в присутствии посторонних ионов. При дробном ходе анализа для каждого определения берут отдельную пробу.
Систематическим ходом анализа - называется определенная последовательность выполнения аналитических реакций, при которой каждый ион обнаруживают после того, как будут обнаружены и удалены другие ионы, мешающие его обнаружению, то есть
систематический анализ основан на последовательном открытии и удалении ионов, которых мешают дальнейшему определению.
Для удаления ионов используют групповые или специфические реактивы.
13
Слайд 14Систематический анализ
Пример: обнаружение катионов Ca2+ :
CaCl2 + (NH4)2C2O4 →
CaC2O4↓ + 2NH4Cl
Эта реакция неспецифична, поскольку оксалат аммония образует белый
кристаллический осадок не только с катионом Ca2+, но также с Вa2+ . Поэтому прежде чем открывать ион Ca2+ , необходимо поверить присутствие мешающего иона Вa2+ , используя специфическую реакцию с дихроматом калия K2Cr2O7 – образование желтого осадка:2BaCl2 + K2Cr2O7 + H2O → 2BaCrO4↓ + 2KCl + 2HCl
Наличие Ca2+ не мешает определению Вa2+ , т.к. СаCrO4
хорошо растворим и не выпадает в осадок.
14
Слайд 15В основу классификации катионов в аналитической химии положено различие в
растворимости образуемых ими солей и гидроксидов, позволяющее отделять (или отличать)
одни группы ионов от других.Существуют разные системы группового разделения катионов: сероводородная, кислотно-основная, аммиачно-фосфатная, тиоацетамидная и др. Наибольшее распространение получили сульфидная и кислотно-основная классификации.
Сульфидная классификация основана на различной растворимости в воде сульфидов, хлоридов, карбонатов и гидроксидов.
:
15
4. Классификация и анализ катионов
Слайд 18Обнаружение катионов первой аналитической группы
1. Открытие катиона калия
Гексанитрокобальтат
(III) натрия дает с катионами К+ желтый осадок двойной комплексной
соли гексанитро- кобальтата (III) калия – натрия2KCl + Na3[Co(NO2)6]→2NaCl + K2Na[Co(NO2 )6]↓
Осадок растворим в сильных кислотах. Присутствие щелочей мешает реакции, так как щелочи, разлагая реактив, образуют темно бурый осадок гидроксида кобальта Со(ОН)3.
В присутствии солей аммония также выпадает желтый кристаллический осадок (реакция неспецифична).
2. Катионы второй аналитической группы
Открытие катиона бария
Открытие катиона кальция
(Все реакции – на доске)
18
Слайд 19Обнаружение катионов первой аналитической группы (продолжение)
2. Открытие катиона
аммония :соли аммония реагируют со щелочью с выделением газообразного аммиака:
NH4Cl+ NaOH = NH3+ H2O+NaClНаблюдается выделение газа, который обнаруживается по запаху. Выделение аммиака можно обнаружить влажной лакмусовой бумажкой, которую держат над пробиркой. Она окрашивается в синий цвет. Опыт проводят при рН>9,в нагретом растворе (реакция специфична).
3. Открытие катиона магния (в присутcтвии NH4Сl – белый осадок):
MgCl2+ Na2HPO4 + NH4OH = MgNH4PO4↓ + 2NaCl + H2O
Катионы других аналитических групп мешают, т.к. тоже образуют нерастворимые фосфаты (реакция неспецифична).
19
Слайд 20Обнаружение катионов второй аналитической группы
(см. слайд №14)
1. Обнаружение катионов Ca2+
:
CaCl2 + (NH4)2C2O4 → CaC2O4↓ + 2NH4Cl
Эта реакция неспецифична, поскольку
оксалат аммония образует белый мелкокристаллический осадок не только с катионом Ca2+, но также с Вa2+ . Поэтому прежде чем открывать ион Ca2+ , необходимо поверить присутствие мешающего иона Вa2+ , используя специфическую реакцию с дихроматом калия K2Cr2O7 – образование желтого осадка.2. Обнаружение катионов Вa2+ (образуется желтый кристаллический осадок) :
2BaCl2 + K2Cr2O7 + H2O → 2BaCrO4↓ + 2KCl + 2HCl
Наличие Ca2+ не мешает определению Вa2+ , т.к. СаCrO4
хорошо растворим и не выпадает в осадок.
20
Слайд 215. Аналитическая классификация анионов
Анионы - отрицательно заряженные ионы, состоящие из
отдельных атомов или групп атомов различных элементов, могут нести один
или несколько отрицательных зарядов.Общепринятой классификации анионов не существует. Наиболее часто применяется классификация, по которой все анионы делятся на три аналитические группы в зависимости от растворимости их бариевых и серебряных солей.
21
Слайд 23Обнаружение анионов
1. Анионы первой аналитической группы
Открытие сульфат-аниона (с ВаСl2 -
белый осадок ВаSO4)
Открытие карбонат-аниона (с HCl – образование СO2)
Открытие фосфат-аниона
(c молибденовой жидкостью – желтый кристаллический осадок):Na2HPO4 + 12 (NH4)2MoO4 + 23HNO3 =
(NH4)3H4[P(Mo2O7) 6] ↓ + 2NaNO3 + 21NH4NO3 + 10H2O
2. Анионы второй аналитической группы
Открытие хлорид-аниона (с AgNO3 - белый осадок AgCl)
Открытие бромид-аниона ( с AgNO3 - желтый осадок AgВr)
2. Анионы третьей аналитической группы
Открытие нитрат-аниона (реакция с дифениламином – темно-синее окрашивание) (все реакции – на доске)
23
Слайд 24Применение катионов 1 и 2 аналитических групп в медицине
Натрий и
калий. Ионы Nа+ и К+ распределены по всему организму, причем,
первые входят преимущественно в состав межклеточных жидкостей, а вторые находятся главным образом внутри клеток.24
Слайд 25Внутриклеточная концентрация ионов натрия составляет менее 10 % его содержания
во внеклеточной жидкости, тогда как концентрация ионов калия внутри клетки
почти в 30 раз выше, чем вне.Если оценивать абсолютные величины, то примерно 95 % ионов натрия, участвующих в обмене веществ, находятся вне клеток и примерно такая же доля ионов калия - внутри клеток.
25
Слайд 26 С ионами Nа+ связано осмотическое давление жидкостей, удержание воды
тканями (15 г NаС1 задерживает в организме человека до двух
литров жидкости), поддержание кислотно-щелочного равновесия в организме (NаНС03 - щелочной резерв крови - компонент гидрокарбонатной буферной системы), перенос аминокислот и cахаров через клеточную мембрану.26
Слайд 27Ионы Nа+ и К+ активируют аденозинтрифосфатазу клеточных мембран, которая «выключает»
ионы Nа+ из клетки и обеспечивает сопряженное накопление ионов К+
в ней.Различные концентрации двух данных ионов по разные стороны от мембраны обусловливают возникновение трансмембранной разности потенциалов (до 100 мВ), что обеспечивает существование легкодоступного источника энергии для многих связанных с функционированием мембран процессов.
27
Слайд 28Ионы Nа+ и К+ оказывают существенное влияние на деятельность центральной
нервной системы (ЦНС).
Так, избыток ионов Nа+ в клетках коры
головного мозга вызывает депрессию, т.е. угнетение деятельности ЦНС. Наоборот, избыток ионов К+ в клетках коры головного мозга вызывает маниакальное состояние, т.е. возбуждение деятельности ЦНС.
28
Слайд 29В медицине применяются:
1. Хлорид натрия NаС1. В зависимости от его
концентрации различают изотонический (физиологический) и гипертонический растворы.
Изотоническим является 0,9
%-ый раствор NаС1, так как его осмотическое давление соответствует осмотическому давлению плазмы крови (780,2 кПа).29
Слайд 30Изотонический раствор применяют в качестве плазмо-замещающего раствора при обезвоживании организма,
для растворения лекарственных веществ и т.д.
Гипертонические растворы (с массовой
долей NаС1 3, 5 и 10 %) применяют наружно в виде компрессов и примочек для лечения гнойных ран.30
Слайд 312. Гидрокарбонат натрия NаНС03 (питьевая сода).
Введение гидрокарбоната натрия в
желудок приводит к быстрой нейтрализации соляной кислоты желудочного сока и
поэтому рассматривается как антацидное средство. Применяют в порошках, таблетках и растворах при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки:NаНСO3 + НС1 = NаС1 + Н2O + СO2.
31
Слайд 323. Декагидрат сульфата натрия
Nа2S04 • 10Н2О (глауберова соль). Назначают
внутрь в качестве слабительного средства.
32
Слайд 334. Декагидрат тетрабората натрия Nа2В4О7 • 10Н2О (бура).
Применяют наружно
как антисептическое средство для спринцеваний, полосканий, смазываний, В водных растворах
бура легко подвергается гидролизу:Nа2В4О7 + 7Н2О = 4Н3ВО3 + 2NаОН.
Образующаяся при гидролизе борная кислота обладает антисептическим действием.
33
Слайд 345. Йодид натрия NаI.
Используют как препарат йода при эндемическом
зобе.
6. Хлорид калия КС1.
Применяют при состояниях, сопровождающихся нарушением электролитного
обмена в организме (неукротимая рвота, профузные поносы), а также для купирования сердечных аритмий.34
Слайд 357. Йодид калия К1.
Применяют как препарат йода при заболеваниях
щитовидной железы.
8. Перманганат калия КМn04
Используют как антисептическое средство для промывания
ран, полоскания рта и горла, для спринцеваний и промываний.35
Слайд 369. Водный раствор аммиака, гидроксид аммония (нашатырный спирт) NH4ОН. Используют
для возбуждения дыхания и выведения больных из обморочного состояния, для
чего небольшой кусок ваты или марли, смоченной в нашатырном спирте, осторожно подносят к носовым отверстиям.10. Хлорид аммония (нашатырь) NH4С1. Оказывает отхаркивающее действие, усиливает мочеотделение.
36
Слайд 37В медицине применяются:
11. Нитрат серебра АgNO3 (ляпис) - вяжущее и
прижигающее средство, используется наружно. Применяется в стоматологии для серебрения корневых
каналов и кариозных полостей зубов перед их пломбированием. Сначала из нитрата серебра получают аммиачный раствор оксида серебра, затем добавляют водный раствор формальдегида с его массовой долей 10 %. Образующаяся серебряная пленка посылает в окружающее пространство ионы серебра, которые обладают бактерицидным действием.12. Нитрат и хлорид серебра применяются для пропитки перевязочного материала - бумаги, ваты, марли.
37
Слайд 39План
1. Количественный анализ. Задачи и методы количественного анализа.
2. Общая
характеристика титриметрических методов анализа. Понятие о титровании.
3. Индикаторы.
4. Стандартные
и стандартизованные растворы.5. Кислотно-основное титрование.
6. Вычисления в титриметрическом анализе
7. Применение объемного метода анализа.
2
Слайд 40Предмет аналитической химии
Аналитическая химия – наука о методах определения
качественного и количественного состава веществ или смеси веществ.
Задачи аналитической химии:
развитие теоретических основ, усовершенствование существующих, разработка новых, более совершенных методов определения элементарного состава веществ.Методы : химические, физические и физико-химические.
Разделы : качественный анализ,
количественный анализ ,
методы исследования
3
Слайд 411. Количественный анализ. Задачи и методы количественного анализа
Раздел аналитической химии,
изучающий методы определения количественного содержания исследуемого вещества.
Три основные группы методов
количественного анализа:1. химические – весовой (гравиметрический), объемный (титриметрический), газовый (волюмометрический);
2. физико-химические;
3. физические (инструментальные).
4
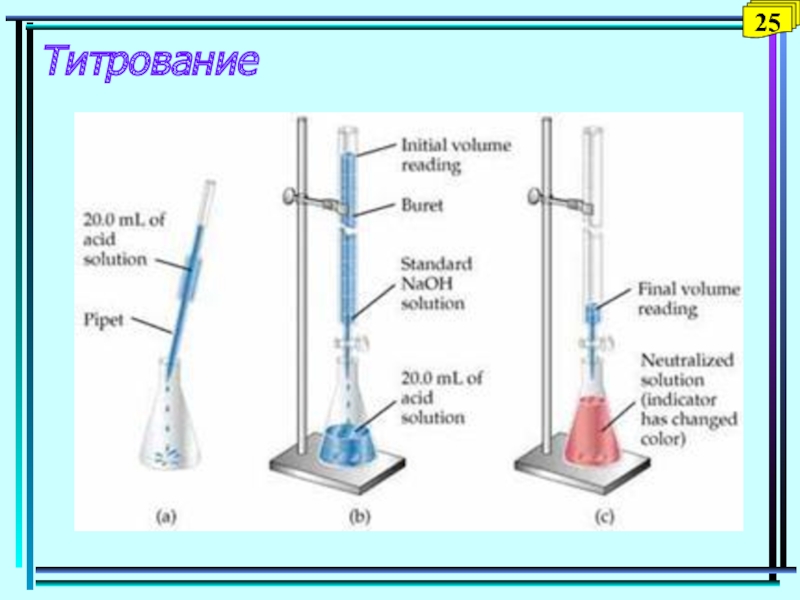
Слайд 422. Общая характеристика титриметрических методов анализа. Понятие о титровании.
Титриметрический
метод - метод количественного анализа, основанный на точном измерении объемов
растворов реагирующих веществ (реагентов), вступающих в химическую реакцию.Титрование - процесс постепенного прибавления раствора титранта (раствора точной концентрации) к раствору анализируемого вещества неизвестной концентрации (проба, аликвота) до получения сигнала индикатора, свидетельствующего о достижении конечной точки титрования (окончании реакции).
5
Слайд 43
Титрованные растворы – растворы с известной концентрацией - титром. Эти
растворы называют рабочими растворами – титрантами. С их помощью проводится
титриметрическое определение, то есть, это раствор, которым титруют.Титр раствора – масса вещества, содержащаяся в 1 мл раствора: Т = m/V (г/мл)
Титриметрический анализ характеризуется быстротой определения и использует химические реакции различных типов.
6
Слайд 44Методы титриметрического анализа:
В основе классификации лежат реакции, применяемые при титровании.
1.
Метод нейтрализации –
в основе метода лежит реакция нейтрализации
H++OH- =H2O
Этим
методом можно определить количество кислот, солей и оснований.
2. Метод окисления - восстановления –
в основе метода лежит реакции окисления и
восстановления. Растворами окислителей определяют количество восстановителей и
наоборот (н-р, перманганатометрия):
Na2SO3 + КMnO4 + H2SO4 MnSO4 + Na2SO4 + K2SO4 + H2O
7
Слайд 453. Метод осаждения - в основе метода лежит реакция осаждения
ионов в виде труднорастворимых соединений.
Ag+ + Cl- = AgCl↓
4.
Метод комплексонометрии- в основе метода лежит реакция связывания ионов в малодиссоциируемое комплексное соединение.
Mg+2 + ЭДТА = комплексное соединение
8
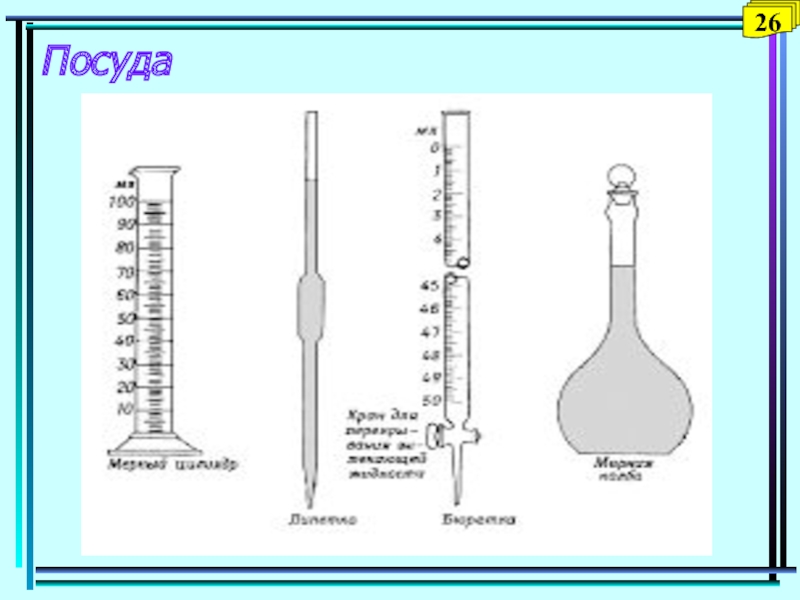
Слайд 46Условия титриметрического анализа
1. Точное измерение объемов реагирующих веществ.
2. Приготовление растворов
точно известной концентрацией, с помощью которых проводят титрование (рабочие растворы).
3.
Определение конца реакции.При титровании прибавляют точное количество реактива, отвечающее уравнению реакции, т. е. количество прибавленного реактива должно быть эквивалентно количеству определяемого вещества.
9
Слайд 47Требования к реакциям титрования
1. Реакция должна проходить количественно, по определённому
уравнению, без побочных реакций.
2. Реакция должна проходить с большой скоростью,
быть практически необратимой.3.Окончание реакции должно быть строго зафиксировано визуально или инструментальными методами.
4. Возможность точного определения концентрации раствора.
10
Слайд 48Способы титрования
А) прямое - при титровании используется один рабочий раствор,
реакция идет между рабочим раствором и титруемым веществом.
Б) обратное –
используются два рабочих раствора, к исследуемому раствору добавляют избыток раствора известной концентрации (первый рабочий раствор). Количество первого раствора, не вступившего в реакцию с определяемым веществом (избыток), титруют (определяют) вторым рабочим раствором.11
Слайд 49В) титрование заместителя – используются два рабочих раствора. Первый рабочий
раствор вступает в реакцию с определяемым веществом с образованием продукта.
Количество образовавшегося продукта определяют вторым рабочим раствором. 12
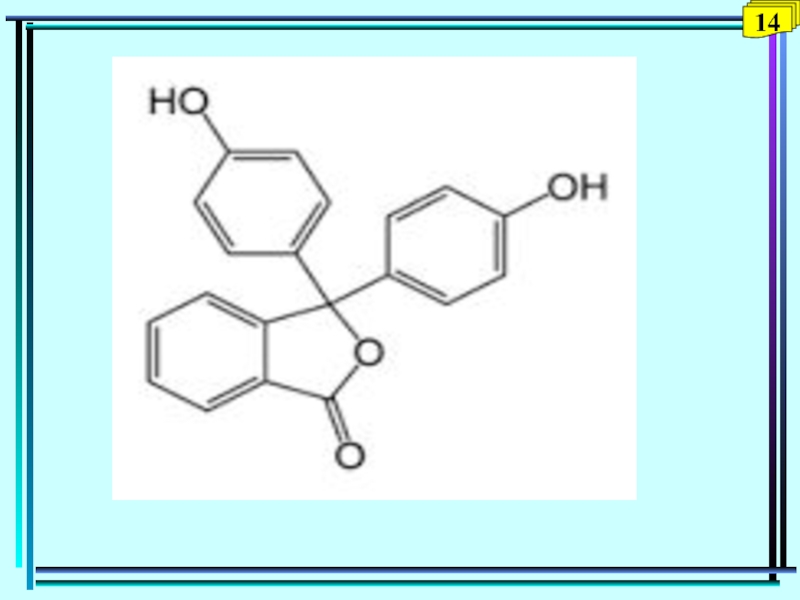
Слайд 503. Индикаторы
Вещества, окраска которых меняется в зависимости от рН среды.
Индикаторы
– это слабые органические кислоты или основания, у которых недиссоциированные
молекулы и ионы имеют различную окраску.Фенолфталеин:
HInd H+ + Ind- К = [H+] [Ind-] / HInd
бесцветный малиновый
- lg K = рH = pK = рТ (показатель титрования);
Область перехода индикаторов (рН ± 1):
Метиловый оранжевый 3.1 – 4.4
Лакмус 5.0 – 8.0
Фенолфталеин 8.0 – 10.0
13
Слайд 524. Стандартные и стандартизированные растворы
Каким бы методом
не проводилось титрование, в нем используются:
- титрованный раствор (титрант),
-
соответствующий индикатор,- способ точного измерения объема.
В зависимости от способа получения различают
стандартные (приготовленные) и
стандартизированные (установленные) растворы.
Требования к стандартным растворам:
вещество должно быть химически чистым, состав его должен строго
соответствовать формуле;
простота и воспроизводимость приготовления раствора,
устойчивость раствора и стабильность его концентрации при хранении
Т = m/V (г/мл); N = 1000 Т/Э (моль-экв./л)
15
Слайд 535. Кислотно-основное титрование
Основные положения метода
Объемы растворов реагирующих веществ обратно пропорциональны
их нормальным концентрациям:
V1 : V2 = N2 :N1 или V1N1
= V2N2Для определения концентрации одного из растворов надо знать объемы растворов реагирующих веществ и концентрацию титранта: N2=V1N1/ V2 .
16
Слайд 546. Вычисления в титриметрическом анализе
Формулы для расчета:
рН раствора слабой кислоты
рН
раствора слабого основания
рН буферной смеси на основе слабой кислоты
рН
буферной смеси на основе слабого основанияПостроение кривых титрования:
сильной кислоты сильным основанием
слабой кислоты сильным основанием
(формулы – на доске)
17
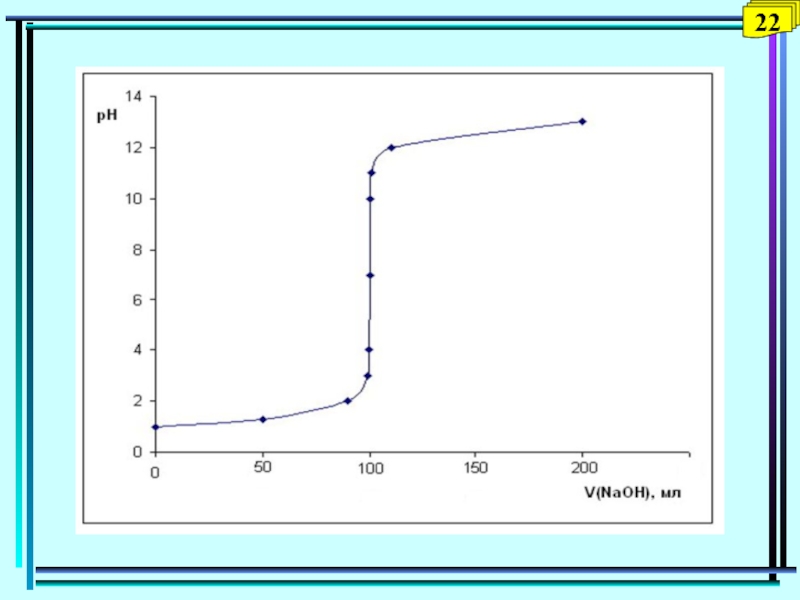
Слайд 55Вычисления в титриметрическом анализе (продолжение)
Расчет кривой титрования сильной кислоты сильным
основанием
1-я точка. Возьмем 100 мл 0,1 М раствора HCl:
pH =
- lg [H+] = -lg [HCl] = -lg 10-1 = 1.2-я точка. Добавим 90 мл 0,1 М раствора NaOH . Концентрацию не вступившей в реакцию HCl можно посчитать по формуле:
С2 (HCl) = Снач. (HCl) Vост.(HCl) / Vнач. (HCl) + Vдоб. (NaOH) , где
Vост. (HCl) – объем избытка HCl.
С2 (HCl) = С2 (H+) = 0,1 (моль/л) . 10 (мл) /190 (мл)=5,3. 10-3 моль/л
рН = -lg 5,3. 10-3 = 2.3.
3-я точка. Добавим еще 9 мл 0,1 М раствора NaOH (всего 99 мл) , останется 1 мл непрореагировавшей HCl. Концентрацию не вступившей в реакцию HCl можно посчитать по формуле:
С3 (HCl) = С3 (H+) = 0,1 (моль/л) . 1(мл) / 199 (мл) = 5,0. 10-4 моль/ л
рН = 3.3.
18
Слайд 56
продолжение:
4-я точка. Добавим еще 0,9 мл 0,1 М раствора NaOH
(всего 99,9 мл) , общий объем раствора составит 199,9 мл,
останется 0,1 мл непрореагировавшей HCl. Концентрацию не вступившей в реакцию HCl можно посчитать по формуле:С4 (HCl) = С4 (H+) = 0,1 (моль/л) . 0,1(мл) / 199,9 (мл) = 5,0. 10-5 моль/ л
рН = 4.3.
5-я точка. Добавим 100,0 0,1 М раствора NaOH(всего), суммарный объем раствора составит 200,0 мл.
В точке эквивалентности рН =7
19
Слайд 57
продолжение:
6-я точка. Добавим еще 0,01 мл 0,1 М раствора NaOH
(всего 100,01 мл), суммарный объем раствора составит 200,01 мл. Избыток
NaOH 0,01 мл (среда щелочная) . Концентрация гидроксид-ионов можно посчитать по формуле:С (ОH-) = 0,1 (моль/л) . 0,01 (мл) /200,01 (мл)
= 5,0. 10-6 моль/л
С (H+) = 10-14 /5,0. 10-6 =2. 10-9 рН = 8,7.
7-я точка. Добавим еще 0,09 мл (всего 100,1 мл) 0,1 М раствора NaOH; избыток NaOH составляет 0,1 мл; суммарный объем раствора 200,1 мл.
С (ОH-) = 0,1 (моль/л) . 0,1 (мл) /200,1 (мл)
= 5,0. 10-5 моль/л
С (H+) = 10-14 /5,0. 10-5 =2. 10-10 рН = 9,7.
20
Слайд 58
Продолжение:
8-я точка. Добавим еще 0,9 мл 0,1 М раствора NaOH
(всего 101 мл ); избыток NaOH составляет 1 мл; суммарный
объем раствора 201 мл.С (ОH-) = 0,1 (моль/л) . 1 (мл) /201 (мл)
= 5,0. 10-4 моль/л
С (H+) = 10-14 /5,0. 10-4 =2. 10-11 рН = 10,7.
21
Слайд 606. Вычисления в титриметрическом анализе (продолжение)
Расчет кривой титрования сильной кислоты
сильным основанием (пред. случай) и сильного основания сильной кислотой (в
самостоятельных заданиях).Кроме того, можно рассчитать
рН буферной смеси на основе слабой кислоты:
рН = рКa + lg (Ccоли / Cкисл.)
рН буферной смеси на основе слабого основания
рН = 14 – рКb + lg (Cосн. / Cсоли.)
23
Слайд 64Вопросы к экзамену
по аналитической химии
Предмет аналитической химии. Методы аналитической
химии.
Качественный химический анализ и его задачи; техника выполнения качественного анализа;
требования к аналитическим реакциям; типы используемых химических реакций.Дробный и систематический качественный анализ.
Классификация и качественный анализ катионов.
Классификация и качественный анализ анионов.
Количественный анализ. Задачи и методы количественного анализа.
Общая характеристика титриметрических методов анализа. Понятие о титровании. Индикаторы. Стандартные и стандартизованные растворы.
Кислотно-основное титрование.
Вычисления в титриметрическом анализе.
Применение объемного метода анализа.
Слайд 65Вопросы к экзамену
по аналитической химии
Растворимость соединений. Произведение растворимости.
Насыщенный и ненасыщенные растворы. Условия выпадения осадка.
Слайд 66Гетерогенные ионные равновесия
МА(т)
М M+ + А–Для малорастворимых сильных электролитов:
Kс = [M+][A–] = ПР(МА)
(произведение растворимости)
В общем виде:
МхАу(т) х Ма+ + у Аb–
Тогда ПР = [Ma+]x [Ab–]y
ПР = const при T = const
ПР = f(T)
Доп.
Слайд 67Растворимость (L), моль/л
МхАу(т) х Ма+ + у
Аb–
[Ma+] = x L; [Ab–] = y L
ПР(МхАу) = (x
L)x (y L)y = xx yy Lx+yСлайд 68Задача
Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 . 10–5
Ag2SO4(т)
2Ag+ + SO42–
L(моль/л)
2L L ПР = [Ag+ ]2 [SO42–] = (2L)2L = 4L3Слайд 69
Т
Условия осаждения и растворения осадков
с
с(М+) с(А–) = [M+] [А–] = ПР
с(М+) с(А–) < ПР
МА(т) М+ + А–
с(М+) с(А–) > ПР
М+ + А– МА(т)
МА(т) М+ + А–
Для малорастворимого сильного электролита МхAy
условие растворения осадка: [Ma+]x [Ab–]y < ПР
условие выпадения осадка: [Ma+]x [Ab–]y > ПР
Слайд 70Вопросы к экзамену
по аналитической химии
Предмет аналитической химии. Методы аналитической
химии.
Качественный химический анализ и его задачи; техника выполнения качественного анализа;
требования к аналитическим реакциям; типы используемых химических реакций.Дробный и систематический качественный анализ.
Классификация и качественный анализ катионов.
Классификация и качественный анализ анионов.
Количественный анализ. Задачи и методы количественного анализа.
Общая характеристика титриметрических методов анализа. Понятие о титровании. Индикаторы. Стандартные и стандартизованные растворы.
Кислотно-основное титрование.
Вычисления в титриметрическом анализе.
Применение объемного метода анализа.





























































![Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Растворимость (L), моль/лМхАу(т) х Ма+ + у Аb–[Ma+] = x Растворимость (L), моль/лМхАу(т) х Ма+ + у Аb–[Ma+] = x L; [Ab–] = y](/img/thumbs/ade6da43478449977c5cd9462dd4e66f-800x.jpg)