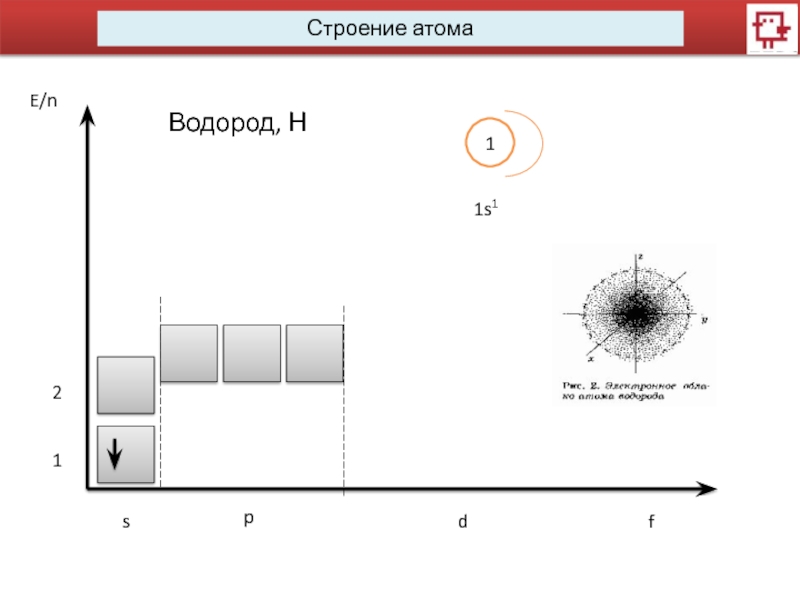
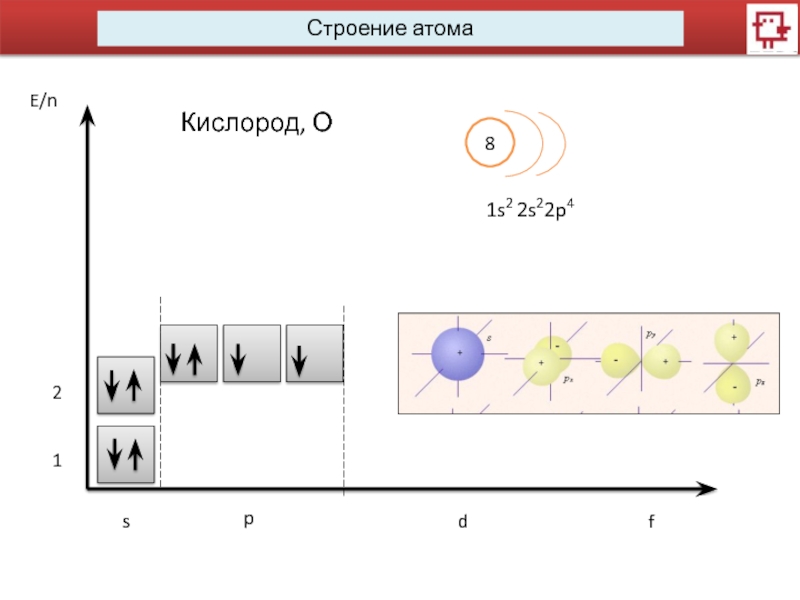
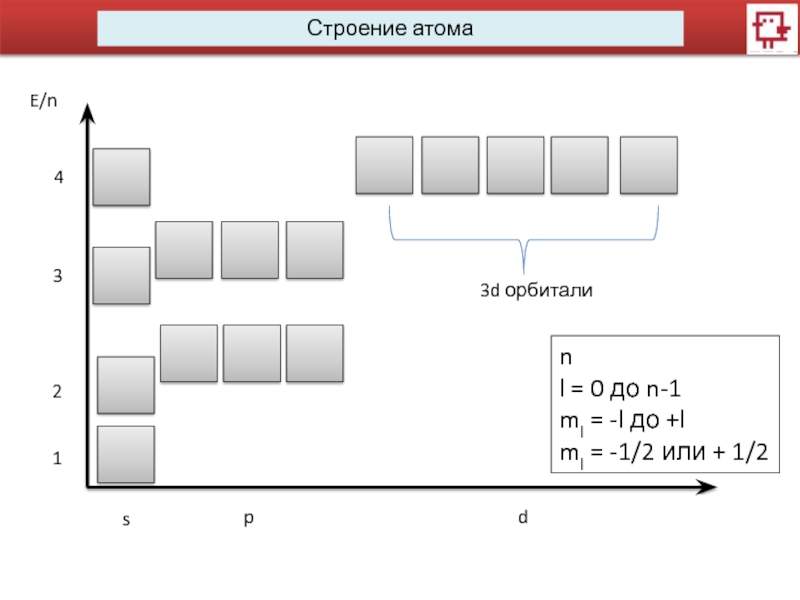
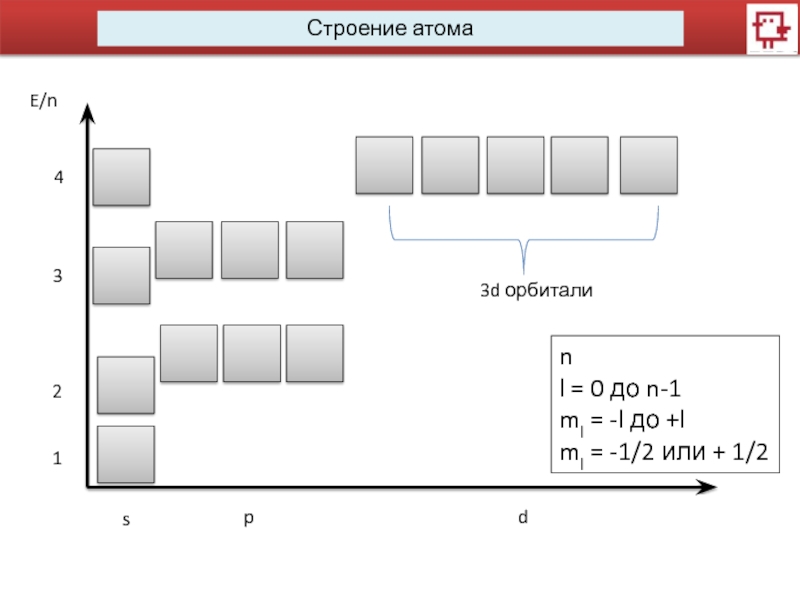
данной орбитали. Может принимать любые целые значения n=1, 2, 3,
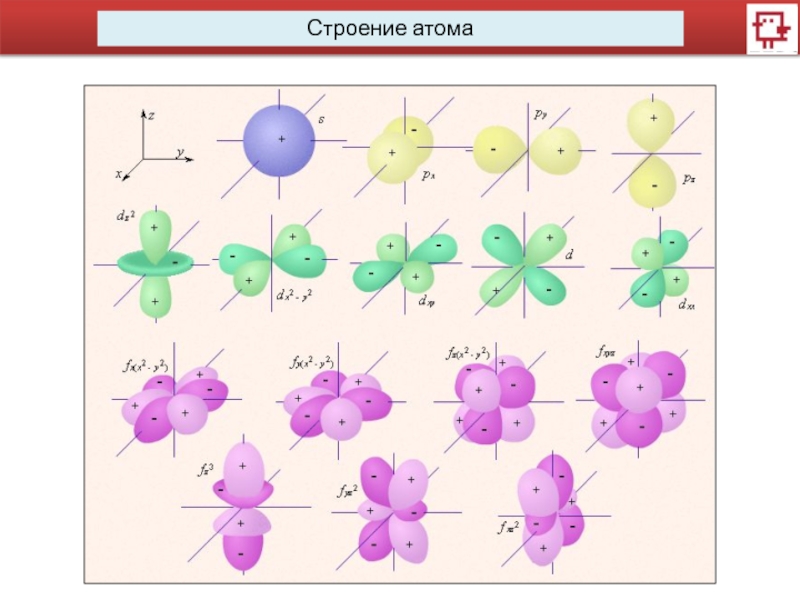
4…Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака. Форма электронного облака зависит от значения побочного квантового числа. l имеет несколько значений от 0 до n-1.
Значение 0 1 2 3 4 5
Букв. Об. s p d f g h
Орбиталь – совокупность положений электрона в атоме, область пространства, в которой наиболее вероятно нахождение электрона.