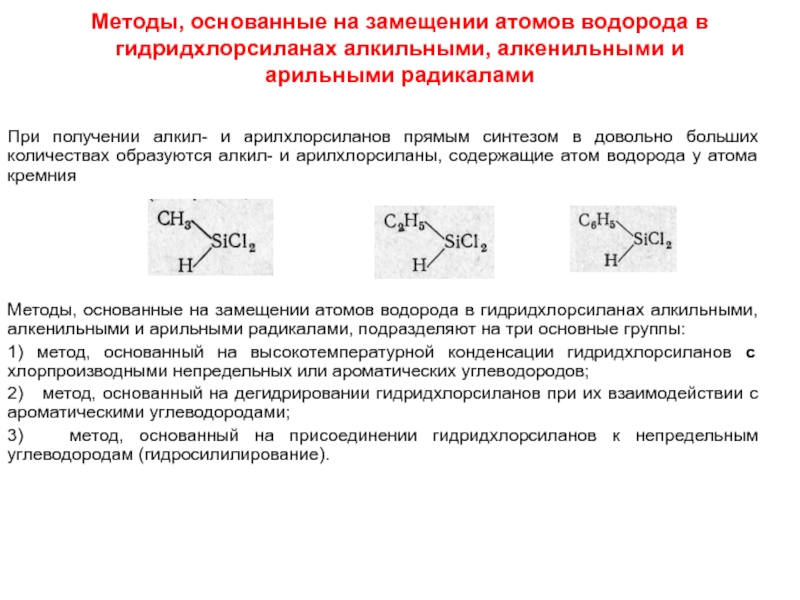
Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок 9 класса Углерод Металлы
Содержание
- 1. Урок 9 класса Углерод Металлы
- 2. ОГЭ:По четвергм в 410 в 17:00 до 18:30
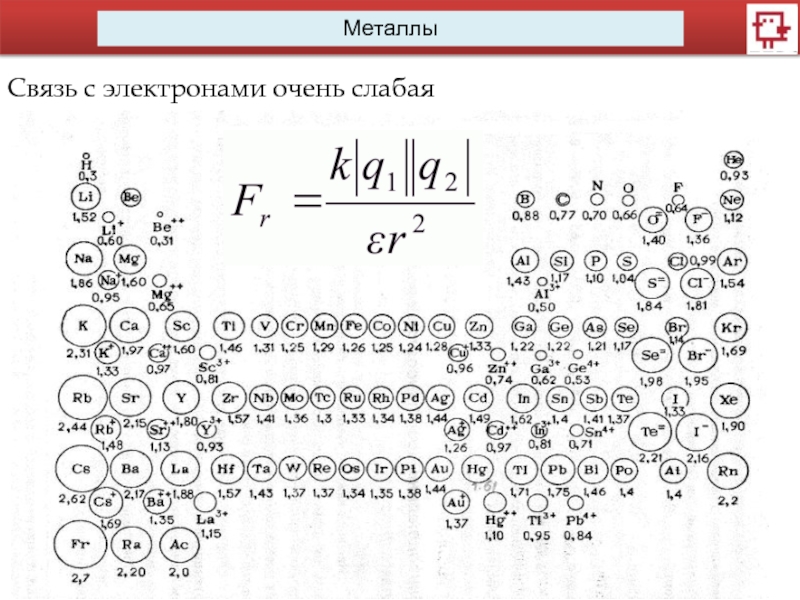
- 3. МеталлыСвязь с электронами очень слабая
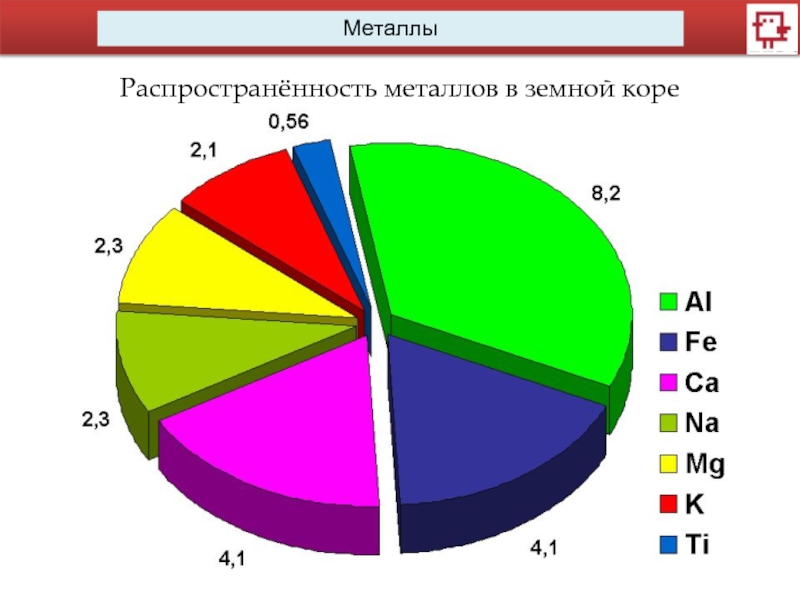
- 4. МеталлыРаспространённость металлов в земной коре
- 5. МеталлыСырьё для добычи металлов:Al – боксит Al2O3Al
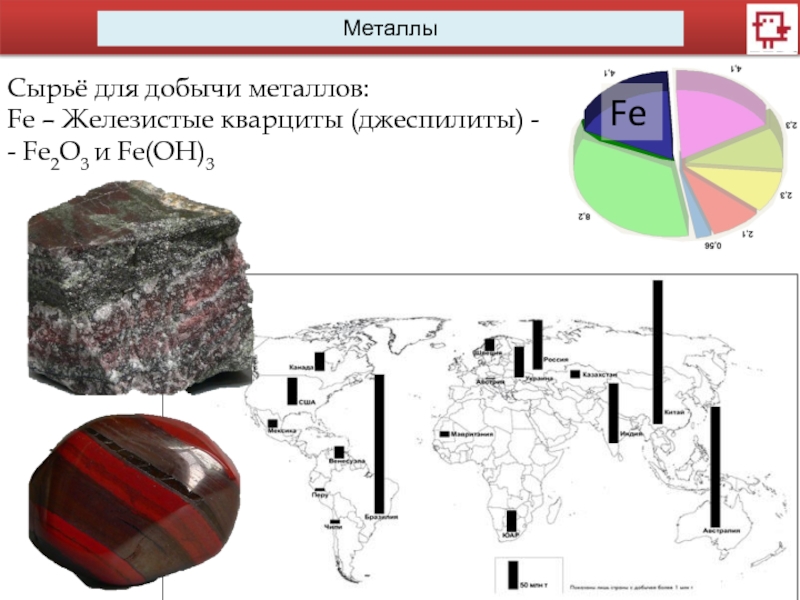
- 6. МеталлыСырьё для добычи металлов:Fe – Железистые кварциты (джеспилиты) -- Fe2O3 и Fe(OH)3 Fe
- 7. МеталлыСырьё для добычи металлов:Ti – ильменит-гематитовые габброTiИльменит – FeTiO3Горная порода габбро
- 8. МеталлыНахождение металлов в природеАктивные: Хлориды NaCl, KCl,
- 9. МеталлыПолучениеNa, K, Ca, Mg получают электролизом.
- 10. МеталлыПолучениеМенее активные металлы получают восстановлением с С,
- 11. МеталлыПолучениеМенее активные металлы получают восстановлением с С,
- 12. МеталлыХимические свойства.На свежем разрезе, s-металлы имеют блестящую
- 13. МеталлыТак, только литий сгорает на воздухе с
- 14. МеталлыВсе металлы, кроме бериллия, вступают в реакцию
- 15. МеталлыРеакции с водой приводят к образованию основания
- 16. МеталлыZn + 2HCl = ZnCl2 + H2Cu
- 17. МеталлыЦинковая пластинка массой 10,0 г опущена в
- 18. МеталлыЦепочка:Mg – MgSO4 – Mg(NO3)2 – MgO – (CH3COO)2Mg
- 19. МеталлыКак доказать, что при горении металлического натрия образуется не оксид, а пероксид?
- 20. Урок 9 классаСплавы
- 21. СплавыМеталлы тоже можно смешивать между собой. Сплав
- 22. Скачать презентанцию
ОГЭ:По четвергм в 410 в 17:00 до 18:30
Слайды и текст этой презентации
Слайд 7Металлы
Сырьё для добычи металлов:
Ti – ильменит-гематитовые габбро
Ti
Ильменит – FeTiO3
Горная порода
габбро
Слайд 8Металлы
Нахождение металлов в природе
Активные:
Хлориды NaCl, KCl, MgCl;
Сульфаты Na2SO4,
CaSO4, MgSO4;
Нитраты NaNO3, KNO3;
Ортофосфаты Ca3(PO4)2
Средней активности:
Оксиды Fe2O3, Fe3O4, Cr2O3;
Сульфиды
PbS, HgS, ZnSБлагородные:
- В самородном виде Ag, Au, Pt
Слайд 10Металлы
Получение
Менее активные металлы получают восстановлением с С, CO или Al.
SnO2
+ C =
Fe2O3 + CO =
MnO2 + Al
= Слайд 11Металлы
Получение
Менее активные металлы получают восстановлением с С, CO или Al.
Сульфиды сначала обжигают.
ZnS + O2 =
ZnO + C =
Слайд 12Металлы
Химические свойства.
На свежем разрезе, s-металлы имеют блестящую поверхности, но вступая
в реакцию с кислородом, быстро тускнеют.
Все s-металлы горят в
атмосфере воздуха образуя оксиды:Нормальные оксиды состава Me2O (1 группа), MeO (2 группа)
Пероксиды Me2O2 (1 группа), MeO2 (2 группа)
Супероксиды MeO2 (1 группа), MeO4 (2 группа)
Так, только литий сгорает на воздухе с образованием оксида:
4Li + O2 = 2Li2O
Натрий образует смесь пероксида и супероксида:
3Na + 2O2 = Na2O2 + NaO2
Слайд 13Металлы
Так, только литий сгорает на воздухе с образованием оксида:
4Li +
O2 = 2Li2O
Натрий образует смесь пероксида и супероксида:
3Na + 2O2
= Na2O2 + NaO2Для того, что бы получить оксиды натрия и калия нужно:
K2O2 + 2K = 2K2O
Слайд 14Металлы
Все металлы, кроме бериллия, вступают в реакцию с водородом, образую
гидриды:
2Li + H2 = 2LiH
При реакции с галогенами:
Hal2 + Ca
= CaHal2Так же, образуются сульфиды, нитриды, фосфиды, карбиды, силициды.
Слайд 15Металлы
Реакции с водой приводят к образованию основания и…
2Li + 2H2O
= 2LiOH + H2
Na2O + H2O = 2NaOH или Na2O
+ H2O = NaOH + H2Zn + 2HCl = ZnCl2 + H2
Cu + HCl =
Fe + CuSO4 = FeSO4 + Cu
Cu + FeSO4 =
Слайд 16Металлы
Zn + 2HCl = ZnCl2 + H2
Cu + HCl =
Fe + CuSO4 = FeSO4 + Cu
Cu + FeSO4 =
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Слайд 17Металлы
Цинковая пластинка массой 10,0 г опущена в раствор сульфата меди(II).
После окончания реакции 1 промытая и высушенная пластинка имеет массу
9,90 г. Объясните изменение массы пластинки и определите массу сульфата ме- ди(II), находившегося в растворе (M(Cu) = 63,54 г/моль, M(Zn) = 65,38 г/моль).Слайд 21Сплавы
Металлы тоже можно смешивать между собой.
Сплав — макроскопически однородный
металлический материал, состоящий из смеси двух или большего числа химических
элементов, обычно металлов. Такие вещества обладают свойствами, которых раньше не было у их составляющих по отдельность – поэтому сплав, не смесь!ОТЛИЧИЕ СПЛАВА, ОТ ТВЕРДОГО РАСТВОРА