Слайд 1Влияние легирования на растворимость
Лекция 6
Слайд 2При сравнении с бинарными металл - водородными системами, рассмотренными в
предшествующей главе, системы водород - сплав являются, естественно, более сложными
и нуждаются в специальном анализе. Составленная более чем из двух видов атомов, кристаллическая решетка, вообще имеет более сложную структуру, содержащую много видов междоузлий с различными химическими и также геометрическими конфигурациями окружающих атомов. В неупорядочных или аморфных сплавах, дефекты могут непрерывно изменять локальные конфигурации. Таким образом, можно ожидать, что атомы H распределены по различным энергетическим состояниям.
Подход к этим системам исходит из следующих двух соображений. Исследуются средние результаты влияния элемента на предельную растворимость водорода. В некоторых случаях, этот средне - полевой подход оказывается довольно полезным, но в то же самое время показывает во многих случаях собственную ограниченность.
Слайд 3Поэтом следующий шаг заключается в разработке формализма, который учитывает распределение
энергий местонахождения для атомов H. Этот формализм применяется к проблеме
захвата в ловушку и блокирования атомами растворенного вещества атомов водорода и, впоследствии, к водороду в аморфных сплавах. .
Влияние легирования на растворимость
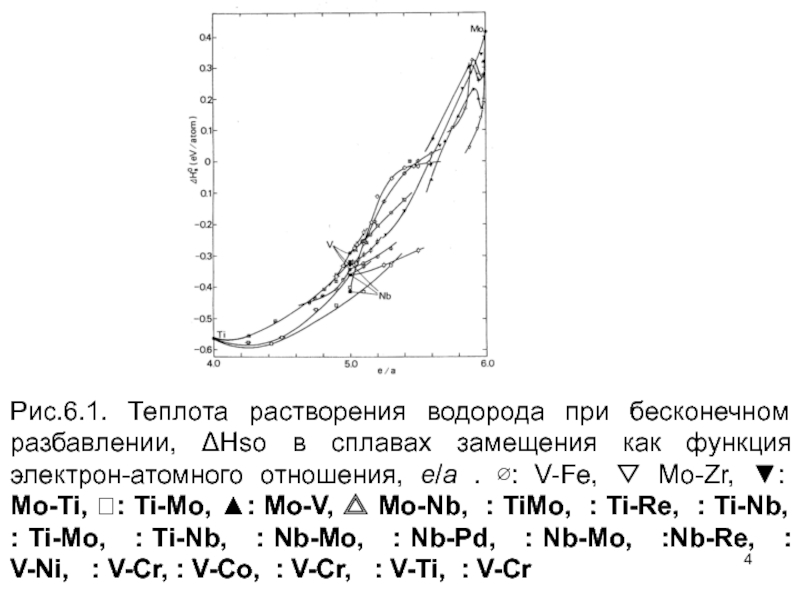
Влияние легирующих атомов растворенного вещества на растворимость водорода в металлах привлекло внимание многих исследователей уже 1930-ые годы, главным образом, из-за практических приложений Pd сплавов, но тогда еще не была ясна общая физическая картина данного явления. В начале необходимо оценить относительную важность средних электронных и упругих вкладов. Рисунок 6.1 показывает теплоты растворения при бесконечном разведении, Нso, полученную для сплавов, легированных переходными металлами группы IV-VI. Полная корреляция между Нso и средним отношением "электрон к атому" (e/a) очевидна.
Слайд 4Рис.6.1. Теплота растворения водорода при бесконечном разбавлении, Hso в сплавах
замещения как функция электрон-атомного отношения, e/a . : V-Fe,
Mo-Zr, : Mo-Ti, : Ti-Mo, : Mo-V, Mo-Nb, : TiMo, : Ti-Re, : Ti-Nb, : Ti-Mo, : Ti-Nb, : Nb-Mo, : Nb-Pd, : Nb-Mo, :Nb-Re, : V-Ni, : V-Cr, : V-Co, : V-Cr, : V-Ti, : V-Cr
Слайд 5Кроме того, крутые линии, наблюдаемые для Mo–V и сплавов Mo–Nb
близко к Mo стороне, и широкий минимум, наблюдаемый для сплавов
Ti–Mo вблизи Ti, как известно, являются скоррелироваными с наблюдаемыми аномалиями в коэффициенте электронной удельной теплоемкости e. С другой стороны, некоторая корреляция была найдена между Нso и постоянной кристаллической решеткой. Таким образом, в этих случаях электронное взаимодействие – намного более важный фактор в определении Нso, чем количественный (объемный) эффект. В случае Pd ситуация отлична. На рис. 6.2 показан подобный график, Нso в зависимости от e/a , для сплавов на основе Pd. Никакой систематической закономерности не наблюдается, за исключением того, что несколько кривых показывают общий минимум при e/a = 0.4-0.6. Это соответствует, по сути, заполнению электронных уровней Ферми, и, как ожидается, перемещению его от высокого ДОСа 4d полосы в низкий ДОС 5s полосы, вызывая более быстрое увеличение электронной энергии с концентрацией растворенного вещества. Однако средний электронный вклад не может считаться главной причиной изменения Нso в палладии.

Слайд 6Рис.6.2. Теплота растворения водорода при бесконечном разбавлении, Hso в сплавах
палладия как функция электрон-атомного отношения, e/a . : V,
: Mn, : Co, : U, : Ni, : Cu, : Rh, : Ag, : Sn< : Сe, : Ir, : Pt, : Au, : Pb
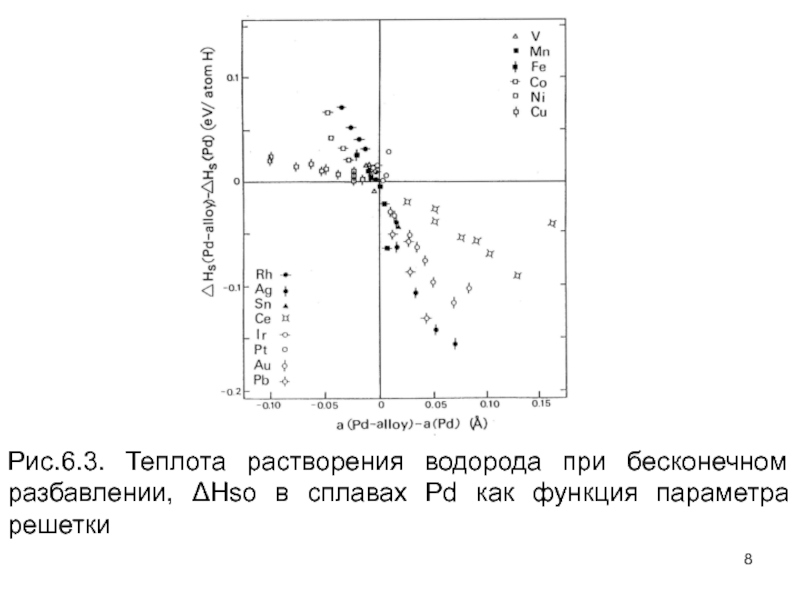
Слайд 7Фактически лучшая корреляция была найдена, когда значения Нso нанесены против
постоянной кристаллической решетки, как это показано на рис. 6.3. Нso
становится более отрицательным с увеличением объема. Таким образом, в случае сплавов на основе Pd количественный эффект более важен, чем средний электронный вклад в определении Нso
Из данных рис. 6.3 с помощью метода наименьших квадратов, исключая Cu и данные по Ce, можно получить эмпирическую формулу
Эта величина может быть сравнена с оценкой, полученной от среднего упругого взаимодействия, описанного в предшествующем разделе,
Слайд 8Рис.6.3. Теплота растворения водорода при бесконечном разбавлении, Hso в сплавах
Pd как функция параметра решетки
Слайд 9использование Ко = 1923 ГПа и vH = 2.8 Å3.
Если мы включаем растворенные вещества Cu и Ce, корреляция между
Нso и постоянной кристаллической решетки становится заметно меньшей. Можно отметить, что отсутствует возможность объяснить наблюдаемое изменение в Нso типом растворенного вещества и линейной суперпозицией упругих и электронных вкладов, например, в форме
с любым произвольным выбором параметров с1 и с2 для данного металла растворителя.
Таким образом, попытки скоррелировать влияние легирования на Нso со средними упругим и электронным взаимодействиями оказываются только частично успешными. Поэтому необходимо искать некоторый другой механизм, в котором атомы растворенного вещества влияют на растворимость.
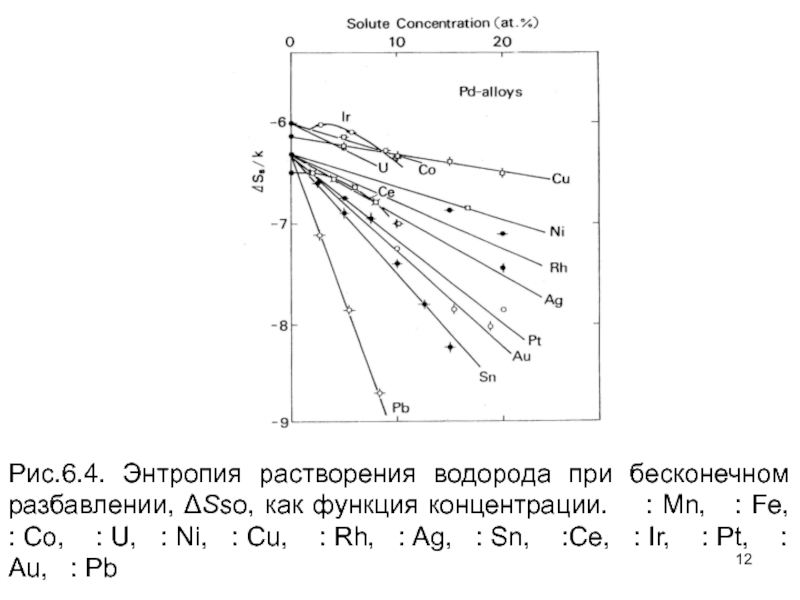
Слайд 10Интересные результатов по влиянию легирования могут быть получено при исследовании
энтропии растворов при бесконечном разведении Ss. На рис. 6.4 показано,
что в сплавах на основе Pd, Ss уменьшается с концентрацией растворенного вещества для всех растворенных элементов. Это предполагает, что количество доступных для водорода междоузлий, r, уменьшается с увеличением концентрации растворенного вещества, вероятно, в результате отталкивающих взаимодействий между атомами растворенного вещества и H.
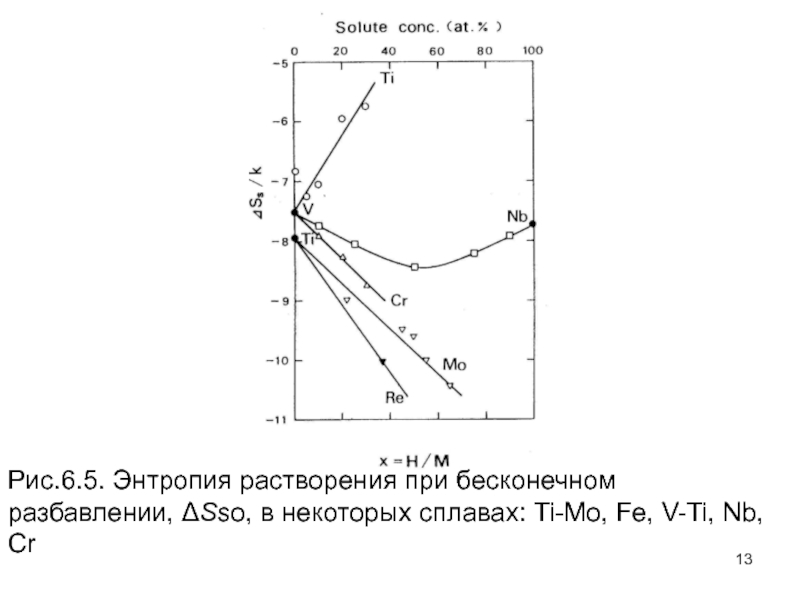
Слайд 11Подобные наблюдения были сделаны в Ti, V и сплавах Nb,
как это показано на рис. 6.5. Единственное исключение – для
Ti и V, в котором Ss увеличивается с увеличением концентрации Ti. Это может понято, поскольку атомы Ti действуют в V как ловушки для H атомов. Из этих результатов по определению Ss следует, что локальное конфигурационное состояние играет важную роль в определении растворимости H в легированных сплавах в дополнение к среднему состоянию данной конфигурации.
Слайд 12Рис.6.4. Энтропия растворения водорода при бесконечном разбавлении, Sso, как функция
концентрации. : Mn, : Fe, : Co,
: U, : Ni, : Cu, : Rh, : Ag, : Sn, :Ce, : Ir, : Pt, : Au, : Pb
Слайд 13Рис.6.5. Энтропия растворения при бесконечном разбавлении, Sso, в некоторых сплавах:
Ti-Mo, Fe, V-Ti, Nb, Cr
Слайд 14Теплоты растворения при более высоких концентрациях водорода также подтверждают этот
вывод. Рисунок 6.6 показывает, что увеличение Нso при высоких концентрациях
H имеет своим следствием понижение концентрации как можно большего количества атомов растворенного вещества. Это поведение может быть понято, если считать, что некоторое локальное отталкивание имеет место между атомами растворенного вещества и H. Тогда атомы H будут ограничены меньшим числом междоузлий и, следовательно, отталкивающее взаимодействие, в среднем, между H атомами станет более сильным.
Слайд 15Рис.6.6. Теплота растворения водорода, Hs , в сплавах замещения как
функция концентрации водорода: Ti-Mo, V-Cr, Pd-Ag
Слайд 16Влияние легирования на предельную растворимость
водорода в сплавах
Слайд 17В легированных сплавах предельная растворимость водорода (Terminal Solubiliti of Hydrogen
- TSH) при низких концентрациях растворенного вещества зависит от разновидности
растворенного вещества, но имеется тенденция к ее увеличению при высоких концентрациях растворенного вещества. Можно предложить простое объяснение увеличению TSH, основанное на термодинамике твердого раствора.
Рисунок 6.7 показывает, как линия растворимости твердого раствора сдвинута к высоким концентрациям H с увеличением концентрации растворенного вещества в сплавах Nb–Ti. Подобные результаты были также получены для V и Mo в Nb. Изменение TSH в широких пределах композиций сплава видно на рис. 6.8, где показаны предельные растворимости при 250 К для Nb–V и сплавов Nb–Ta. Наблюдаемая TSH показывает явный максимум в некоторой композиции сплава, заметно больший, чем линейная комбинация наблюдаемого TSH исходных металлов. В этих сплавах большинство объемных свойств, таких как параметр кристаллической решетки, электронный DOS в уровне Ферми, и теплота растворения водорода, изменяются монотонно с композицией сплава.

Слайд 18Рис.6.7. Смещение линий растворимости в сплавах Nb-Ti-H
Слайд 19Рис.6.8. Предельная растворимость водорода при 250 К
в сплавах Nb-V
и Nb-Ta
Слайд 20Рассмотрим равновесное состояние между и фазами псевдобинарной системы
МНx, где М = A1-yBy. Предположим, что гидридная фаза имеет
почти постоянную композицию МНx. На рис. 5.2 видно, что функция свободной энергии g имеет очень острый минимум, т. е.
(6.1)
(6.2)
(6.3)
Для фазы запишем
(6.4))
Получаем следующие выражения:
(6.5)
(6.6)
Слайд 21Равновесное состояние, условие общей касательной может быть
записано так:
следовательно,
Замена
Для
свободной энергии формирования гидрида МHx в H2 газе
в стандартном
состоянии
в результате получаем
(6.11)
(6.10)
(6.9)
(6.8)
(6.7)
Слайд 22Отметим здесь, что левая часть – возрастающая функция x в
концентрационном диапазоне, представляющем интерес: 0 < x < a ,
когда a < r, и 0 < x < r, когда r < a. Свободные энергии формирования гидридов сплава, как ожидается, будут выше во всех случаях, чем таковые для составляющих металлических гидридов, которые, согласно (6.11), приводят в равновесную концентрацию H в - фазе соответственно к более высоким значениям..
Предполагается, что металлы A и В имеют ту же самую структуру и формируют идеальный раствор. Что касается гидридов, необходимо учесть то, что гидрид АН, который сосуществует с - АНx , не может быть изоморфным с гидридом ВНb, который сосуществует с - ВНx.
В малолегированных сплавах имеет место локальное взаимодействие между H и атомами растворенного вещества в - фазе, свойства гидридной фазы ответственны за изменение TSH.
Слайд 23Растворение водорода. Захват и блокировка
В большинстве предшествующих исследованиях принималось, что
H атомы распределены по междоузлиям, имеющим ту же самую энергию.
В случае локального взаимодействия между водородом и атомами растворенного вещества или между водородными атомами возникает ситуация, при которой определенное количество междоузлий блокировано таким взаимодействием и атомы H частично или полностью исключены из этих местонахождений (блокирование), или полностью связаны к этим местонахождениям (захват), прежде чем они начнут движение в следствие термической активации.
Фактически уровень потерь или захват в ловушку может измениться с температурой согласно относительной величине энергетической разности между нарушенными (возмущенными) и неискаженными (невозмущенными) местонахождениями.
Слайд 24Так называемый двухямочный формализм (состояний) применяется к междоузлиям, которые имеют
две различные энергии захвата или блокировки. Рассмотрим случай двух энергетических
состояний: N1 междоузлия с энергией E1 и N2 местонахождениями с энергией E2. Распределение атомов H таково, что число путей распределения n атомов по этим местонахождениям становится максимальным для данной полной энергии. Согласно статистической физике распределение Ферми – Дирака в этом случае имеет вид
где - химический потенциал H атомов.
предположим, что имеются атомы примеси, которые понижают первоначальную энергию местонахждения Eo до энергии связи Еb. Запись общего количества местонахождений как N и количества нарушенных местонахождений Nd можно представить (6.13) как
(6.13)
Слайд 256.14)
из которого получаем
(6.15)
Здесь, как и прежде, концентрации написаны как
отношения к числу М. атомов, r = N/No, x =n/No,
rd = Nd / No, и = exp (Eb/kT). Можно говорить, что атомы примеси или улавливают, или блокируют атомы H в зависимости от того, как Еb > 0 или Еb < 0.
Рассмотрим два случая ограничения: сильный захват в ловушку и сильное блокирование. В случае сильного блокирования (-Еb kT) второй терм в (6.14) становится маленьким и получаем
(6.16)
Слайд 26, r = N/No, x = n/No, rd = Nd
/ No, и = exp (Eb/kT).
В случае сильного
блокирования (-Еb kT), второй терм в (6.14) становится маленьким, и мы получаем
где r ' = r — rd. В случае сильного захвата в ловушку (Еb kT), все H атомы будут захвачены пока x < rd . В этом случае, первый терм в (6.14) невелик (Еo — kT), и получаем
(6.17)
(6.18
Слайд 27по сравнению с первоначальным родным металлом, не содержащим атомы растворенного
вещества, химический потенциал, как и предполагалось, увеличивается при блокировке и
уменьшается при захвате.
Изменение химического потенциала с водородной концентрацией показано на рис. 6.9. Для простоты кривые демонстрируют только три случая: блокирование (Eb/kT = -10); отсутствие взаимодействия (при Eb = 0); захват (при Еb/kT = 10), с r = 1 и rd = 0.2. Когда Eb/kT становится большим по величине, стадии при Eo и Eo - Eb станут более четко выделенными, делая аппроксимацию полного блокирования или захвата в ловушку более определенной.
Слайд 28Рис.6.9. Химический потенциал как функция концентрации водорода в присутствии ловушек
или блокировки: а) с концентрацией пор-ловушек rd = 0.2 и
энергией связи Eb/kT =10; б) с захватом и блокировкой; в) с блокировкой пор с концентрацией rd = 0.2 и энергией связи Eb/kT = -10
Слайд 29Рассмотрение как влияет легирование на спинодальный распад может быть выполнено,
прибавляя терм –
к химическому потенциалу в (6.15), или
(616), или (6.18) в двух граничных случаях сильного захвата в ловушку и сильного блокирования, соответственно. Тогда критическая точка может быть легко рассчитана, со следующими результатами:
сильный захват:
сильное блокирование
где критическая точка в чистом металле растворителе представлена (xco, Тco) и для легированного образца (xc, Тc). Предельно-допустимая концентрация увеличивается при захвате и уменьшается при блокировке, но критическая температура понижается в обоих случаях.
Слайд 31Большинство аморфных сплавов сформированы в результате быстро охлаждая расплав к
комнатной температуре или ниже при скоростях охлаждения 104÷106 К с-1.
Другие методы типа теплового испарения, распыления, электроосаждения, и ионной имплантации также были использованы. Во всех этих методах, образцы обычно получаются в форме тонкой пленки или фольги. Аморфные сплавы могут также быть получены путем размолом на шаровой мельнице в элементарные металлические порошки за 30÷60 часов (механическое сплавление), или, в некоторых случаях, просто гидрируя кристаллические сплавы. В этих методах получены также порошковые образцы.
Аморфные сплавы термодинамически метастабильны и проходят ряд кристаллических стадий, когда нагреваются до температуры кристаллизации, Tcryst = 200÷500 °C, в зависимости от состава сплава.
Слайд 32Таким образом, при насыщении аморфных сплавов водородом или электролизе, или
газовой фазы, должны быть приняты меры предосторожности, чтобы не произошел
нагрев выше Tcryst. В данном случае нельзя активировать поверхность, нагревая ее в вакууме или Н2 газе, как обычно делается в случае кристаллических образцов. Поэтому в большинстве случаев очищают поверхность наждачной бумагой или ультразвуком в ацетоне или эфире. При покрытии поверхности Pd поверхность очищают посредством аргон - ионного распыления и как известно, это более эффективно.
Слайд 33Термодинамические свойства водорода в аморфных сплавах
Рассматриваемые здесь аморфные сплавы имеют
отрицательные теплоты растворения водорода. Они могут быть грубо классифицированы в
три группы: 1) сплавы легких переходных металлов (ETM: Y, Ti, Zr, Hf), переходными металлами 7–8 групп (LTM: Fe, Ni, Cu, Rh, Pd); 2) сплавы РЗМ металлы (Re, La, Ce, Pr, Sm, Gd) и LTM (Co, Ni); и 3) сплавы металлов с элементами металлоидных свойств (P, Si, и т.д.).
Слайд 34Типичные кривые p–x–T , измеренные для сплава Zr–Ni, показаны на
рис. 6.10. Одно из наиболее характерных изменений в переходе от
кристаллического к аморфному состоянию сплавов – исчезновение плато на изотермах. Фактически ни в одном случае в системах "аморфный сплав– водород" признаки плато на p-x-T изотермах не проявлялись. Отсутствие плато и сопутствующего распада в течение циклов абсорбция/десорбция послужило основанием предложить использование аморфных сплавов для хранения водорода.
Слайд 35Рис.6.10. Изотермы давление – состав для водорода в аморфном и
кристаллическом сплаве Zr50Ni50
Слайд 36Рисунок 6.11 показывает, что закон Сивертса для аморфных сплавов практически
не соблюдается. Положительное отклонение от закона Сивертса при высоких концентрациях
H также наблюдается и в других случаях и, как полагают, является общей особенностью систем "аморфный сплав – водород". Причина должна заключаться в том, что имеется распределение энергетических состояний в аморфном строении и атомы H занимают их последовательно до самого высокого энергетического состояния.
Слайд 37Рис.6.11. Графики закона Сивертса для изотерм давление – концентрация в
аморфных сплавах Zr-Ni
Слайд 38. Как в кристаллических металлах и сплавах, гидрирование в большинстве
случаев вызывает объемное расширение, с увеличением объема на атом H
что очень схоже с кристаллическим случаем (см. разд. 2.2). Однако, возможный результат влияния упругого взаимодействия между атомами H, а именно линейное уменьшение теплоты растворения с увеличением концентрации H, не наблюдается. По общему признанию это связано с тем, что очень трудно изолировать этот терм в присутствии энергетического распределения по местонахождениям.
В одном наблюдении относительно изменения объема показано, что в Pd80Si20 и Ni34Pd48P18, имеют нормальное объемное расширение с ~ 2.5 Å3, которое происходит при концентрациях H приблизительно 10-4, но при более низких концентрациях имеет место объемная усадка с vH 1.5 Å3. Это показывает, что атомы H до концентрации 10-4 заполняют глубокие ловушки, природа которых все еще неизвестна.
Слайд 39Распределение атомов водорода
по энергии местонахождения
Слайд 40Непрерывное распределение энергий местонахождения может быть описано в терминах местонахождения
– функция энергетического распределения D (E) так, что число местонахождений,
имеющих энергии в диапазоне E – E + dE, дается формулой
и общее количество местонахождений
Слайд 41Число H атомов, занимающих эти местонахождения, может быть расписано так
где
f(E) - функция распределения Ферми - Dirac:
Когда энергетическое распределение по
местонахождениям достаточно широко по сравнению с kT, распределение Ферми – Дирака может быть аппроксимировано ступенчатой функцией,
Слайд 42Предположим, что энергетическое распределение по местонахождениям может быть представлено функцией
Гаусса:
Для kT , отношение между и x может
быть приблизительно определено как
где интеграл вероятности ошибки определен как
где
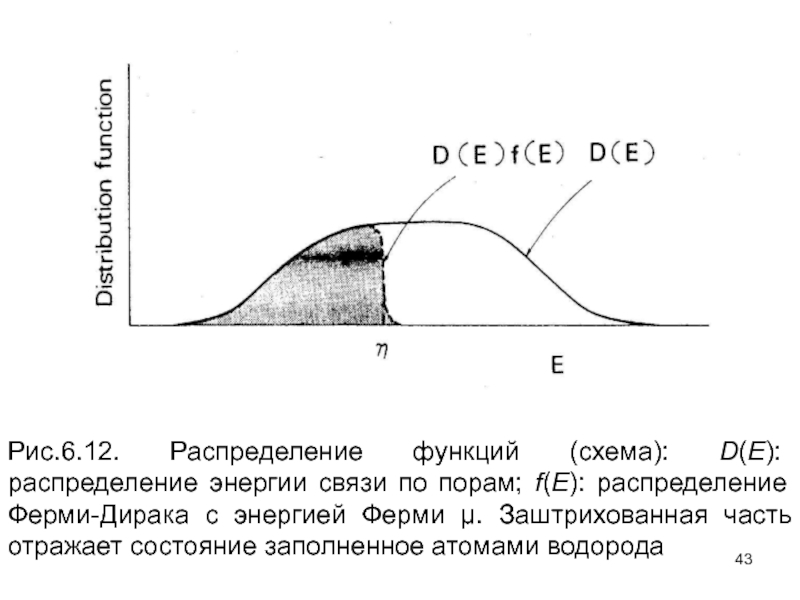
Слайд 43Рис.6.12. Распределение функций (схема): D(E): распределение энергии связи по порам;
f(E): распределение Ферми-Дирака с энергией Ферми . Заштрихованная часть отражает
состояние заполненное атомами водорода
Слайд 44Рис.6.13. Химический потенциал водорода в аморфном сплаве Pd82Si18 при 295
К в зависимости от обратной функции ошибок erf-1 |1-2x|. Пунктирная
кривая связывает химпотенциал с содержанием H – H взаимодействующих пар с энергией 0.12x eV на каждый водородный атом
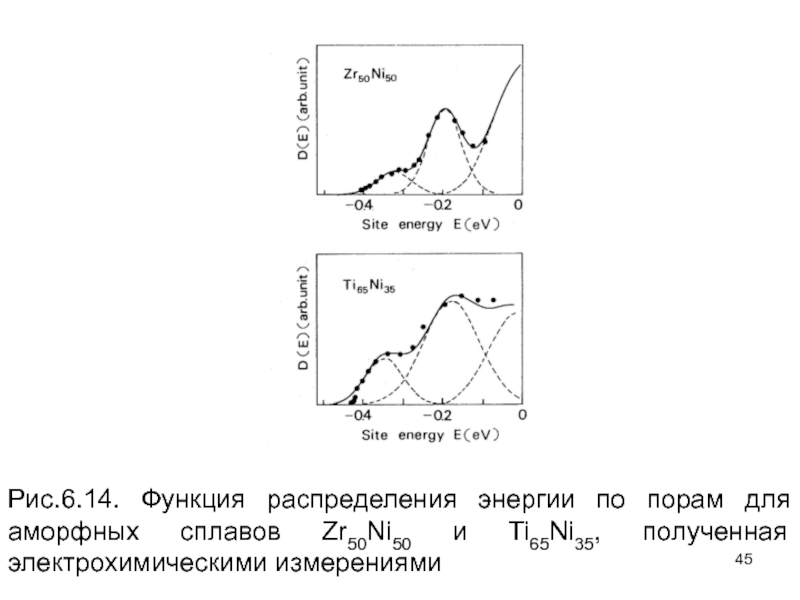
Слайд 45Рис.6.14. Функция распределения энергии по порам для аморфных сплавов Zr50Ni50
и Ti65Ni35, полученная электрохимическими измерениями
Слайд 46Рис.6.15. Вариации температуры спинодального распада с распределения функции энергии связи
водорода в порах. Ширина распределения 2 определяет силу Н-Н взаимодействия
. Показаны расчеты по теории среднего поля (пунктир) и теории решеточного газа (сплошная линия)
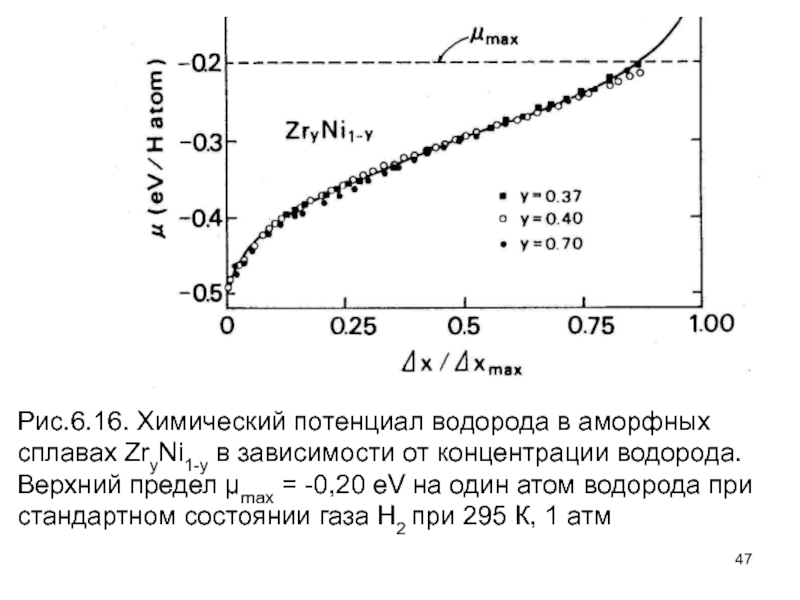
Слайд 47Рис.6.16. Химический потенциал водорода в аморфных сплавах ZryNi1-y в зависимости
от концентрации водорода. Верхний предел max = -0,20 eV на
один атом водорода при стандартном состоянии газа H2 при 295 К, 1 атм
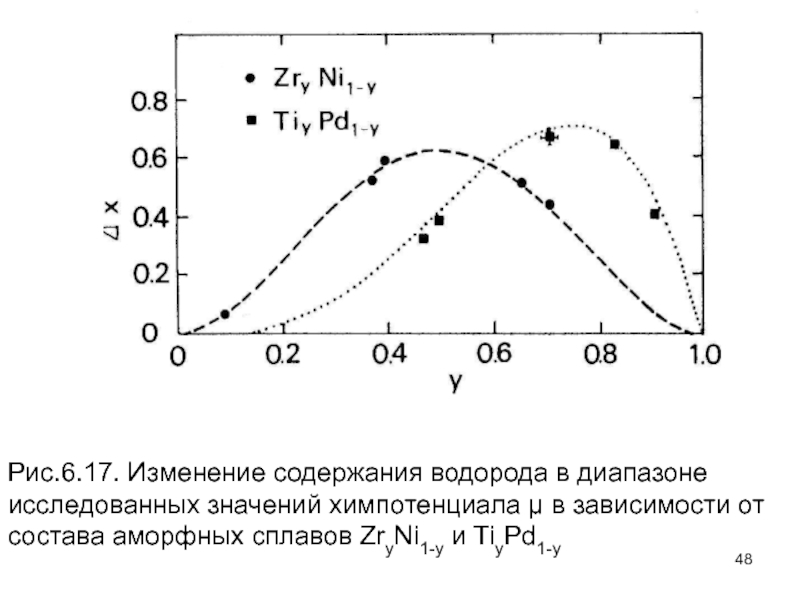
Слайд 48Рис.6.17. Изменение содержания водорода в диапазоне исследованных значений химпотенциала
в зависимости от состава аморфных сплавов ZryNi1-y и TiyPd1-y
Слайд 49Рис.6.18. Распределение энергии связи водорода с тетраэдрической порой в ETM/LTM
аморфных сплавах
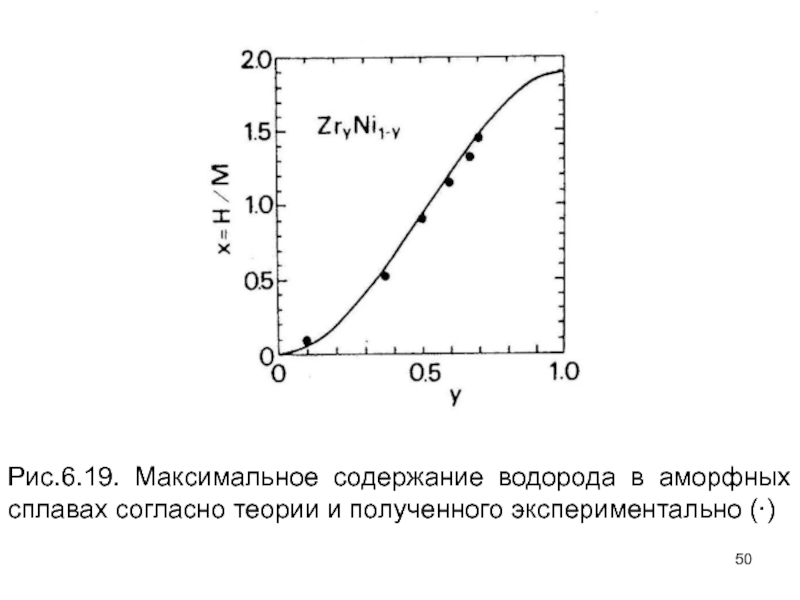
Слайд 50Рис.6.19. Максимальное содержание водорода в аморфных сплавах согласно теории и
полученного экспериментально ()
Слайд 51В 1983 г. Yeh и другие сообщили, что аморфная структура
может быть сформирована посредством насыщения кристаллического Zr3Rh водородом в интерметаллической
фазе при достаточно низких температурах (~ 200 °C). Измерения дифракции рентгеновских лучей, плотности и сверхпроводящих свойств подтверждали, что аморфные гидриды сплава, подготовленные гидрированием кристаллических сплавов, были те же, что и подготовленные гидрированием и быстрым охлаждением аморфные сплавы той же самой композиции.
Слайд 52Это явление, называемое вынужденным водородом переход в аморфное состояние (Hydrogen
Induced of Amorphous - HIA), если путь перехода в аморфное
состояние существенно отличается от других существующих методов, и открывает возможность для подготовки аморфных сплавов без ограничения, чтобы избежать разрушения. Было показано, что такое гидрирование ведет к переходу в аморфное состояние большого количества интерметаллидов, которые перечислено в таблице 6.3.
Слайд 54Только составы СеМ2 переходят в аморфными в широком диапазоне температур.
Во всех этих сплавах переход в аморфное состояние имеет место
при температурах немного ниже температуры декомпозиции в RH2 и Fe, Со или RNi3.Наблюдения под электронным микроскопом показали, что формирование аморфной фазы в Zr3А1 при гидрировании начинается на дефектах в кристалле типа дислокаций и границ зерен.
Слайд 55Термодинамику HIA изучали дифференциальным термографическим анализом в H2 атмосфере, в
которой кристаллический GdFe2Hx переходит в аморфное состояние экзотермически вблизи 470
К. Это подразумевает, что свободная энергия аморфного гидрида более низкая, чем кристаллического гидрида при этой же температуре. Схематично, свободная энергия Гиббса, в кристаллических и аморфных сплавах, должна зависеть от концентрации H и температуры согласно схеме, показанной на рис. 6.20. Таким образом, переход в аморфное состояние может происходить только в случае преодоления кинетического барьера при этих температурах.
Слайд 56Рис.6.20. Термодинамика (схема) вызванной введением водорода аморфизации в сплаве GdFe2