Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Вокруг света. Приключения атомов химических элементов
Содержание
- 1. Вокруг света. Приключения атомов химических элементов
- 2. Атомы как частицы Вселенной Очень большое количество атомов
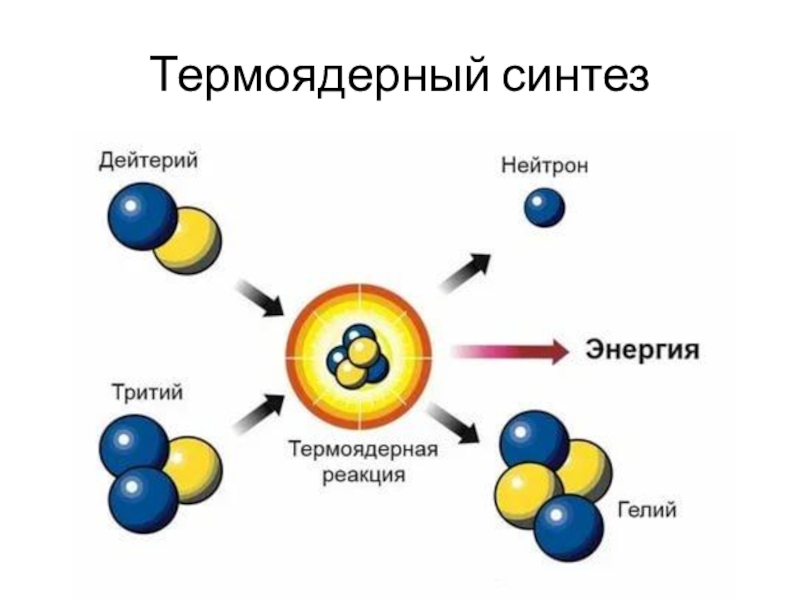
- 3. Происхождение атомов. Термоядерный синтез В звездах при высокой
- 4. Термоядерный синтез
- 5. Протон-протонный цикл Солнца1H + 1H = 2D
- 6. Происхождение атомов. Радиоактивный распадВероятно, при Большом Взрыве
- 7. Закон радиоактивного распадаN (t) = N0 exp ( - kt)
- 8. Задача 1. Период полураспада 14C составляет 5750 лет.
- 9. Задача 2. «Когда подойдешь к кораблю, первым
- 10. РешениеN (t) = N0 exp ( - kt)Сколько же должно быть атомов, чтобы выдать такую активность?
- 11. Шаг 1.Сообразим, что при радиоактивном распаде доля
- 12. Шаг 2. Расчет времени10-9 = exp [-
- 13. Изотопы в живых организмахПока мы живем, организм
- 14. Радиоуглеродный метод датировки Какая доля изотопа 14C уцелеет
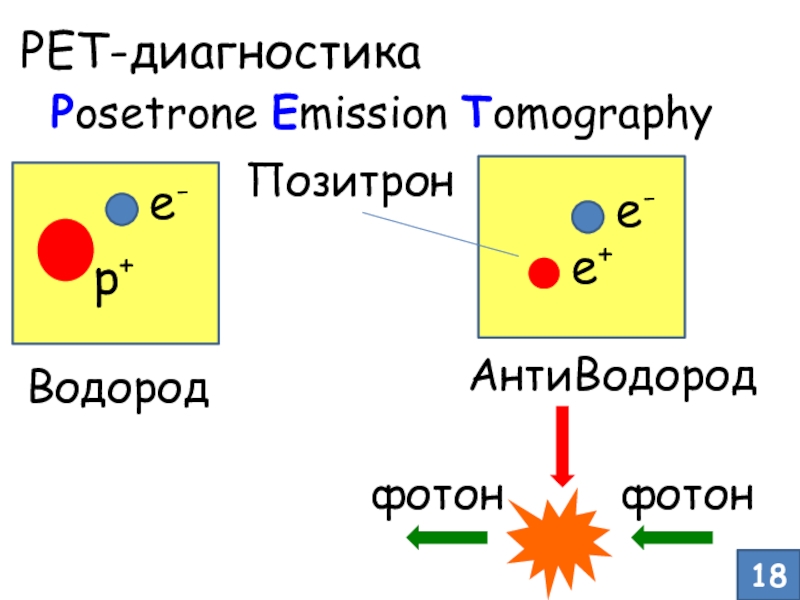
- 15. Секреты ядерной медицины. 18-ФДГОдним из эффективных методов
- 16. PET-диагностика18Posetrone Emission Tomographyp+e-Водородe-АнтиВодородe+Позитронфотонфотон
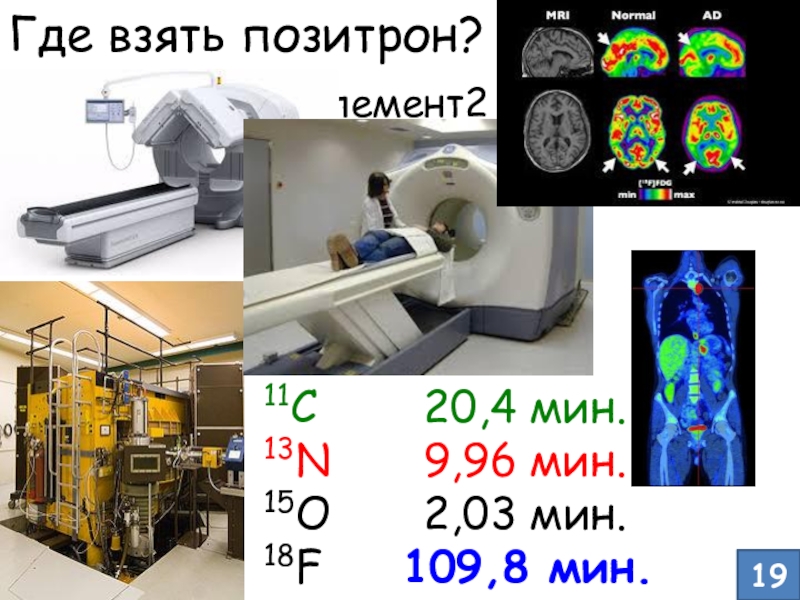
- 17. Где взять позитрон? β+-распад11C
- 18. 2-фтор-[18F]-2-дезоксиглюкозаДоза рассчитывается индивидуально(рост, вес, площадь поверхности тела),200-400
- 19. Изотопный составПлан рассказаЗадача – определить изотопный составПринцип
- 20. Общая идеяМолекулу вещества надо разбить на отдельные
- 21. Чем разбить молекулу?А) энергией, но ее нужно
- 22. Молекулу расстреливают электронами – это смертельно?Пинг-понг –
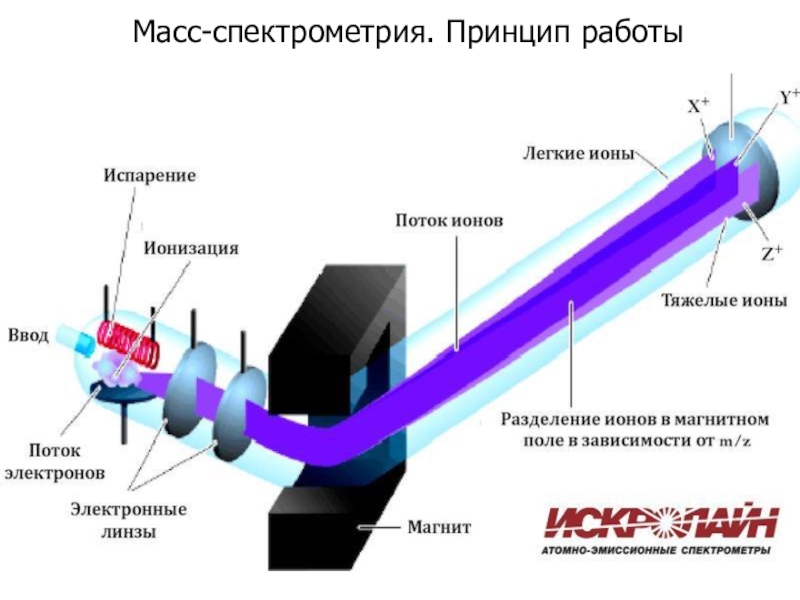
- 23. Масс-спектрометрия. Принцип работы
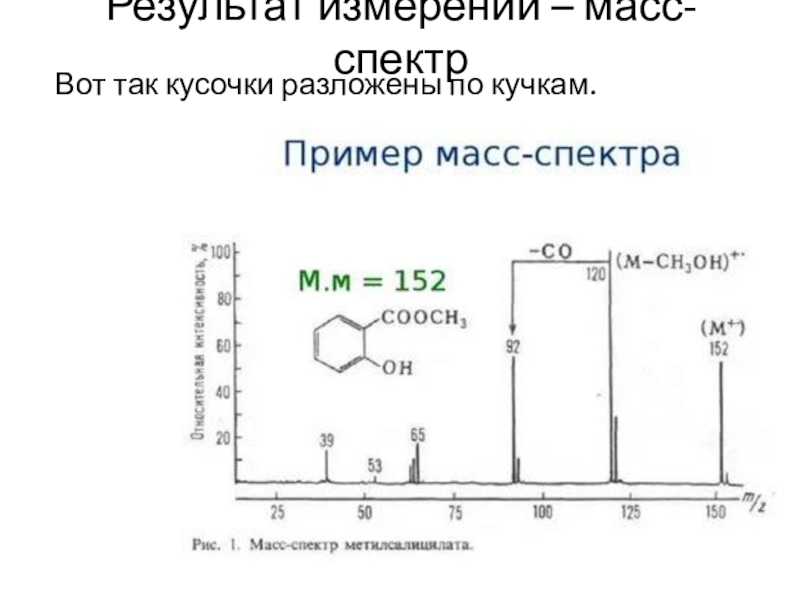
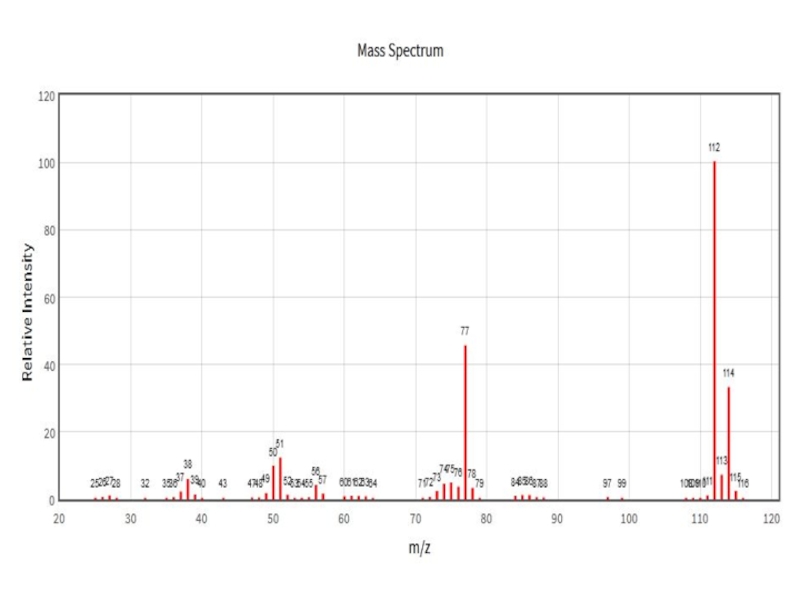
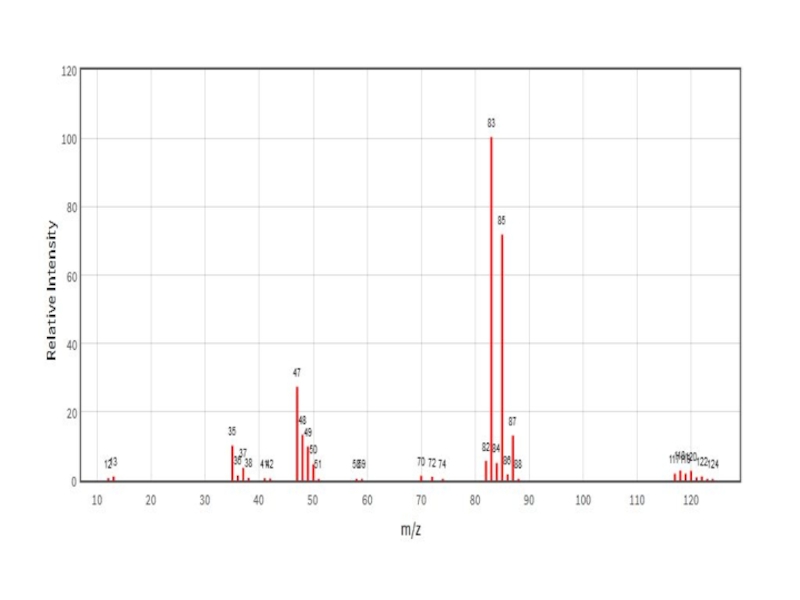
- 24. Результат измерений – масс-спектрВот так кусочки разложены по кучкам.
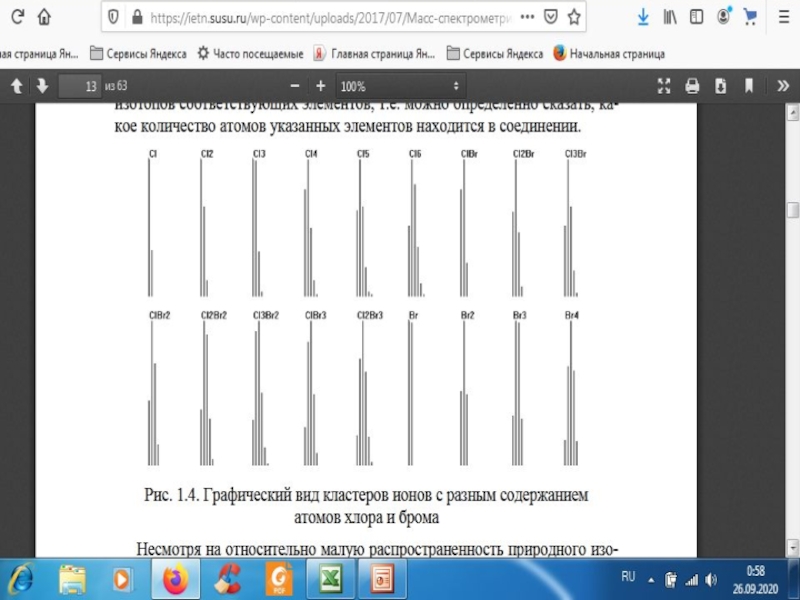
- 25. Природное содержание изотоповХлор Ar = 35,45335Cl 77,35%37Cl
- 26. Слайд 26
- 27. СледствияПосредством анализа изотопного состава можно отличить природный
- 28. Институт геологии и минералогии Сибирского отделения РАН
- 29. Почувствуй себя детективом! Предложите возможные молекулярную и структурную
- 30. Слайд 30
- 31. Слайд 31
- 32. Искренне ВашБредихин Роман Андреевич, к.х.н.НИОХ СО РАН, научный сотрудникСУНЦ НГУ, страшный преподавательИ вся командаvnauke.nsu.ruvnauke.nsk@gmail.ru (Химия)vkontakte.ru/club10559233
- 33. Скачать презентанцию
Атомы как частицы Вселенной Очень большое количество атомов существуют, по-видимому, с момента рождения Вселенной. Big Bang – Большой Взрыв
Слайды и текст этой презентации
Слайд 1Вокруг света.
Приключения
атомов химических элементов
Самым замечательным в мире
школьникам посвящается …
1
Слайд 2Атомы как частицы Вселенной
Очень большое количество атомов существуют, по-видимому, с
момента рождения Вселенной.
Слайд 3Происхождение атомов. Термоядерный синтез
В звездах при высокой температуре происходит термоядерный
синтез – образование более тяжелых элементов из более легких.
Солнце
H 73,5%
He 24,9% остальное 1,6%Слайд 5Протон-протонный цикл Солнца
1H + 1H = 2D + ?
2D +
1H = 3He + hv (гамма-квант)
3He + 3He = 4He
+ 1H + ?Слайд 6Происхождение атомов. Радиоактивный распад
Вероятно, при Большом Взрыве образовались не только
легкие, но и очень тяжелые элементы.
Однако их ядра нестабильны
и постепенно
разрушаются238U 234Th + 4He
Слайд 8Задача 1.
Период полураспада 14C составляет 5750 лет. Рассчитайте период времени,
за который концентрация изотопа 14C упадет в 1000 раз.
Оценка:
За
время, равное периоду полураспада, количество атомов сокращается в 2 раза.210 = 1024
10 периодов полураспада – 57 500 лет.
Слайд 9Задача 2. «Когда подойдешь к кораблю, первым делом проверь уровень
радиации» М/ф «Перевал», 1988, 19 мин. 20 сек.
Через сколько лет
бета-радиоактивность стронция-90 (период полураспада 29,12 лет)упадет с 1 кКи (килоКюри)
до 1 мкКи (микроКюри)?
Слайд 11Шаг 1.
Сообразим, что при радиоактивном распаде доля атомов, распадающихся за
фиксированный промежуток времени, постоянна.
(В самом деле, за время, равное периоду
полураспада, всегда распадается половина имеющегося количества)Значит, доля атомов, распадающихся за 1 секунду, тоже постоянна.
Слайд 13Изотопы в живых организмах
Пока мы живем, организм поддерживает постоянство состава
внутренней среды (гомеостаз)
Это касается, в том числе,
изотопного состава организма
Слайд 14Радиоуглеродный метод датировки
Какая доля изотопа 14C уцелеет в останках мамонта
возрастом 44,8 тыс. лет, если период полураспада 14C 5750 лет?
Вычислите,
сколько атомов 14С содержится в таком аналитическом образце, если минимально необходимая масса углерода равна 0,1 мг, а равновесное содержание углерода 14С в живом организме равно 10-12.Слайд 15Секреты ядерной медицины. 18-ФДГ
Одним из эффективных методов диагностики онкологических заболеваний
является
ПЭТ – Позитронная Эмиссионная Томография
Опухоль – место высокой концентрации
и интенсивного роста клеток, т.е. «горячая точка», где «кипит» обмен веществСлайд 17Где взять позитрон? β+-распад
11C 20,4 мин.
13N
9,96 мин.
15O 2,03 мин.
18F 109,8
мин.Элемент1 Элемент2 + позитрон
Позитрон + Электрон 2 фотона
19
Слайд 182-фтор-[18F]-2-дезоксиглюкоза
Доза рассчитывается индивидуально
(рост, вес, площадь поверхности тела),
200-400 МБк (< 400
распадов в секунду)
Рабочая концентрация препарата –
не выше 10 ммоль/л.
Оцените
массу 5% раствора 2-ФДГ, которой должно оказаться достаточно, для проведения диагностики ПЭТ для Вас.Слайд 19Изотопный состав
План рассказа
Задача – определить изотопный состав
Принцип работы масс-спектрометра –
как это работает, что происходит?
Результат измерений – что мы видим?
Обработка
результата – что это значит?Слайд 20Общая идея
Молекулу вещества надо разбить на отдельные более простые кусочки
Эти
кусочки нужно разобрать по кучкам по весу
Эти кусочки нужно посчитать
Слайд 21Чем разбить молекулу?
А) энергией, но ее нужно много.
Управление плазмой –
задача непростая
Б) другой молекулой, но тогда получим смесь кусков разных
молекулВ) электронами – легкие, почти невесомые, быстрые
Слайд 22Молекулу расстреливают электронами – это смертельно?
Пинг-понг – электрон «стукается» о
молекулу, передает ей часть энергии – и отскакивает прочь
Избыток энергии
молекулы может стать причиной ее ионизации – потери «собственного» электронаСлайд 25Природное содержание изотопов
Хлор
Ar = 35,453
35Cl 77,35%
37Cl 22,65%
35Cl : 37Cl
= 3.4 : 1
Бром
Ar = 79,904
79Br 54,8%
81Br 45,2%
79Br : 81Br
= 1.2 : 1На картинке - 2 пика с массами [M]+ и [M+2]+
Слайд 27Следствия
Посредством анализа изотопного состава можно отличить природный естественный образец от
образца искусственного происхождения.
Анализ изотопного состава природных объектов может дать информацию
о характере их происхождения и некоторых событиях в прошлом (извержение вулкана, падение метеорита, ядерные испытания)Анализ изотопного состава теоретически способен показать географическое происхождение образца (экспертиза, разведка)










![Вокруг света. Приключения атомов химических элементов Шаг 2. Расчет времени10-9 = exp [- tx ln 2 / Шаг 2. Расчет времени10-9 = exp [- tx ln 2 / T1/2]9 ln 10 = 0,692 tx](/img/tmb/7/606216/f06080972ee22a6144f217e2ea71288c-800x.jpg)



![Вокруг света. Приключения атомов химических элементов 2-фтор-[18F]-2-дезоксиглюкозаДоза рассчитывается индивидуально(рост, вес, площадь поверхности тела),200-400 МБк (< 400 распадов 2-фтор-[18F]-2-дезоксиглюкозаДоза рассчитывается индивидуально(рост, вес, площадь поверхности тела),200-400 МБк (< 400 распадов в секунду)Рабочая концентрация препарата – не](/img/tmb/7/606216/83ab91f2108a9db3066fe5916aeb3f52-800x.jpg)