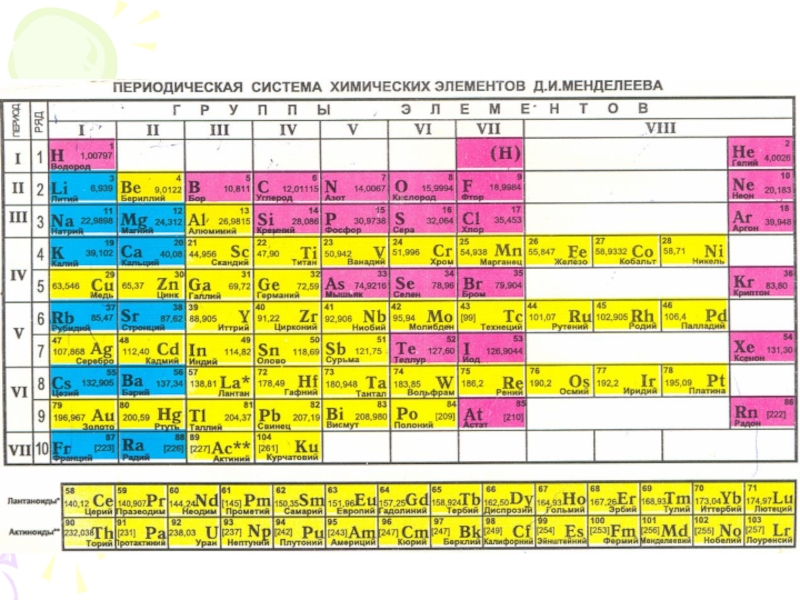
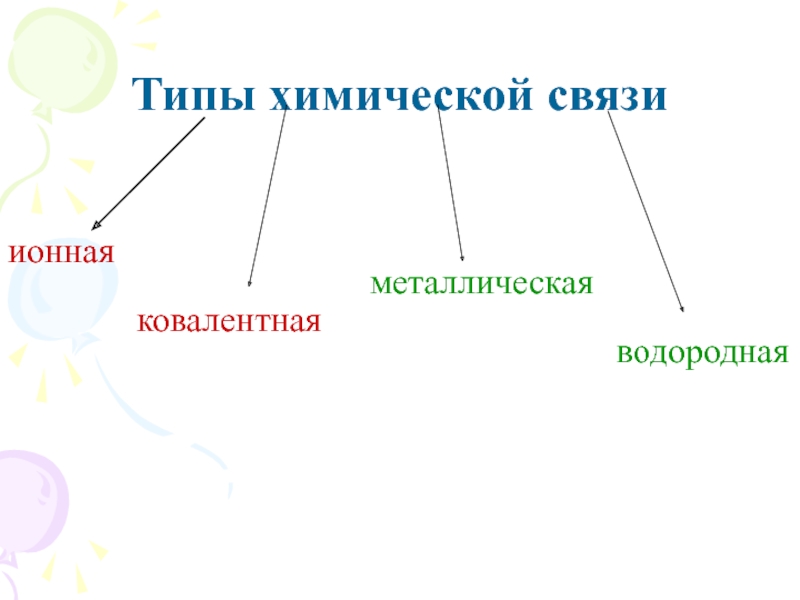
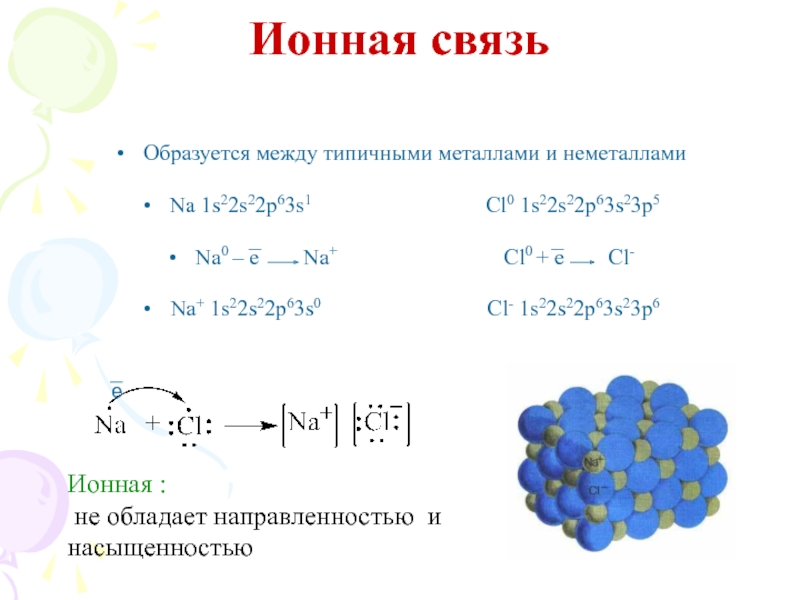
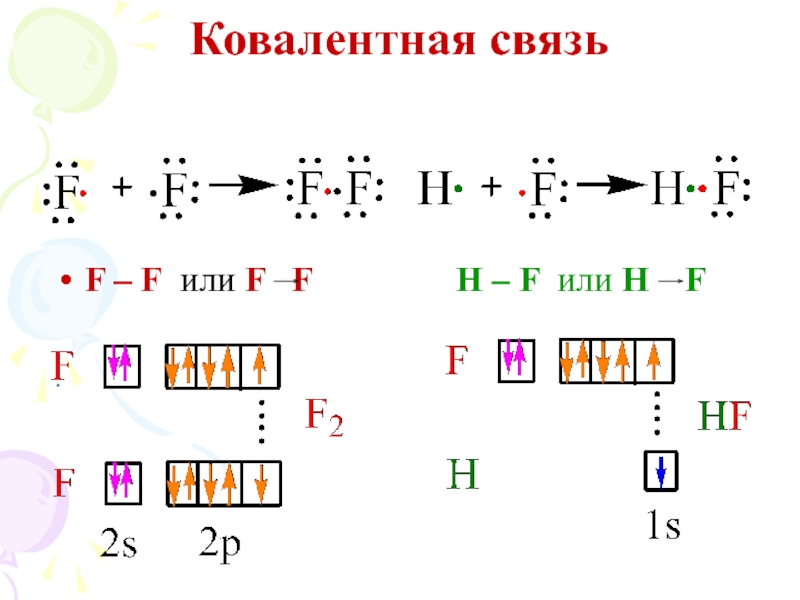
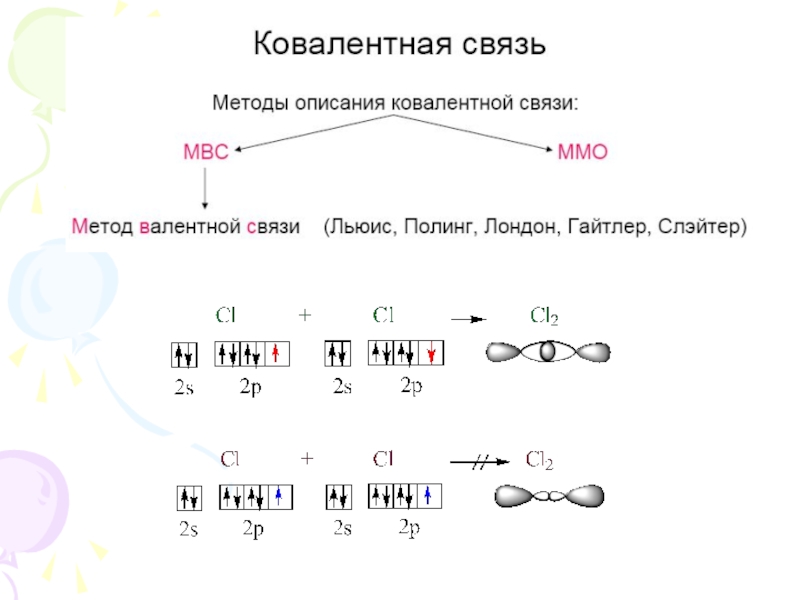
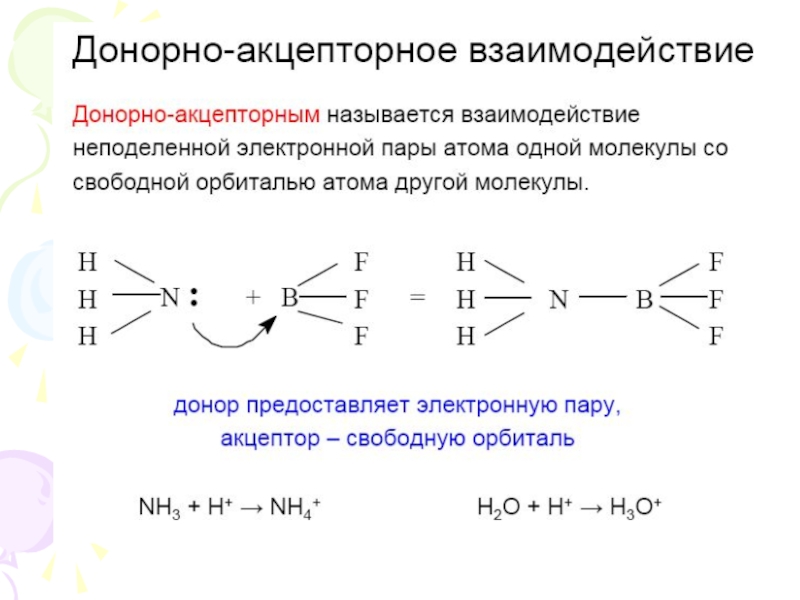
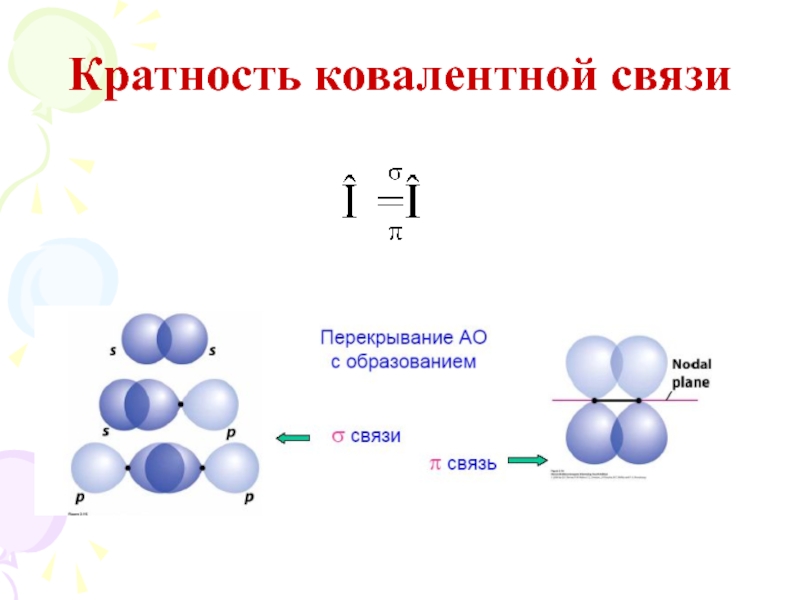
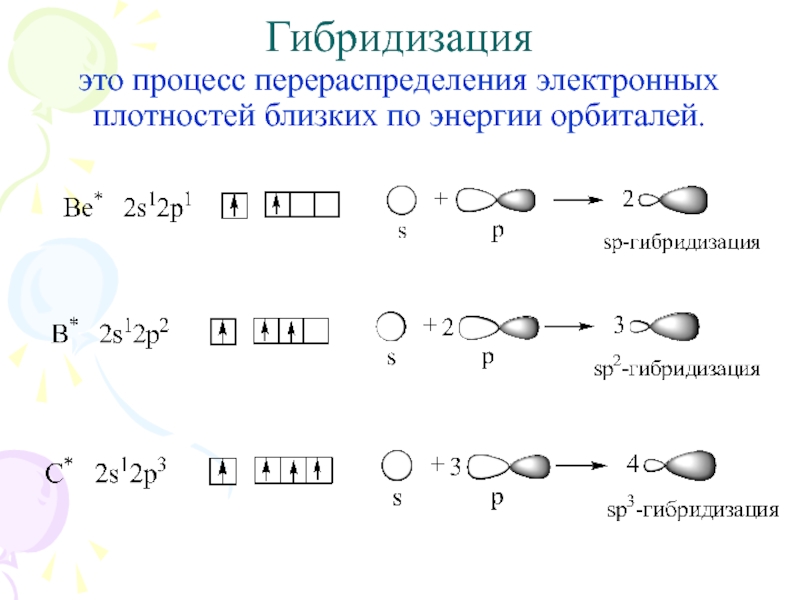
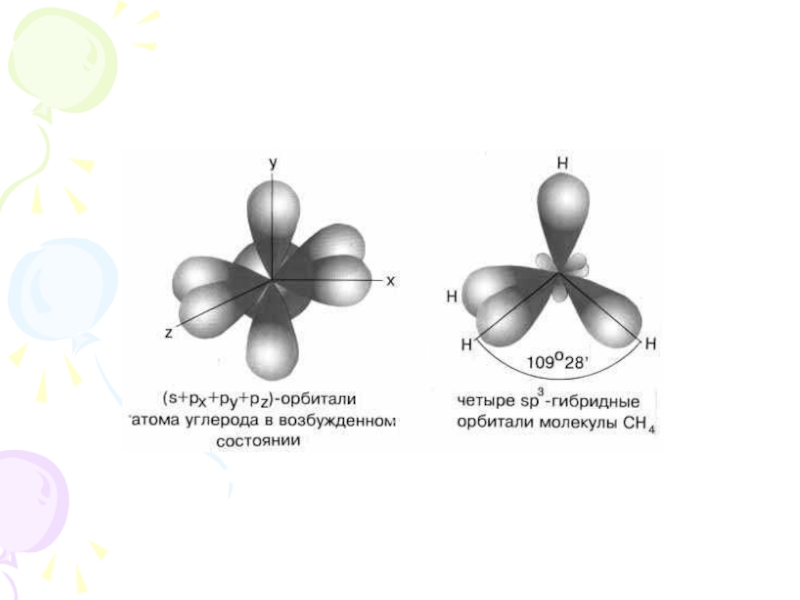
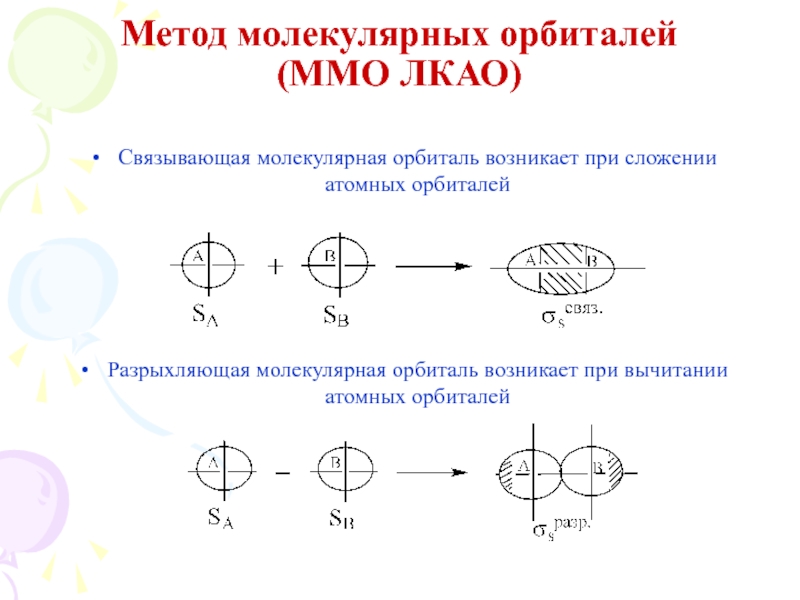
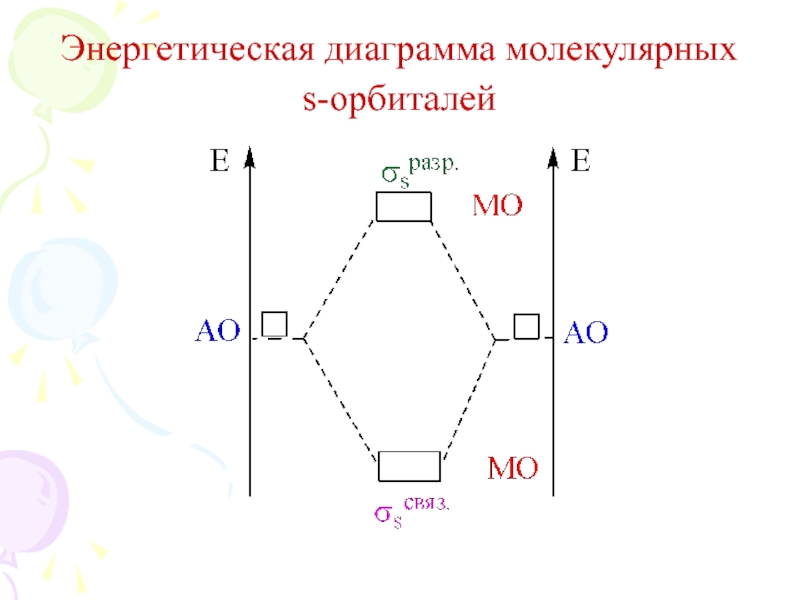
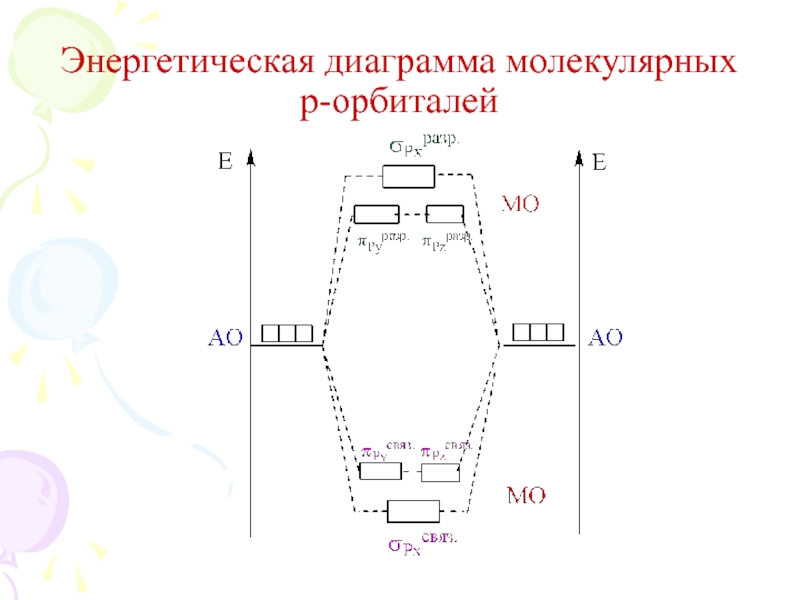
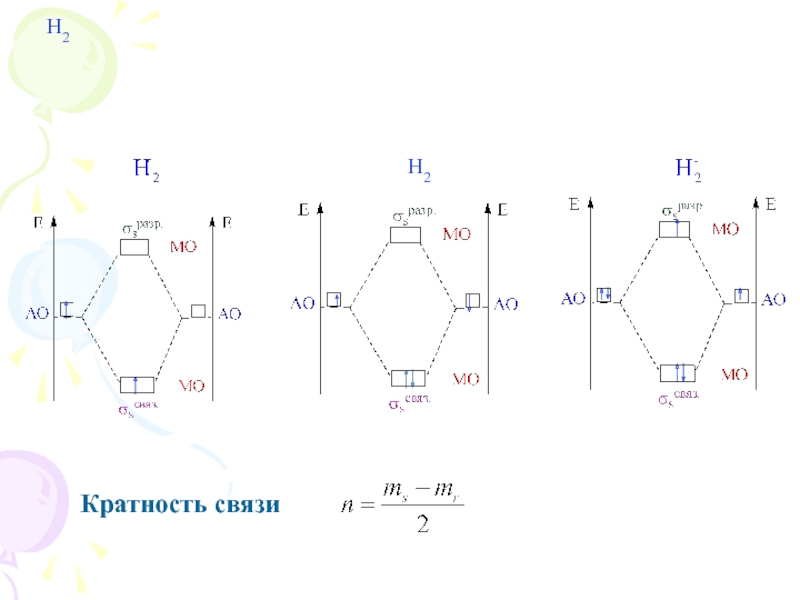
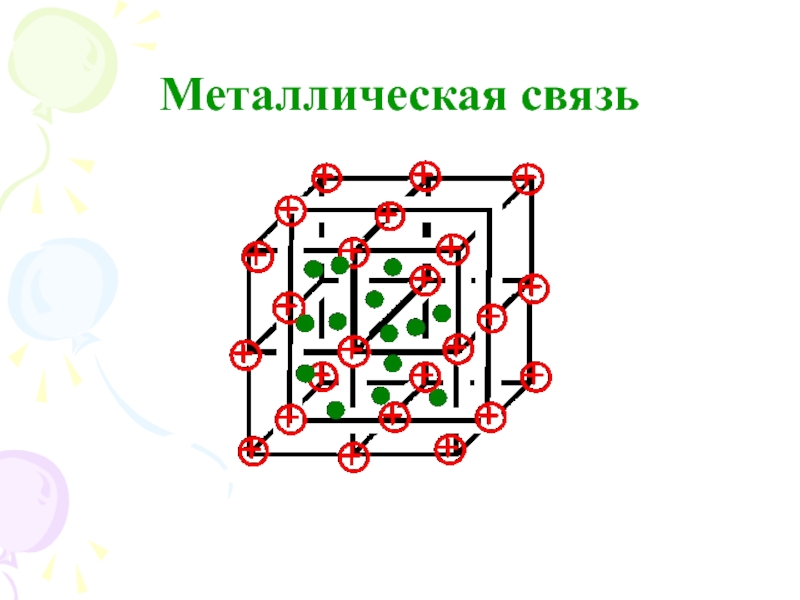
их стремление к энергетически устойчивому состоянию, характерному соответствующее формуле ns2np6.
Основные пути приобретения подобного строения внешнего электронного уровня:
1) отдача или присоединение электронов;
2) обобществление неспаренных электронов разных атомов.