Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
химическое равновесие и его термодинамическое обоснование
Содержание
- 1. химическое равновесие и его термодинамическое обоснование
- 2. Критерии равновесия Для химической реакции общего видаaA +
- 3. Достижение равновесия в обратимой реакцииВремяνIIIIIII − прямая реакцияII − обратная реакцияIII − состояние равновесия
- 4. Критерии равновесия Для постоянного давления и температуры: ΔH
- 5. Закон действующих массотношение произведения равновесных концентраций продуктов
- 6. Способы выражения констант равновесия
- 7. Уравнение изотермы химической реакции Для процесса в общем
- 8. Соотношение Пс и Кр
- 9. Принцип подвижного равновесия При изменении одного из условий
- 10. Уравнение изобары химической реакцииОграничение: ΔТ − должна быть небольшой.
- 11. Влияние давления на смещение равновесияΔn = (x
- 12. Расчёт теоретического выхода продукта реакцииРассмотрим превращение 1
- 13.
- 14. ЗаключениеВторой закон определяет направление реакции в изолированной
- 15. Спасибо за внимание
- 16. Скачать презентанцию
Критерии равновесия Для химической реакции общего видаaA + bB ↔ xX + yY состояние равновесия может быть описано и с точки зрения кинетики и с точки зрения термодинамики. С точки зрения термодинамики макроскопические
Слайды и текст этой презентации
Слайд 1ХИМИЧЕСКОЕ РАВНОВЕСИЕ И ЕГО ТЕРМОДИНАМИЧЕСКОЕ ОБОСНОВАНИЕ
Курс лекций по физической химии
Лектор:
проф. Иванова Надежда Семёновна
Слайд 2Критерии равновесия
Для химической реакции общего вида
aA + bB ↔ xX
+ yY
состояние равновесия может быть описано и с точки зрения
кинетики и с точки зрения термодинамики. С точки зрения термодинамики макроскопические системы достигают равновесия, когда изменение энергии компенсируется энтропийной составляющей.Слайд 3
Достижение равновесия в обратимой реакции
Время
ν
I
II
III
I − прямая реакция
II − обратная
реакция
III − состояние равновесия
Слайд 4Критерии равновесия
Для постоянного давления и температуры: ΔH = TΔS, тогда
Δ G = 0.
С точки зрения кинетики состояние равновесия характеризуется
величиной константы равновесия:(при Т=const)
Слайд 5Закон действующих масс
отношение произведения равновесных концентраций продуктов реакции, взятых в
степенях, равных их стехиометрическим коэффициентам, к такому же произведению концентраций
исходных веществ при данной постоянной температуре есть величина постоянная, называемая константой химического равновесия.Слайд 7Уравнение изотермы химической реакции
Для процесса в общем виде:
В положении равновесия
Якоб
Хендрик Вант-Гофф
(1852-1911)
ΔG = 0
Δ G° = −RTlnKр
Слайд 9Принцип подвижного равновесия
При изменении одного из условий химического равновесия оно
смещается в сторону той реакции, которая уменьшает произведённое изменение.
Принцип адаптивных
перестроекЛюбая живая система при воздействии на неё перестраивается так, чтобы уменьшить это воздействие.
Анри-Луи Ле Шателье
(1850-1936)
Слайд 11Влияние давления на смещение равновесия
Δn = (x + y) −
(a + b)
Δn − изменение числа моль газов в реакции
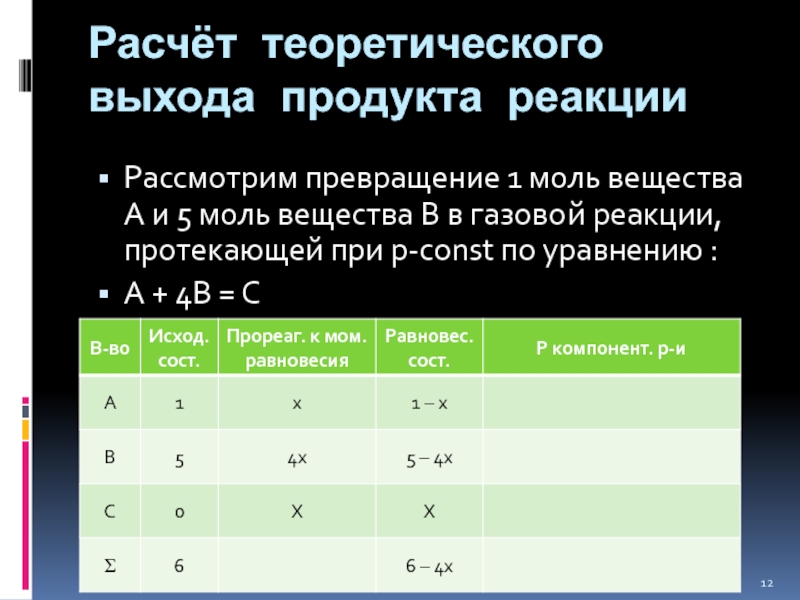
Слайд 12Расчёт теоретического выхода продукта реакции
Рассмотрим превращение 1 моль вещества А
и 5 моль вещества В в газово й реакции, протекающей при
р-const по уравнению :А + 4В = С
Слайд 14Заключение
Второй закон определяет направление реакции в изолированной системе, объединенный 1
и 2 закон – в закрытой системе.
Термодинамическим обоснованием принципа подвижного
равновесия являются уравнения изотермы и изобары.Второй закон используется для термодинамического обоснования процессов, протекающих в живом организме.