Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Загальні властивості металів. Метали ІА та ІІА груп періодичної системи
Содержание
- 1. Загальні властивості металів. Метали ІА та ІІА груп періодичної системи
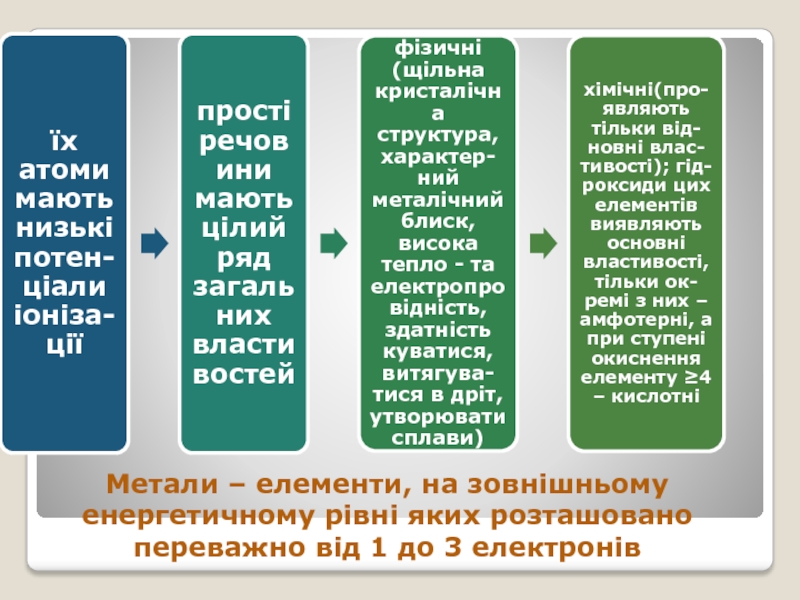
- 2. Метали – елементи, на зовнішньому енергетичному рівні яких розташовано переважно від 1 до 3 електронів
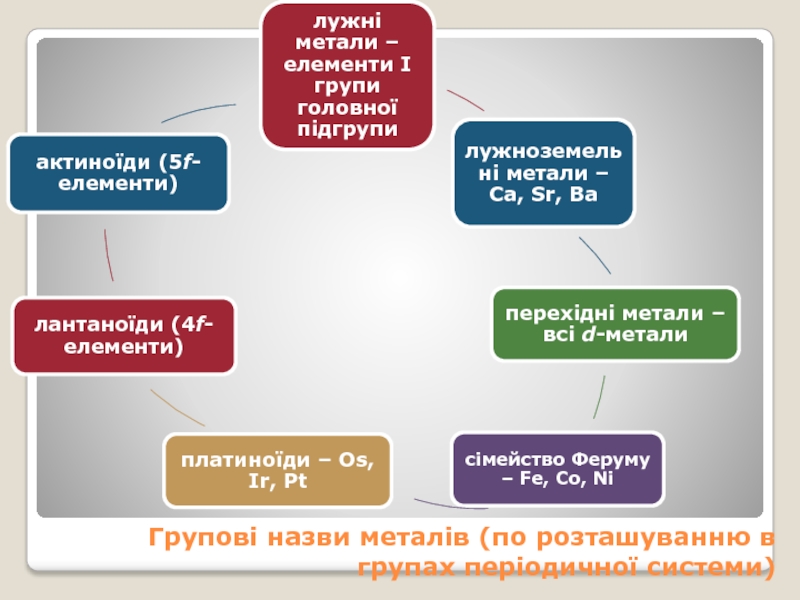
- 3. Групові назви металів (по розташуванню в групах періодичної системи)
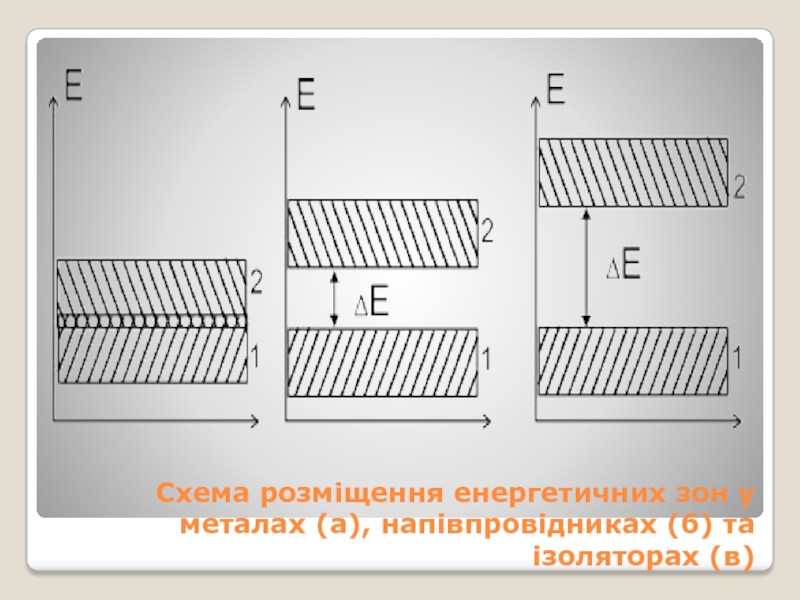
- 4. Схема розміщення енергетичних зон у металах (а), напівпровідниках (б) та ізоляторах (в)
- 5. Фізичні властивості металів
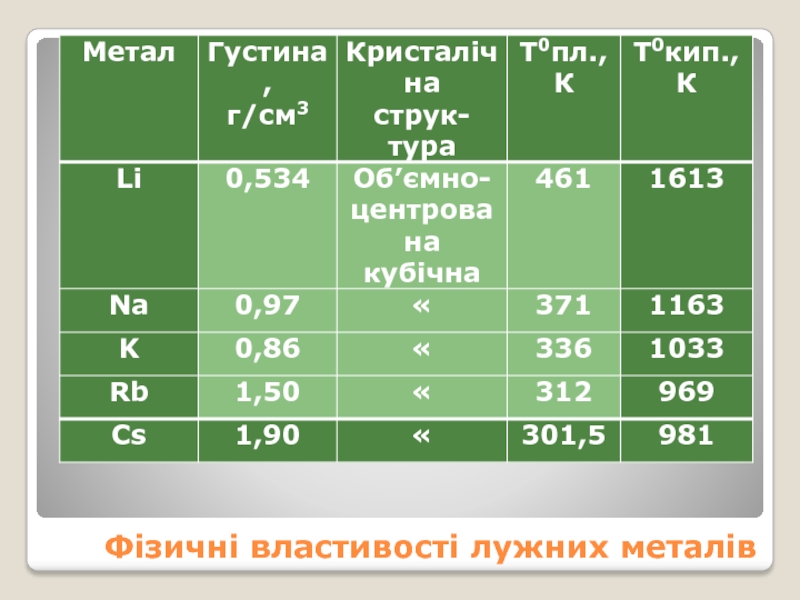
- 6. Фізичні властивості лужних металів
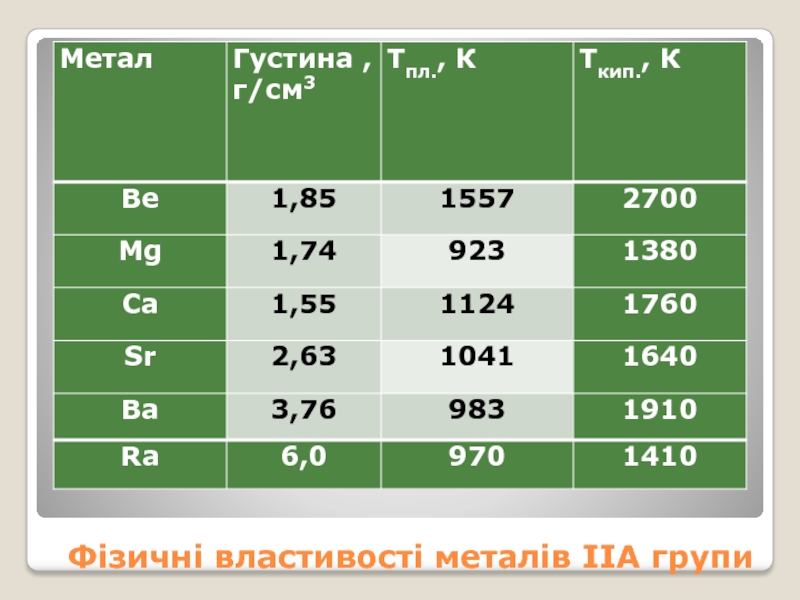
- 7. Фізичні властивості металів ІІА групи
- 8. Фізичні властивості елементів ІА та ІІА груп
- 9. Енергетичні характеристики лужних металів
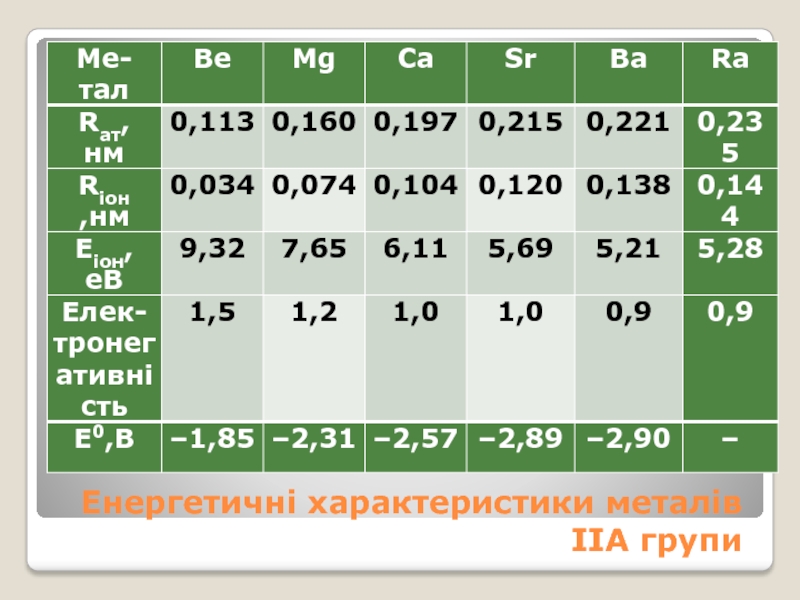
- 10. Енергетичні характеристики металів ІІА групи
- 11. Хімічні властивості
- 12. Хімічні властивості
- 13. Хімічні властивості
- 14. Слайд 14
- 15. Слайд 15
- 16. Хімічні властивості
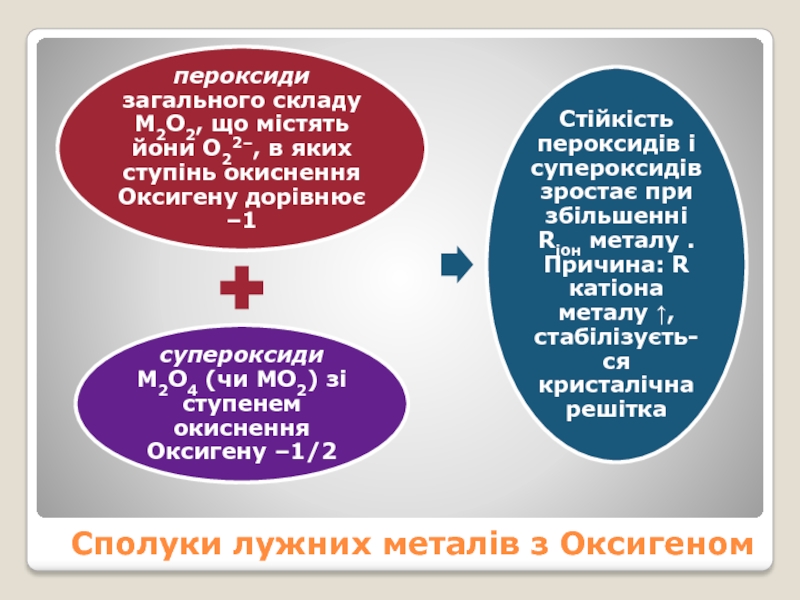
- 17. Сполуки лужних металів з Оксигеном
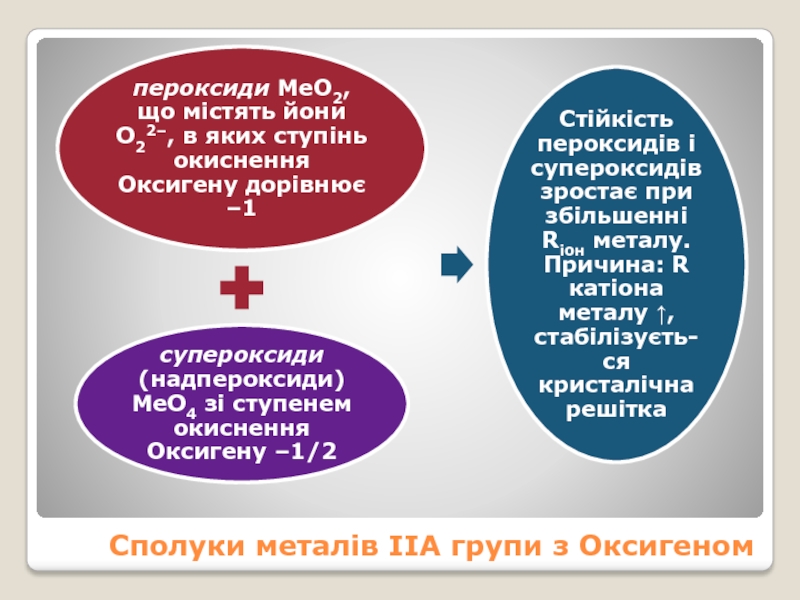
- 18. Сполуки металів ІІА групи з Оксигеном
- 19. Пероксиди лужних металівПероксиди лужних металів – солеподібні
- 20. Пероксиди металів ІІА групиПероксиди – білі тверді
- 21. Супероксиди s-металів Супероксиди лужних металів належать до
- 22. Озоніди лужних металівУ деяких випадках продуктами реакцій
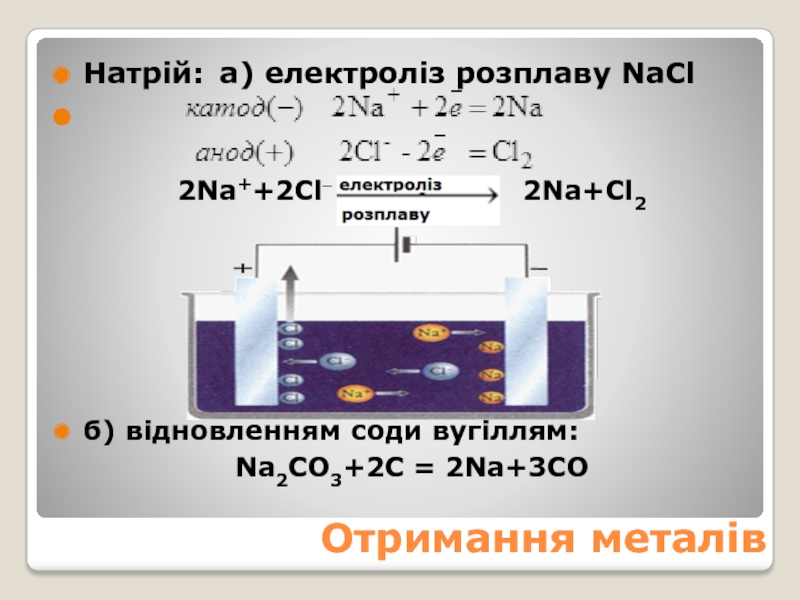
- 23. Отримання металів Натрій: а) електроліз розплаву NaCl
- 24. Отримання металівКалій: а) заміщенням його натрієм з розплаву
- 25. Отримання металівМетали ІІ групи: електролізом розплавів їх солей
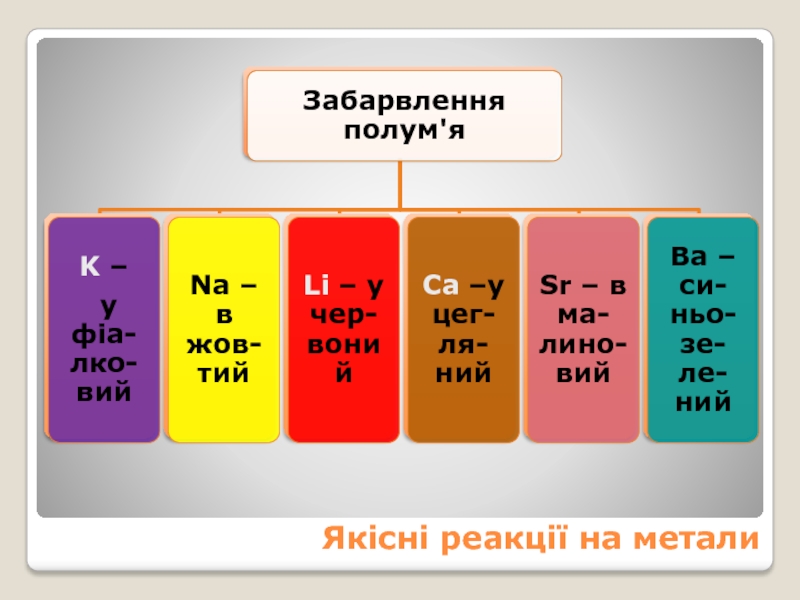
- 26. Якісні реакції на метали
- 27. Якісні реакції на металиЯкісна реакція на Mg
- 28. Твердість води
- 29. Твердість водиУсунення тимчасової твердості води:1. При кип’ятінні
- 30. Твердість водиУсунення постійної твердості води:При усуненні постійної
- 31. Твердість води4. При пом’якшенні великої кількості води
- 32. Скачать презентанцию
Метали – елементи, на зовнішньому енергетичному рівні яких розташовано переважно від 1 до 3 електронів
Слайды и текст этой презентации
Слайд 1Загальні властивості металів. Метали ІА та ІІА груп періодичної системи елементів
Д.І.Менделєєва
Слайд 2Метали – елементи, на зовнішньому енергетичному рівні яких розташовано переважно
від 1 до 3 електронів
Слайд 19Пероксиди лужних металів
Пероксиди лужних металів – солеподібні речовини, їх можна
розглядати як сіль надто слабкої кислоти Н2О2. При дії на
них холодною водою пероксиди піддаються швидкому гідролізуNa2O2 + 2H2O 2NaOH + Н2O2,
однак при дії гарячою водою чи при нагріванні пероксиди диспропорціонують за схемою:
2Na2O2 + 2H2O 4NaOH + O2.
Натрій пероксид – це жовтий кристалічний порошок (розкладається при тривалому зберіганні)
2Na2O2 2Na2O + O2.
Виступають в окисно-відновних реакція і окисниками, і відновниками:.
4Na2O2 + H2S + 2H2O 4Na2SO4 + 6NaOH
3Na2O2 + HIO3+ 3H2SO43Na2SO4+HI +O2+ 3H2O
Слайд 20Пероксиди металів ІІА групи
Пероксиди – білі тверді речовини, у присутності
води вони піддаються необоротному гідролізу:
СaО2 + 2H2O Ca(OH)2 +
H2O2.Барій пероксид використовується для одержання Гідроген пероксиду:
BaO2 + 2H2O Ba(OH)2 + H2O2,
BaO2 + H2SO4 BaSO4↓+ H2O2.
Слайд 21Супероксиди s-металів
Супероксиди лужних металів належать до сильніших окисників: в
них майже миттєво згоряє алюміній, а дерев'яні ошурки – при
незначному нагріванні.Вони реагують з водою з утворенням кисню і гідроген пероксиду
2КО2 +2Н2О 2КОН + Н2О2 + О2.
Cупероксиди елементів ІІА групи – речовини жовтого кольору, менш стійкі, ніж пероксиди, утворюються як побічний продукт при добуванні пероксидів.
Слайд 22Озоніди лужних металів
У деяких випадках продуктами реакцій за участю озону
та лужних металів є озоніди:
К + О3 = К О3
4КОН + 4О3 = 4КО3 + О2 + 2Н2О
Такі сполуки містять
молекулярний іон О3-. На відміну від О3 іон О3- вже має неспарений електрон, що обумовлює його парамагнетизм. Озоніди лужних металів мають червоний колір і є дуже сильними окисниками.
Слайд 23Отримання металів
Натрій: а) електроліз розплаву NaCl
2Na++2Cl–
2Na+Cl2
б) відновленням
соди вугіллям: Na2CO3+2C = 2Na+3CO
Слайд 24Отримання металів
Калій: а) заміщенням його натрієм з розплаву калій хлориду :
KCl+Na= K+NaCl
б) електролізом розплавів хлориду
Літій: а) електролізом розплаву хлориду
Рубідій, цезій: відновленням їх
галогенідів в вакуумі: 2RbCl+Ca = 2Rb+CaCl2 2CsCl+Ca = 2Cs+CaCl2
Слайд 25Отримання металів
Метали ІІ групи: електролізом розплавів їх солей або термічним відновленням
їх сполук активнішими металами чи вуглецем:
BaO+Ca CaO+Ba;
BeCl2+Mg MgCl2+Be;
3CaO+2Al 3Ca+Al2O3;
MgO+C MgO+CO
Слайд 27Якісні реакції на метали
Якісна реакція на Mg : утворення білого
осаду подвійної солі в реакції
MgSO4+Na2HPO4+NH4OH
MgNH4PO4+Na2SO4 + H2O, осад розкладається при прожарюванні:
2MgNH4PO4 Mg2P2O7 + 2NH3 + H2O.
Якісна реакція на Ва та Са: утворення осадів при дії сульфатної кислоти на їх солі:
Ba2++SO42- = BaSO4,
Ca2++SO42-+2H2O = CaSO42H2O.
Слайд 29Твердість води
Усунення тимчасової твердості води:
1. При кип’ятінні води розчинні гідрогенкарбонати
кальцію та магнію руйнуються і нерозчинні карбонати випадають в осад:
2Ca(HCO3)2 CaCO3 + H2O + CO2.
У промисловій водопідготовці даний спосіб не використовується як енергозатратний.
2. При додаванні до твердої води гашеного вапна Ca(OH)2 протікає його взаємодія з гідрогенкарбонатами, що призводить до випадання осаду карбонатів:
Ca(OH)2 + Ca(HCO3)2 2CaCO3 + 2H2O.
Слайд 30Твердість води
Усунення постійної твердості води:
При усуненні постійної твердості води усувається
і тимчасова.
1. Тимчасова твердість усувається повністю і частково постійна при
обробці води каустичною содою NaOH: 2NaOH + Ca(HCO3)2 CaCO3 + Na2CO3 + 2H2O,
Карбонат натрію зв’язує частину іонів магнію:
Na2CO3 + MgSO4 MgCO3 + Na2SO4.
2. При обробці води сумішшю соди з каустичною содою твердість води усувається повністю.
3. Більш ефективно діє як пом’якшуючий засіб натрій фосфат, який додають у пральні порошки:
3MgSO4 + 2Na3PO4 Mg3(PO4)2 + 3Na2SO4.
Слайд 31Твердість води
4. При пом’якшенні великої кількості води у промисловості користуються
іонообмінними смолами.
Іонообмінні смоли – полімери, до складу молекул яких
входять функціональні групи, здатні утримувати катіони (катіоніти) або аніони (аніоніти). Використовують для пом’якшення води катіоніти, переважно сульфовугілля (катіоніт КУ-1). При пропусканні твердої води через колонку, заповнену натрієвою сіллю катіоніту, іони кальцію та магнію реагують з катіонітом і утримуються його функціональними групами, заміщуючи натрій.