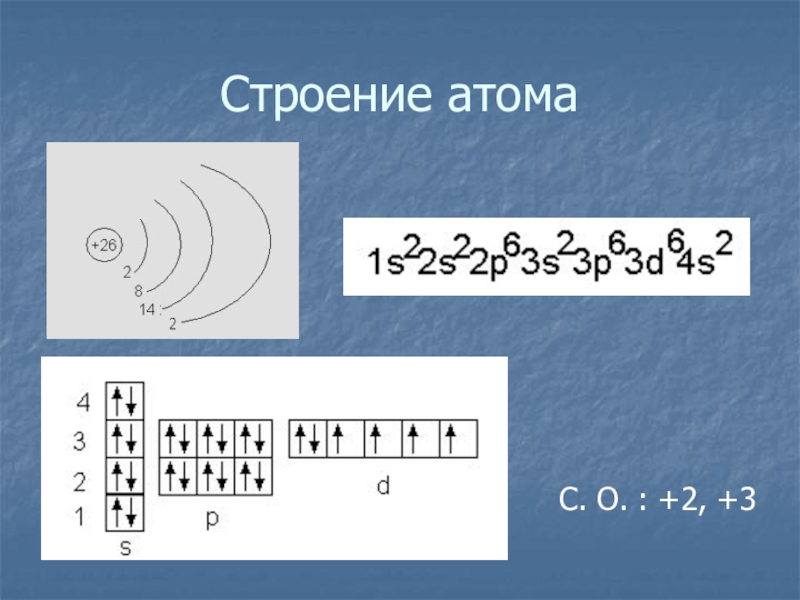
и строению атома(самостоятельно)
Нахождение в природе
Способы получения железа
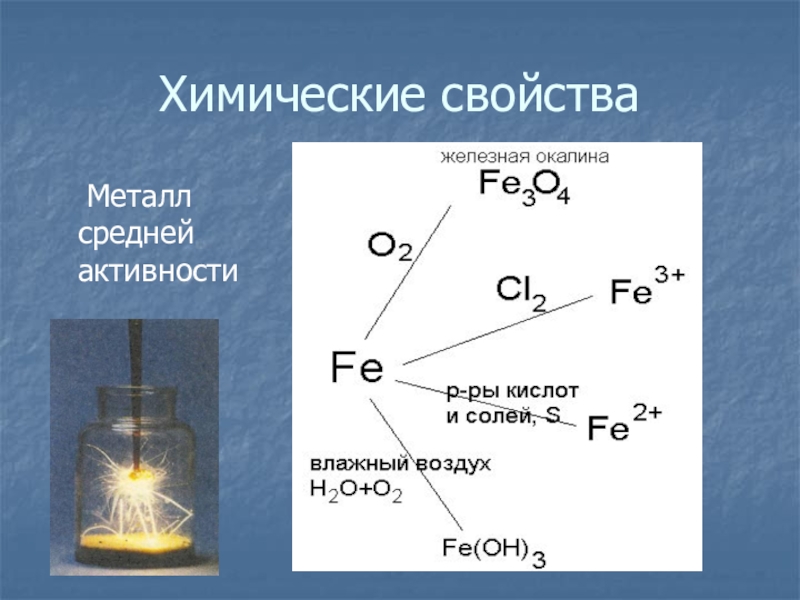
Физические и химические
свойстваПрименение. Биологическая роль железа