Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аллотропия кислорода.
Содержание
- 1. Аллотропия кислорода.
- 2. Оглавление Аллотропия.Аллотропные модификации кислорода.История открытия кислорода и
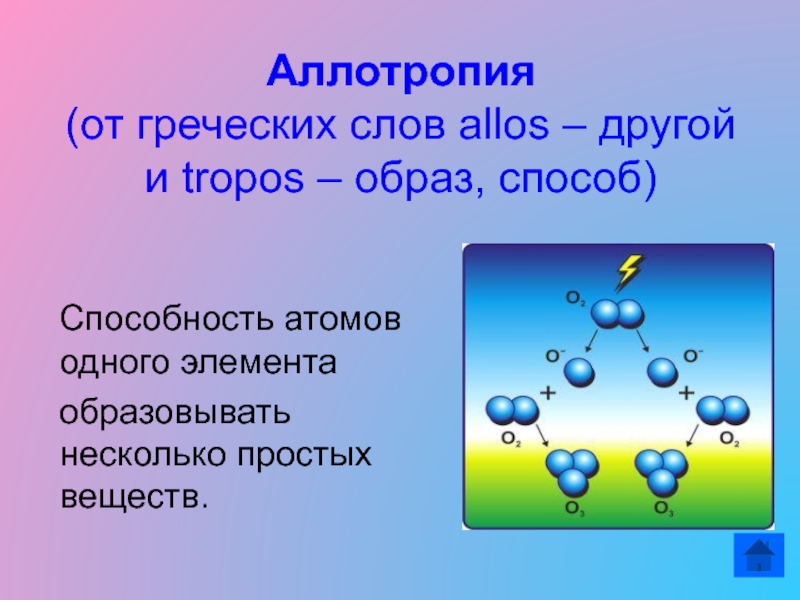
- 3. Аллотропия (от греческих слов allos – другой
- 4. Аллотропные модификации кислорода.
- 5. 1772 год. Карл Вильгельм
- 6. 1774 год. Джозеф Пристли, изучая состав воздуха,
- 7. Впервые количественный состав воздуха установил французский ученый
- 8. Впервые озон обнаружил в 1785 голландский физик
- 9. ( 1799 – 1868 )Кристиан Фридрих ШёнбейТермин
- 10. Нахождение в природе.
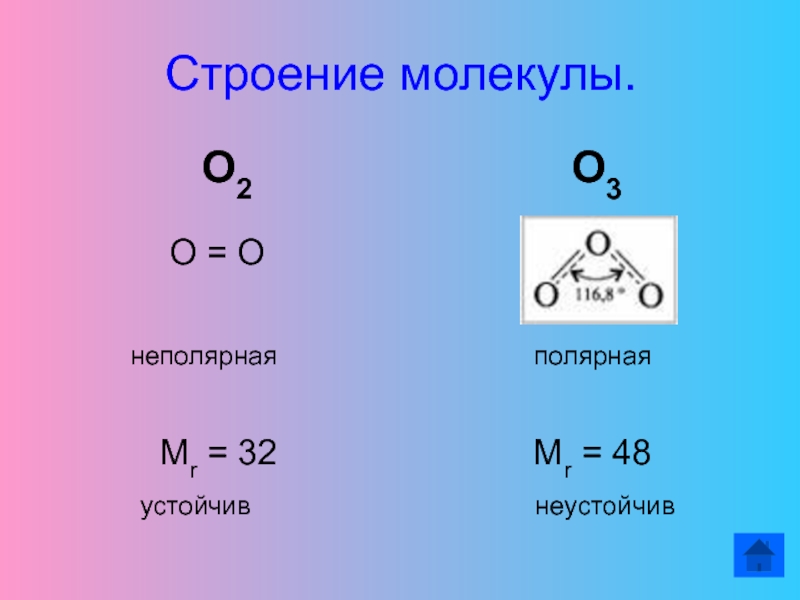
- 11. Строение молекулы.
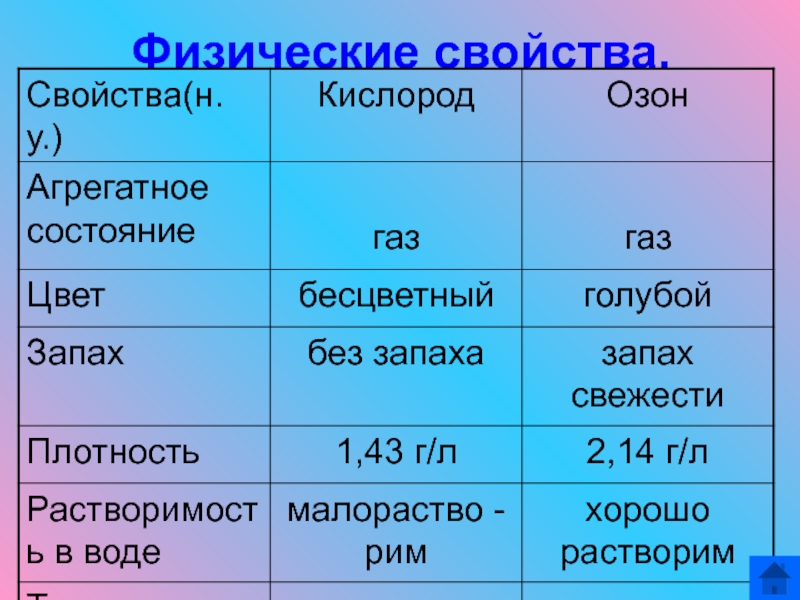
- 12. Физические свойства.
- 13. Химические свойства О2 Сильный окислитель, но не
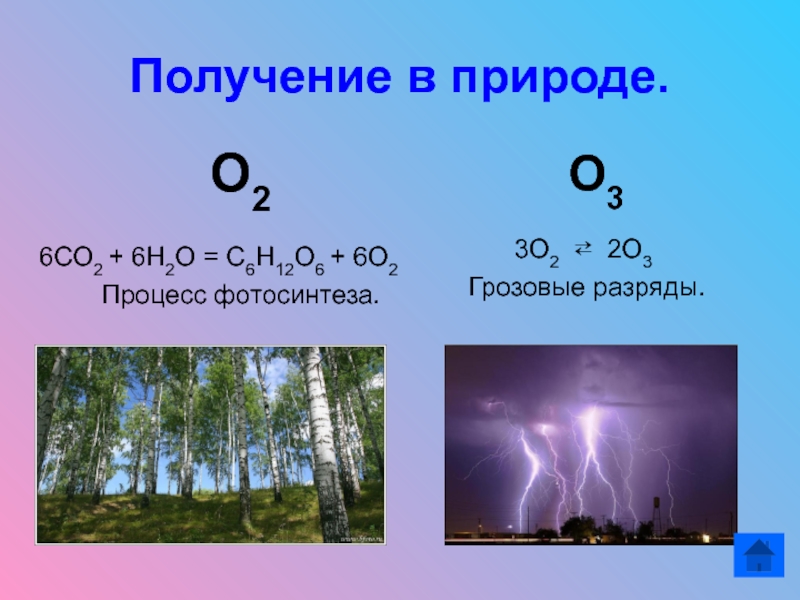
- 14. Получение в природе.
- 15. Значение кислорода и озона в природе.
- 16. Проверь себя!1. Что такое аллотропия?2. Назовите фамилии
- 17. Литература, интернет-ресурсы.О.С.Габриелян « Химия. 9 кл.»
- 18. Спасибоза внимание!
- 19. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Оглавление
Аллотропия.
Аллотропные модификации кислорода.
История открытия кислорода и озона.
Нахождение в природе.
Строение молекулы.
Физические
свойства.
Химические свойства.
Получение в природе.
Значение кислорода и озона в природе.
Проверь себя.
Литература.
Слайд 3Аллотропия (от греческих слов allos – другой и tropos – образ,
способ)
Способность атомов одного элемента
образовывать несколько простых
веществ. Слайд 4Аллотропные модификации кислорода.
О2
кислород(простое вещество)
К. В. Шееле 1772 г.
Дж. Пристли 1774 г.
А. Лавуазье 1777г.
«рождающий кислоты»
О3
озон
(простое вещество)
Х. Ф. Шёнбейн 1839 г.
«пахнущий»
Слайд 5 1772 год. Карл Вильгельм Шееле (шведский учёный)
хотел раскрыть загадку огня и при этом неожиданно обнаружил, что
воздух — не элемент, а смесь двух газов, которые он называл воздухом «огненным».
Однако приоритет открытия кислорода принадлежит Джозефу Пристли, который описал его в 1774 г. независимо от Шееле.
(1742–1786)
В 1777 г. был опубликован труд Шееле «Химический трактат о воздухе и огне».
Слайд 61774 год. Джозеф Пристли, изучая состав воздуха, пытался выяснить, какие
его составляющие могут выделиться из химических веществ при их нагревании.
Нагревая оксид ртути (II), он получил газ и назвал его «дефлогистированным воздухом». Исследуя свойства полученного газа, Пристли обнаружил, что зажженная свеча горела в нем ослепительно ярко и что он поддерживает дыхание.(1733-1804)
Прибор для получения кислорода ( Д.Пристли )
Позднее А.Лавуазье назвал этот газ кислородом.
Слайд 7Впервые количественный состав воздуха установил французский ученый
Антуан Лоран Лавуазье ( 1775 г. )
По результатам своего известного 12-дневного опыта он сделал вывод, что весь воздух в целом состоит из кислорода, пригодного для дыхания и горения, и азота, неживого газа, в пропорциях 1/5 и 4/5 объема соответственно. Ученый предложил «жизненный воздух» переименовать в «кислород», поскольку при сгорании в кислороде большинство веществ превращается в кислоты, а «удушливый воздух» – в «азот», т.к. он не поддерживает жизнь, вредит жизни.( 1743-1794 )
Опыт Лавуазье
Слайд 8Впервые озон обнаружил в 1785 голландский физик М. ван Марум
по характерному запаху (свежести) и окислительным свойствам, которые приобретает воздух
после пропускания через него электрических искр. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».Слайд 9( 1799 – 1868 )
Кристиан Фридрих Шёнбей
Термин озон предложен
немецким химиком
X.Ф. Шёнбейном в 1840 г., вошёл в словари в конце 19-ого века. Многие источники именно ему отдают приоритет открытия озона в 1839 г.Слайд 10Нахождение в природе.
О2
Воздух – 21% по объёму
23% по массе. О3
Атмосфера (верхний слой) – озоновый экран Земли.
Слайд 13Химические свойства
О2
Сильный окислитель, но не окисляет Au и
Pt, окисляет многие металлы, образуя оксиды.
2Cu
+ O2 = 2CuOВзаимодействует со всеми неметаллами, кроме галогенов, за исключением F
S+ O2 = SO2
Горение сложных веществ:
2H2S + 3O2 = 2H2O + 2SO2
О3
Очень сильный окислитель, более реакционноспособнее, чем двухатомный кислород.
Окисляет почти все металлы (за исключением золота, платины и иридия).
2Ag + O3 = Ag2O + O2
(комнатная температура)
Окисляет многие неметаллы.
C + 2O3 = CO2+ 2O2
Окисление сложных веществ
2KI + O3 + H2O = 2KOH + I2 +O2
Слайд 14Получение в природе.
О2
6СО2 + 6Н2О = С6Н12О6 + 6О2
Процесс фотосинтеза. О3
3О2 ⇄ 2О3
Грозовые разряды.
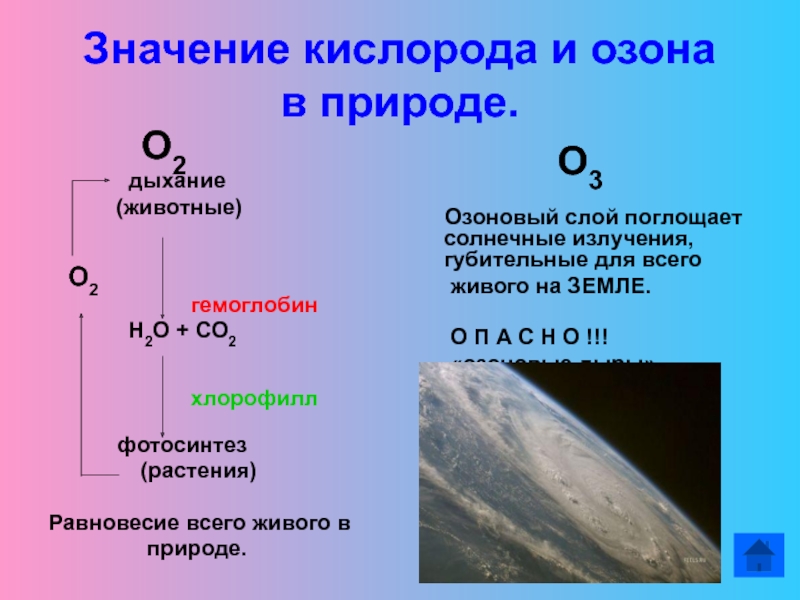
Слайд 15Значение кислорода и озона
в природе.
О2
дыхание(животные)
О2
гемоглобин
Н2О + СО2
хлорофилл
фотосинтез
(растения)
Равновесие всего живого в
природе.
О3
Озоновый слой поглощает солнечные излучения, губительные для всего
живого на ЗЕМЛЕ.
О П А С Н О !!!
«озоновые дыры»
Слайд 16Проверь себя!
1. Что такое аллотропия?
2. Назовите фамилии трех ученых, открывших
кислород.
3. В результате какого процесса в природе образуется кислород?
4.
Какая химическая реакция происходит при грозовых разрядах?5. Газ, образующий защитную оболочку Земли.
6. В чём одна из причин многообразия веществ?
Слайд 17Литература, интернет-ресурсы.
О.С.Габриелян « Химия. 9 кл.»
М. Дрофа, 2010
г..Ю.М.Малиновская «Химия. 6 кл.» (пропедевтический курс) С-Пб ТОО фирма Икар, 1999г.
Н.Г.Назина «Введение в химию» С-Пб, изд-во НИИХ С-ПбГУ, 2006г.
http://www.newsland.ru/
http//www.alhimik.ru/
http://www.xumuk.ru/spravochnik/