Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Амины (органические производные аммиака)
Содержание
- 1. Амины (органические производные аммиака)
- 2. Амины (органические производные аммиака)
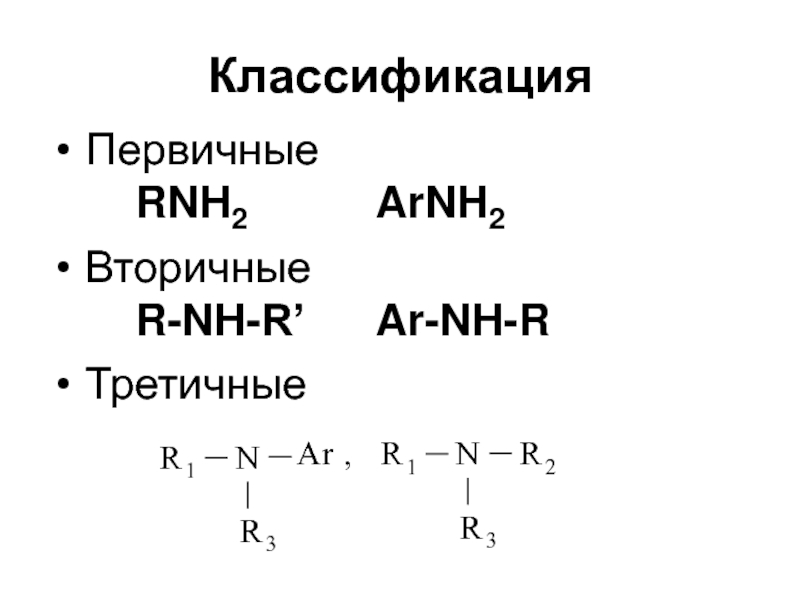
- 3. КлассификацияПервичные RNH2 ArNH2 Вторичные R-NH-R’ Ar-NH-R Третичные
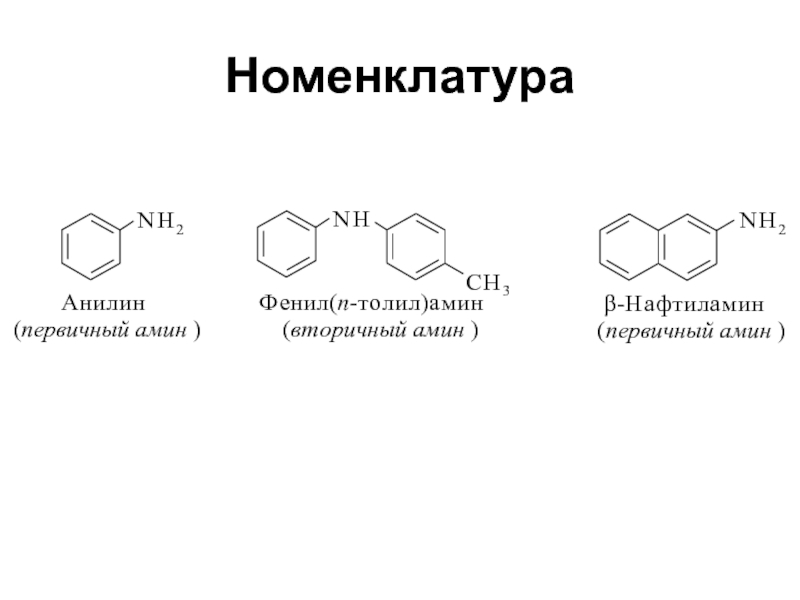
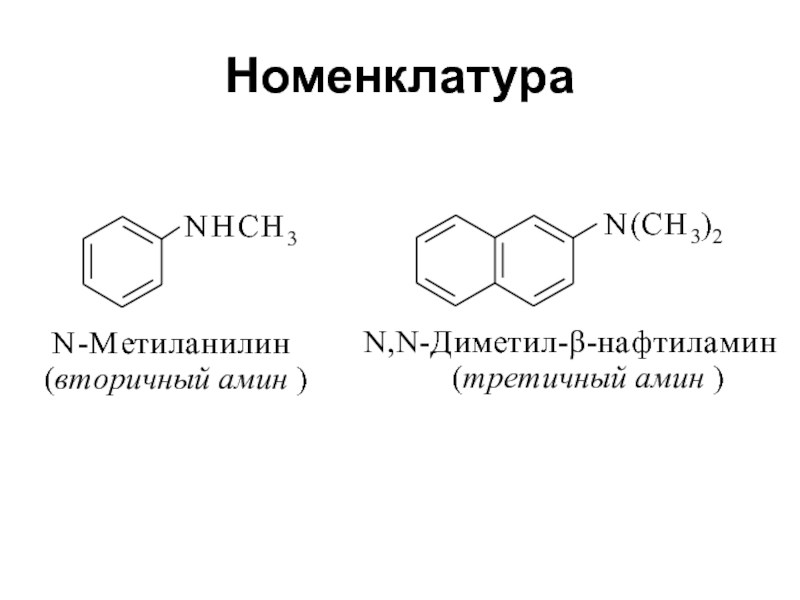
- 4. Номенклатура
- 5. Номенклатура
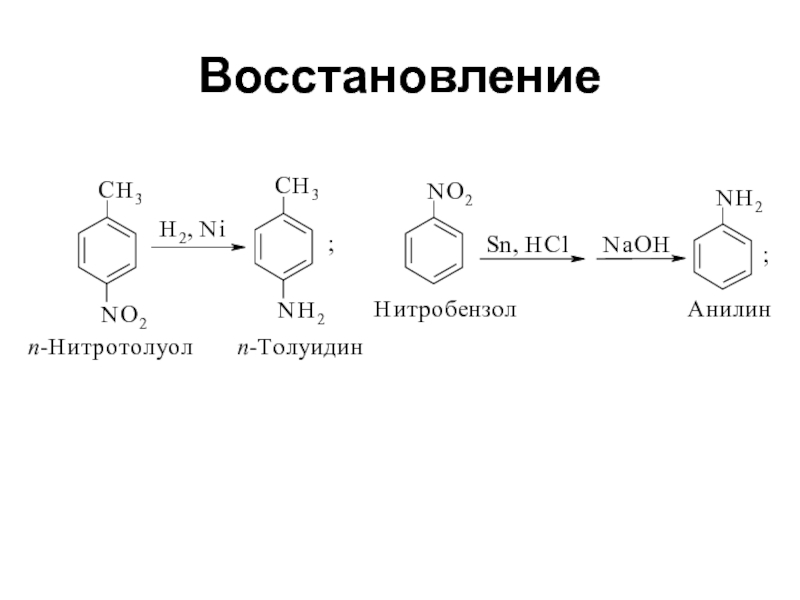
- 6. Получение
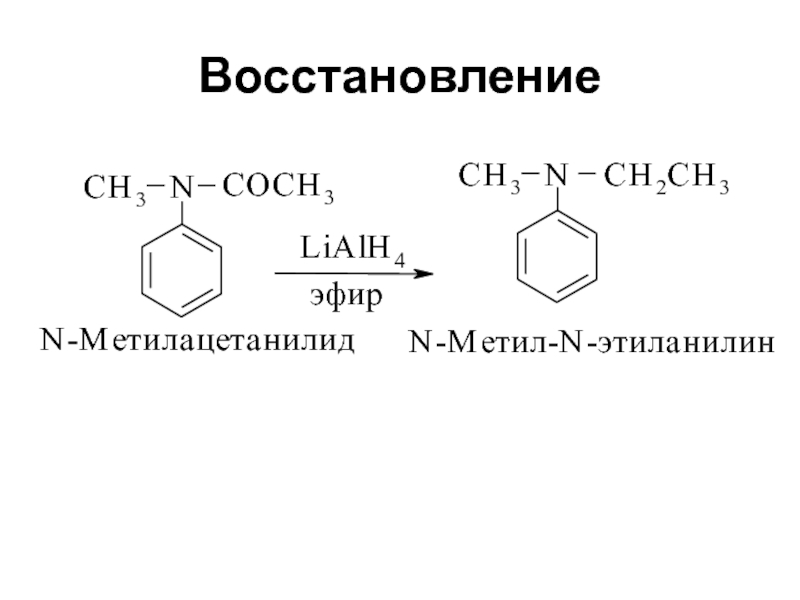
- 7. Восстановление
- 8. Восстановление
- 9. Восстановительное аминирование
- 10. Аминолиз спиртов
- 11. Расщепление амидов по Гофману (укорачивание цепи)ArСОNH2 +
- 12. Физические свойстваАроматические амины – жидкости или твердые
- 13. Химические свойстваАмины являются основаниямиАмины способны выступать в качестве нуклеофильных реагентов
- 14. Основность аминов ArNH2 + H2O → ArNH3+
- 15. Основность В + Н2О → НВ+ +
- 16. Основность аминов Ароматические амины менее основны чем алифатические
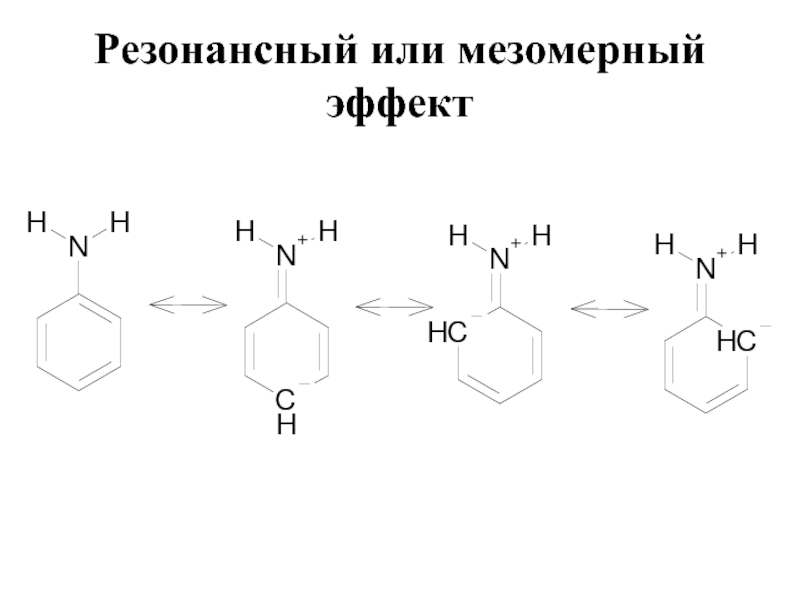
- 17. Резонансный или мезомерный эффект
- 18. Основность (pKBH+) NH3 9.21 CH3NH2 10.62 C2H5NH2 10.63(CH3)2NH 10.71 (C2H5)2NH 10.98(CH3)3N 9.76 (C2H5)3N 10.65PhNH2 4.58PhNHCH3 4.85 PhN(CH3)2 5.06
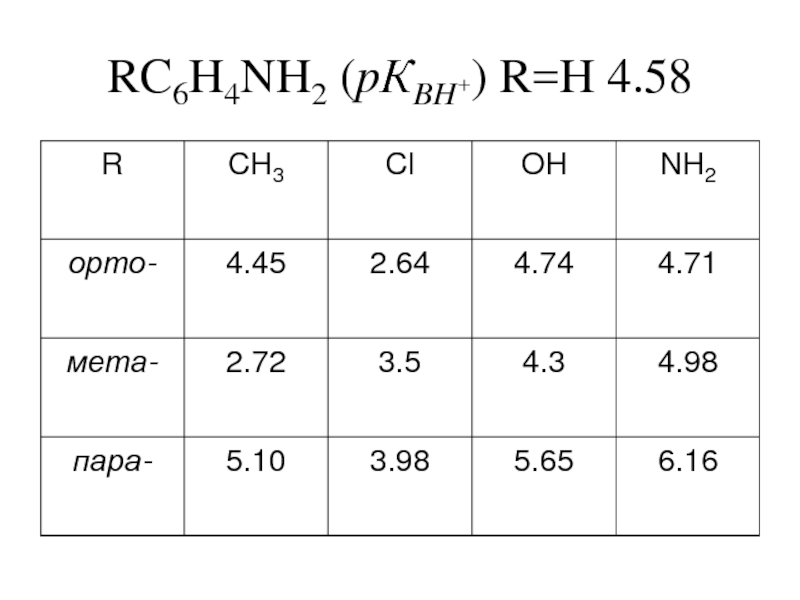
- 19. Влияние заместителей на основность ароматических аминов
- 20. RC6H4NH2 (pКBH+) R=H 4.58
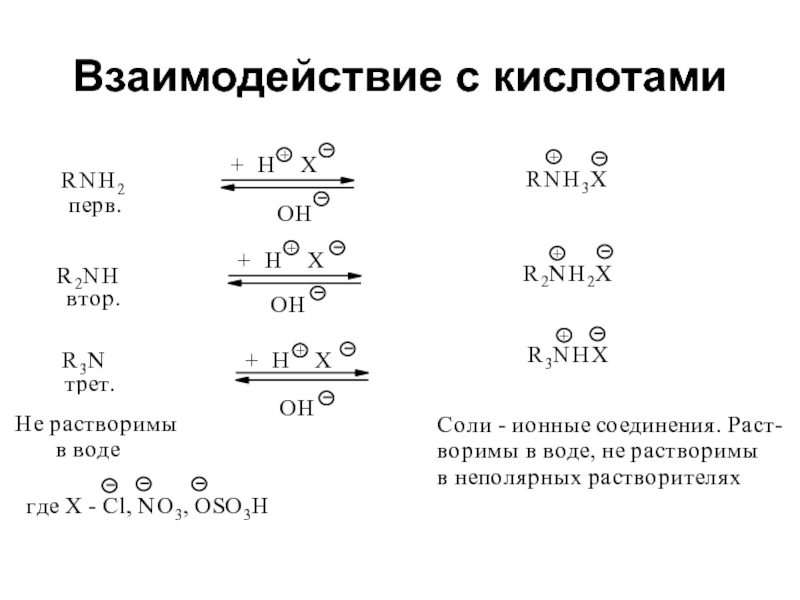
- 21. Взаимодействие с кислотами
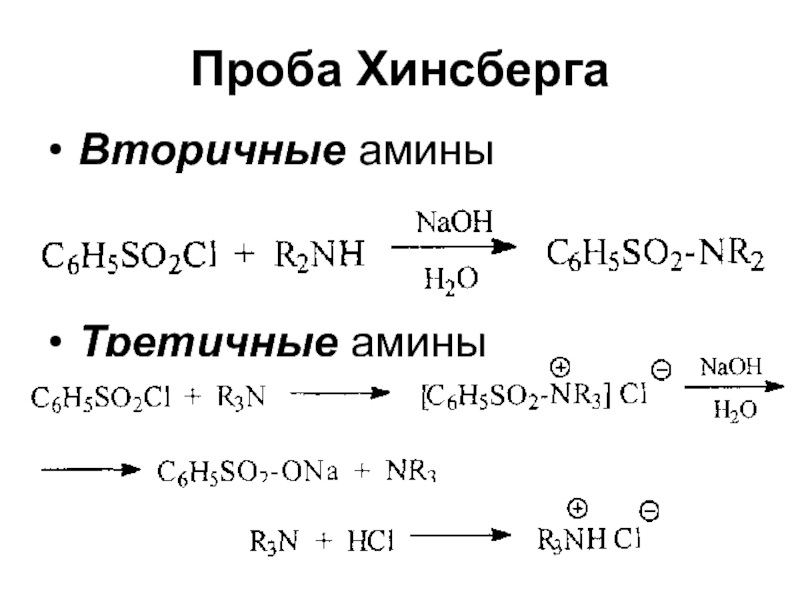
- 22. Проба ХинсбергаПервичные амины
- 23. Проба ХинсбергаВторичные аминыТретичные амины
- 24. Ароматические амины Первичные при взаимодействии с азотистой
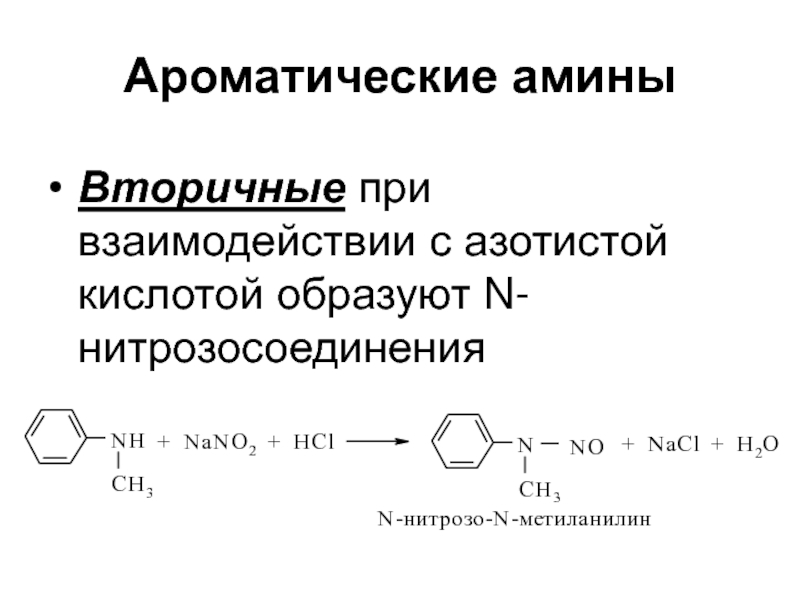
- 25. Ароматические амины Вторичные при взаимодействии с азотистой кислотой образуют N-нитрозосоединения
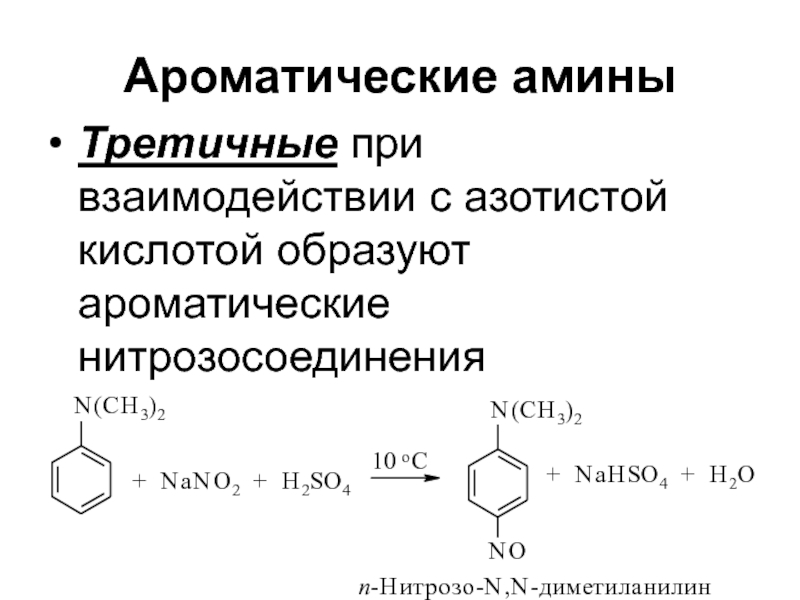
- 26. Ароматические аминыТретичные при взаимодействии с азотистой кислотой образуют ароматические нитрозосоединения
- 27. Ароматические амины
- 28. Слайд 28
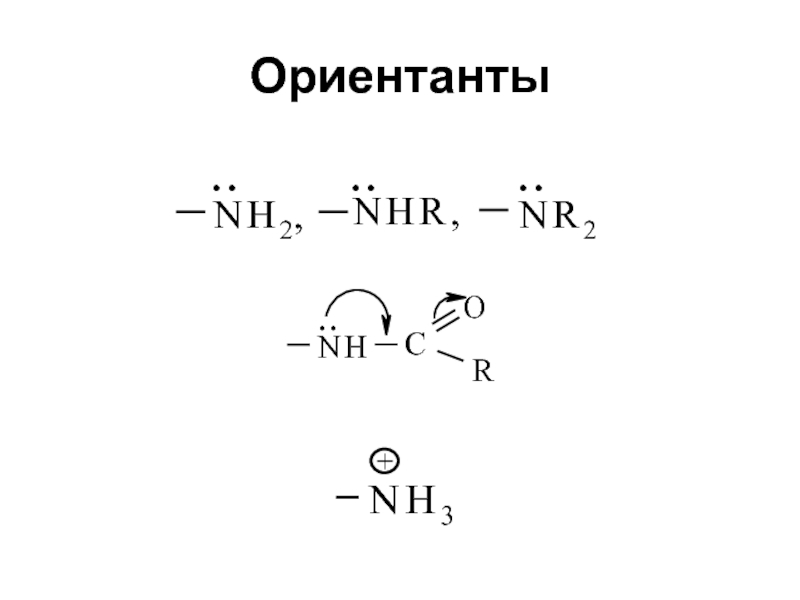
- 29. Замещение в кольце ароматических аминов
- 30. Ориентанты
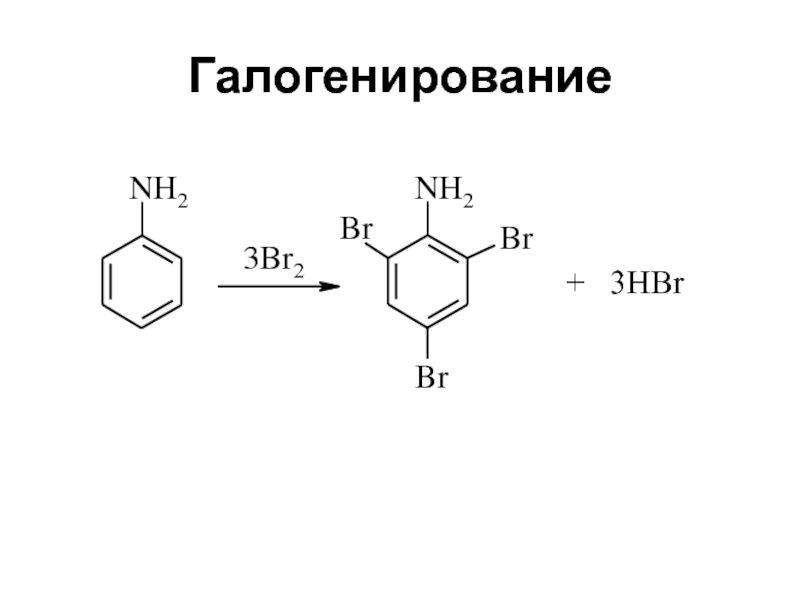
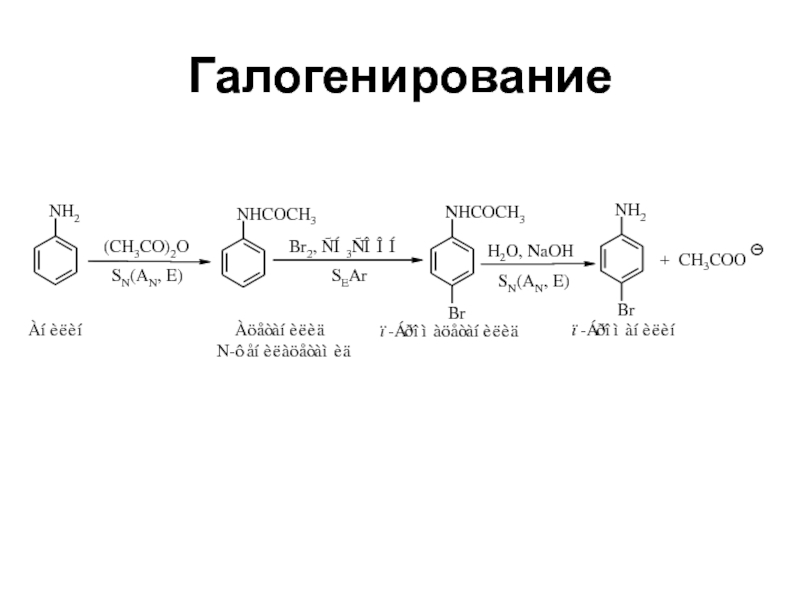
- 31. Галогенирование
- 32. Галогенирование
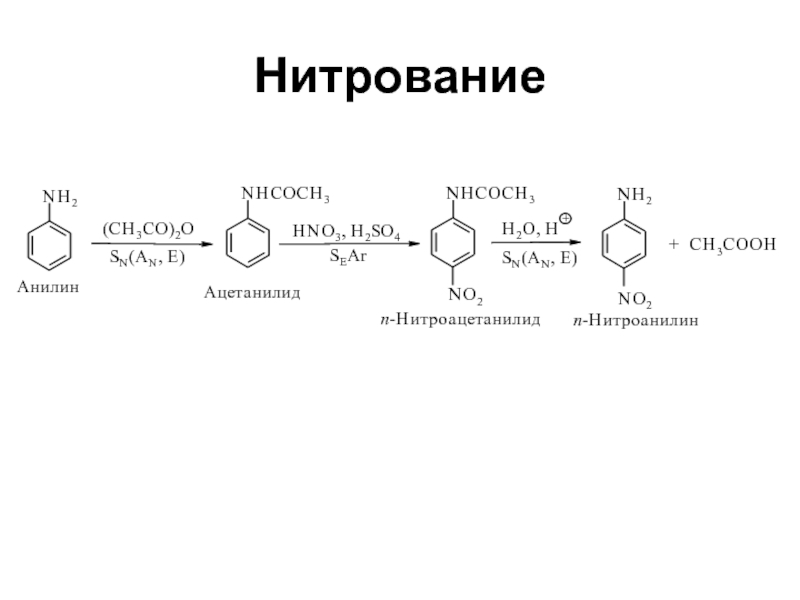
- 33. Нитрование
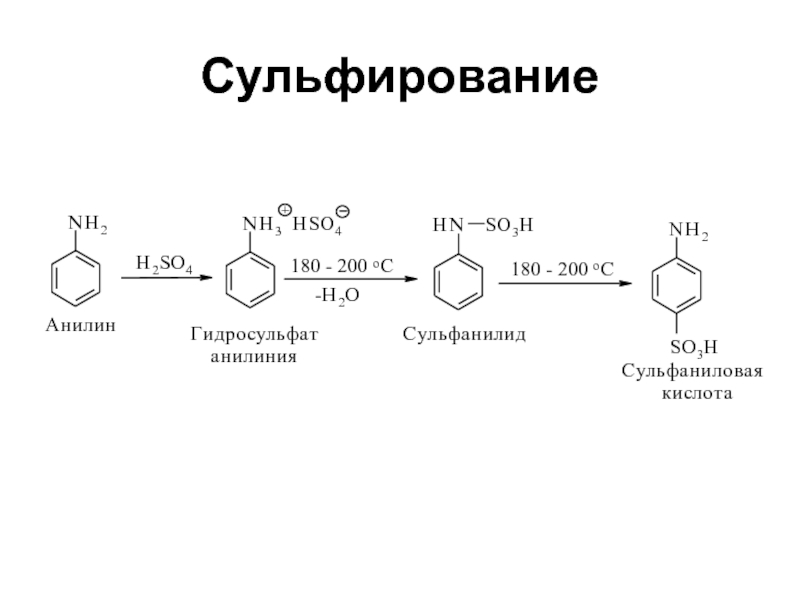
- 34. Сульфирование
- 35. Сульфаниламиды
- 36. Диазосоединения Соли диазония
- 37. ДиазосоединенияВ которых группа –N2– связана с углеводородным
- 38. Получение
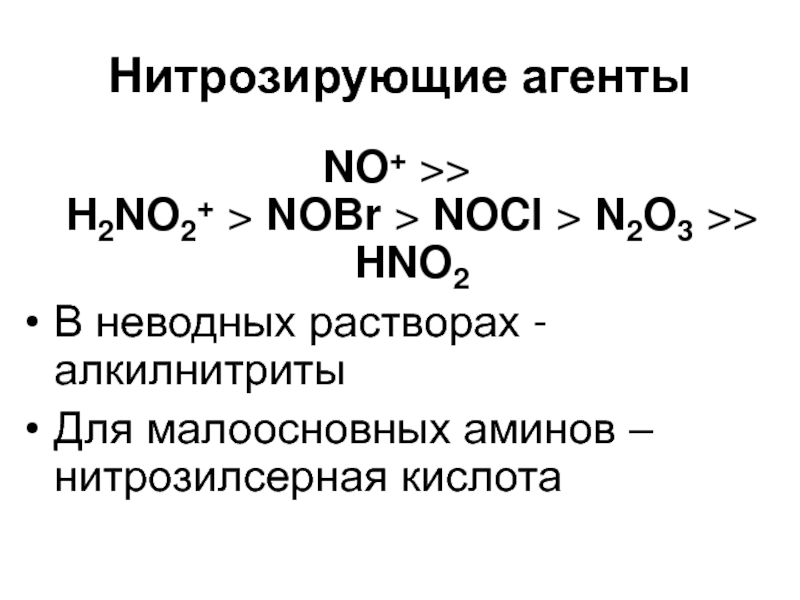
- 39. Нитрозирующие агентыNO+ >> H2NO2+ > NOBr
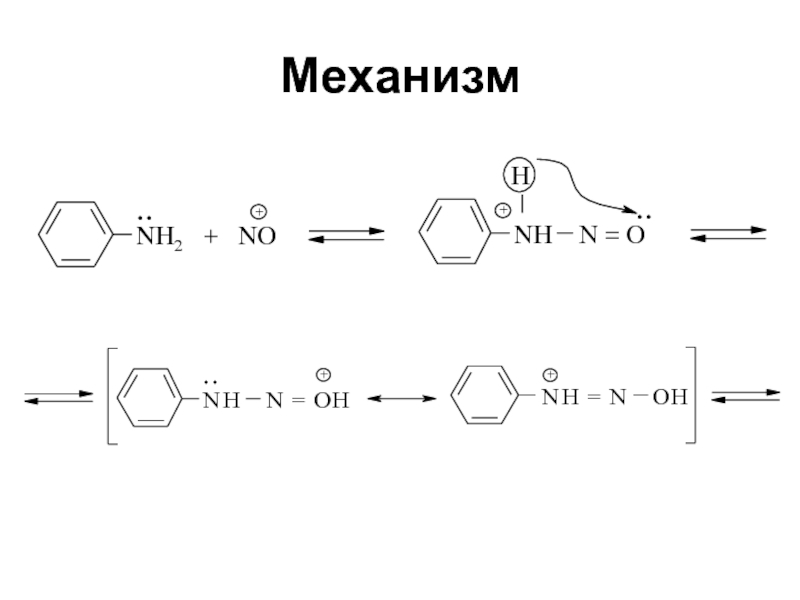
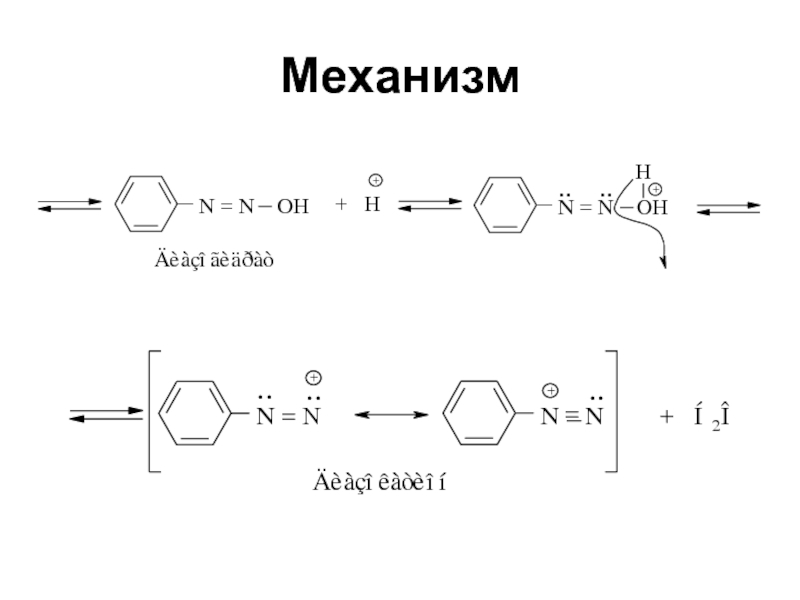
- 40. Механизм
- 41. Механизм
- 42. Формы диазосоединений
- 43. Свойства солей диазония
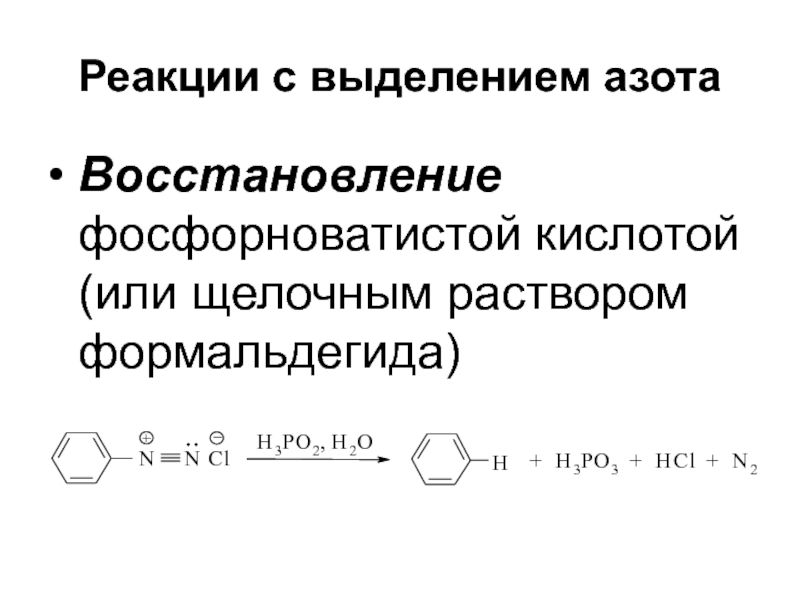
- 44. Реакции с выделением азота Восстановление фосфорноватистой кислотой (или щелочным раствором формальдегида)
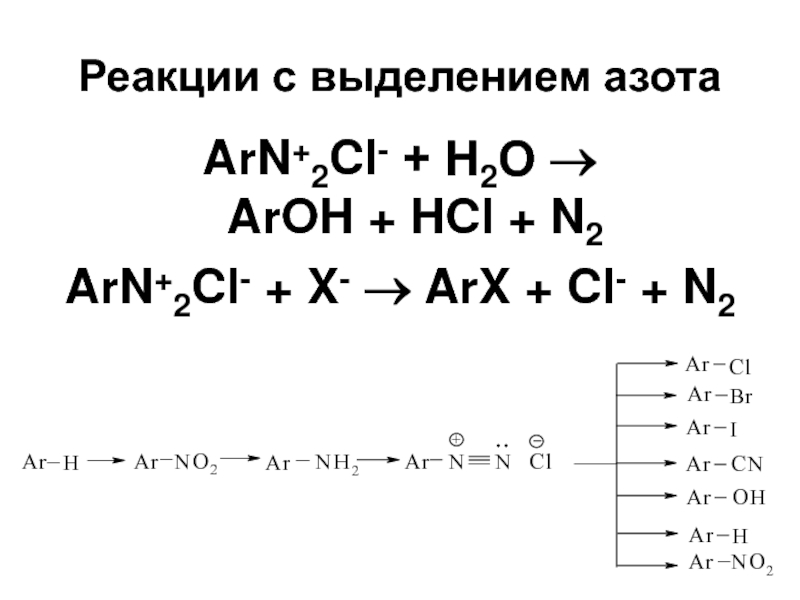
- 45. Реакции с выделением азота ArN+2Cl- + Н2О
- 46. SN1Ar ArN2+ → N2 +
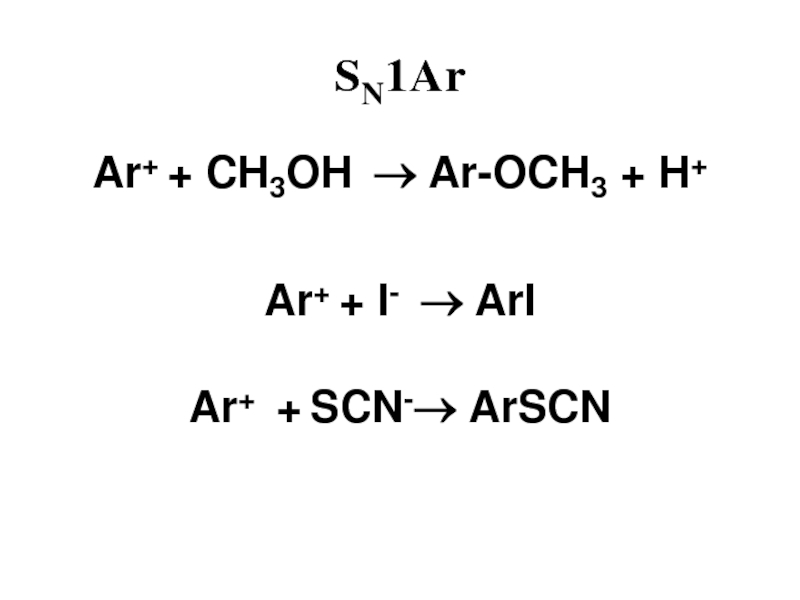
- 47. SN1Ar Ar+ + CH3OH → Ar-OCH3 + H+Ar+ + I- → ArIAr+ + SCN-→ ArSCN
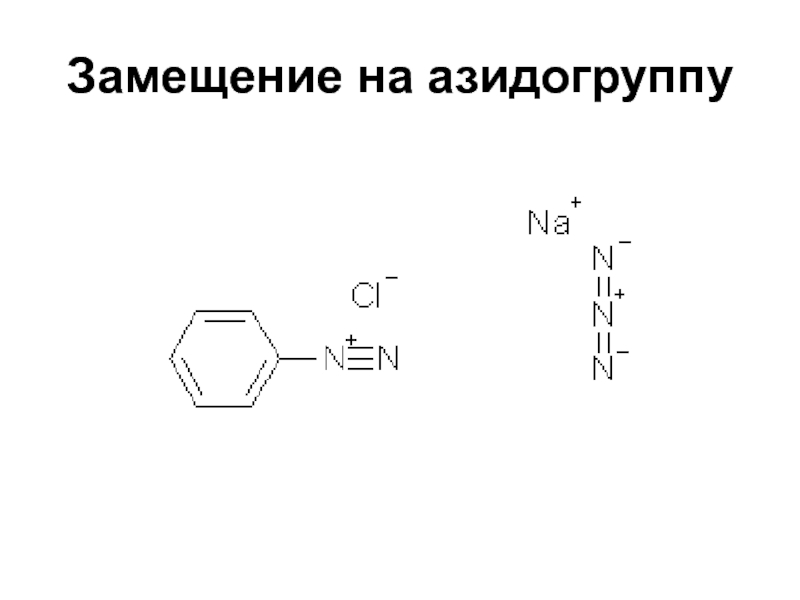
- 48. Замещение на азидогруппу
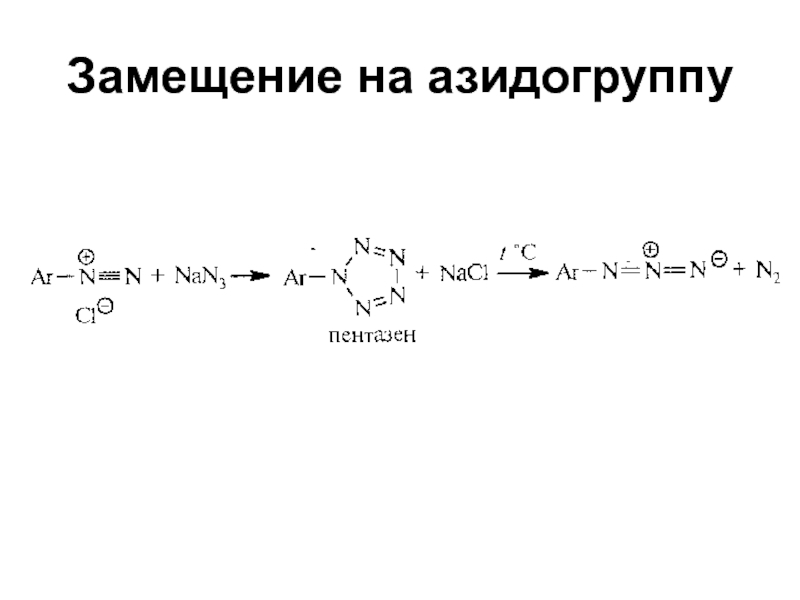
- 49. Замещение на азидогруппу
- 50. SN1Ar1) Скорость не зависит от [Nu]2) Влияние
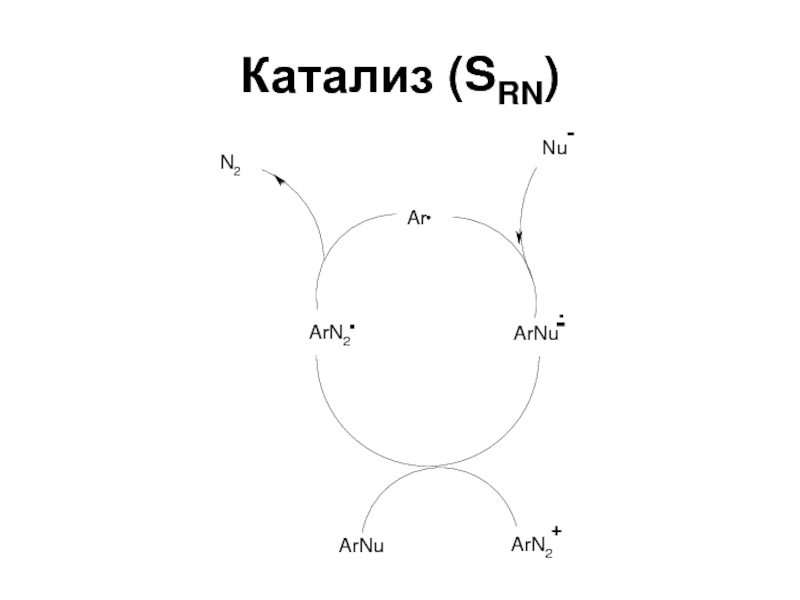
- 51. Катализ (SRN)
- 52. Реакции замещения на галоген Реакции с использованием
- 53. Реакции замещения на галоген
- 54. Реакции замещения на галогенЗамещение диазогруппы на I
- 55. Реакции замещения на тиоционат
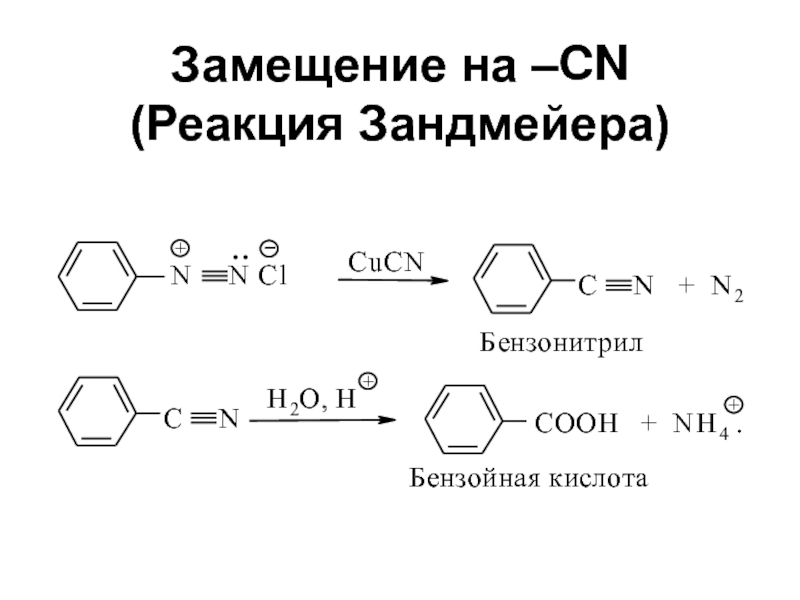
- 56. Замещение на –CN (Реакция Зандмейера)
- 57. Замещение на -ОНРеакция медленно протекает даже в
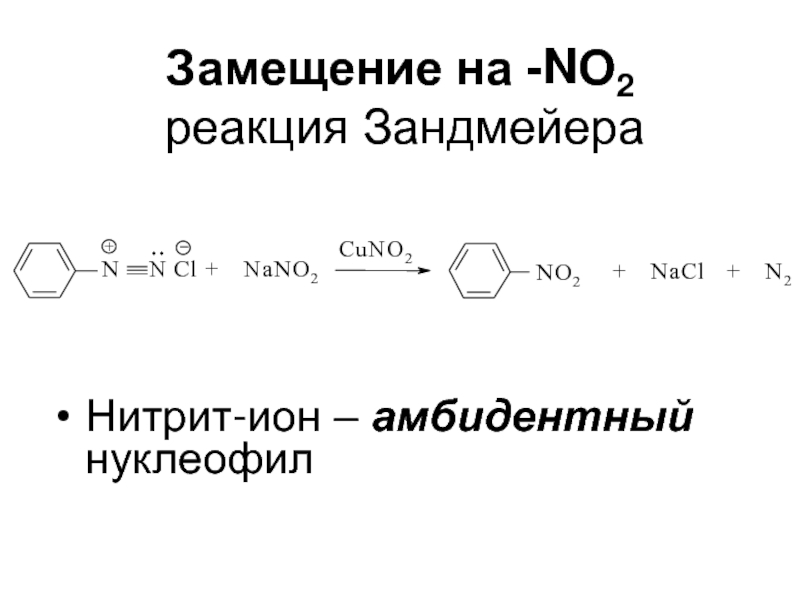
- 58. Замещение на -NО2 реакция ЗандмейераНитрит-ион – амбидентный нуклеофил
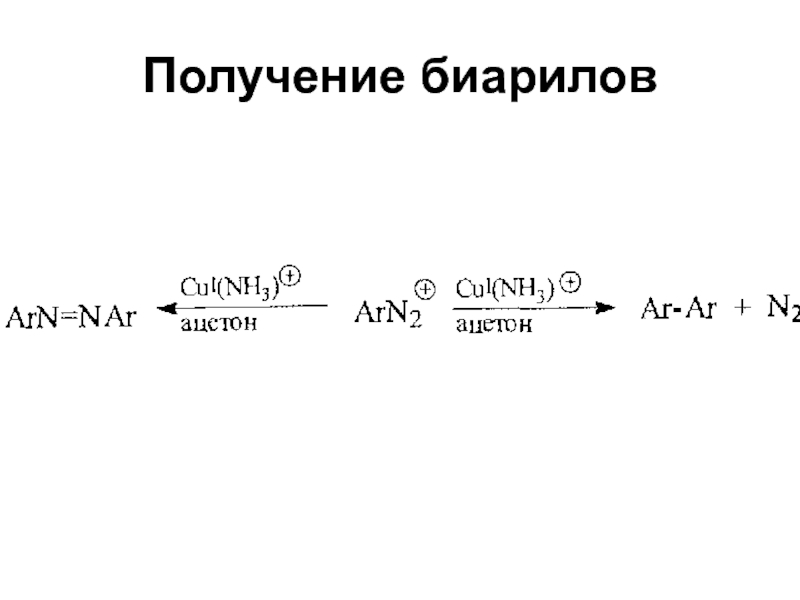
- 59. Получение биарилов
- 60. Реакции солей диазония без выделения азота
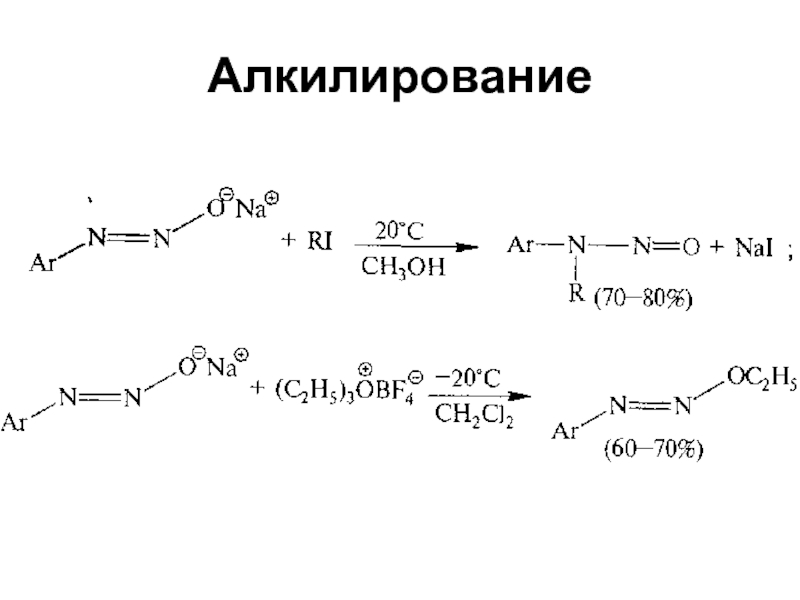
- 61. Алкилирование
- 62. Свойства диазосоединенийArN2+ + [Н] → ArNHNH2
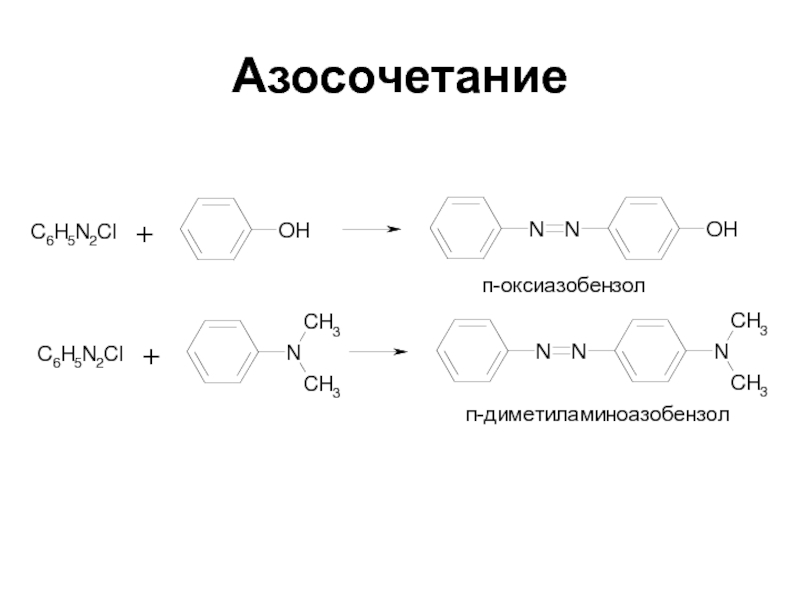
- 63. Азосочетание Соли диазония в определенных условиях реагируют
- 64. АзосочетаниеЗамещение обычно протекает в п-положение, если оно занято, сочетание происходит в о-положение
- 65. Азосочетание
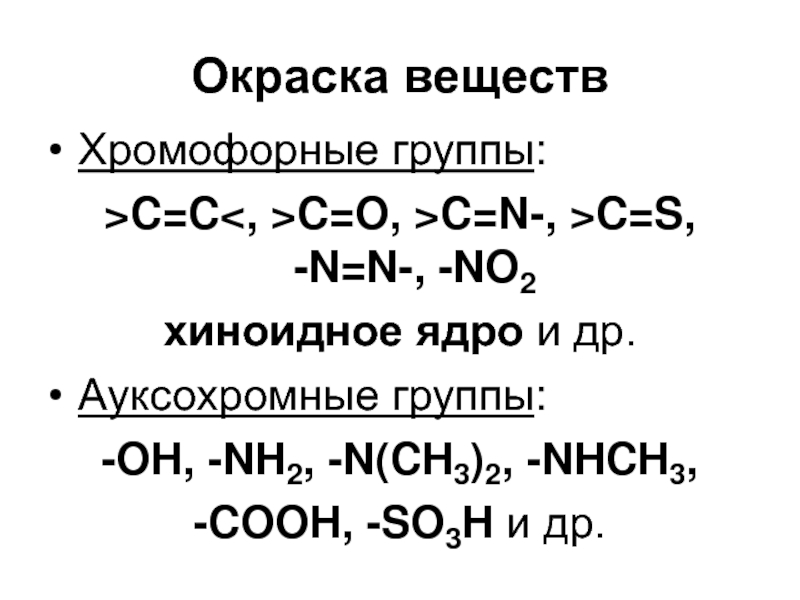
- 66. Окраска веществХромофорные группы:>C=CC=O, >C=N-, >C=S, -N=N-,
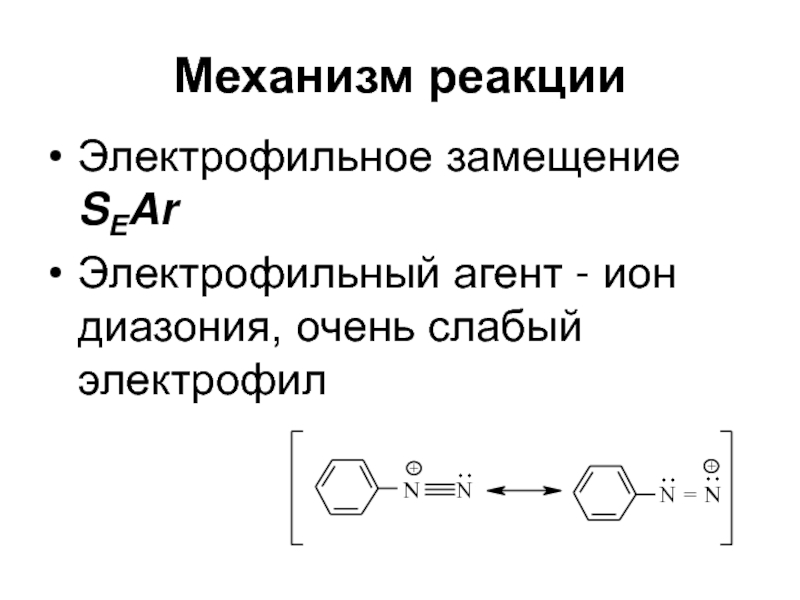
- 67. Механизм реакции Электрофильное замещение SEArЭлектрофильный агент - ион диазония, очень слабый электрофил
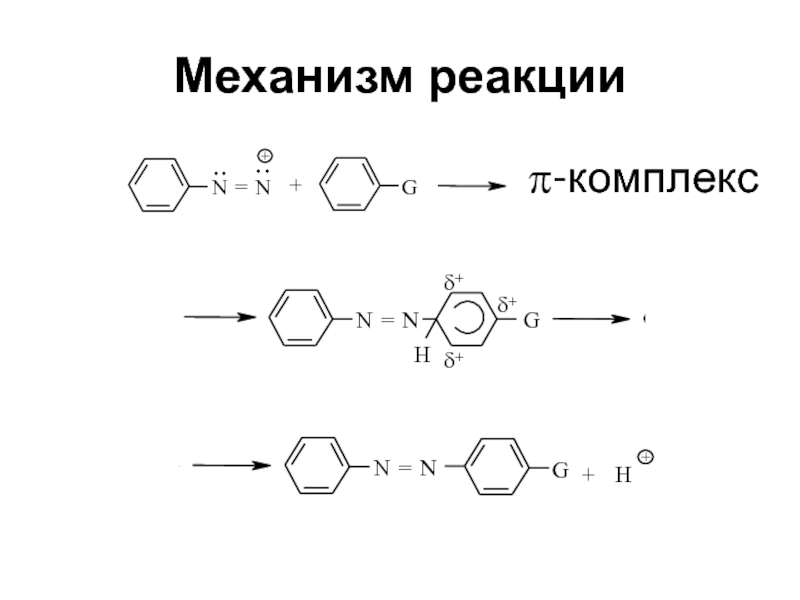
- 68. Механизм реакцииπ-комплекс
- 69. Сочетание с фенолами Ведется в слабощелочной среде, при пониженной температуре
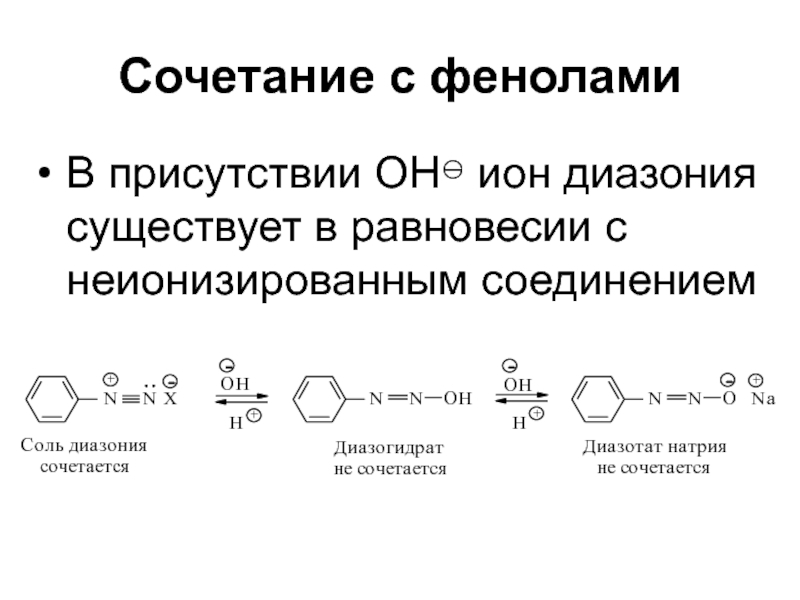
- 70. Сочетание с феноламиВ присутствии ОН ион диазония существует в равновесии с неионизированным соединением
- 71. Сочетание с аминами Высокая кислотность среды способствует тому, что диазосоединение полностью находится в виде диазокатиона
- 72. Сочетание с аминами Чем выше кислотность, тем
- 73. Синтез п-нитроанилинового красного
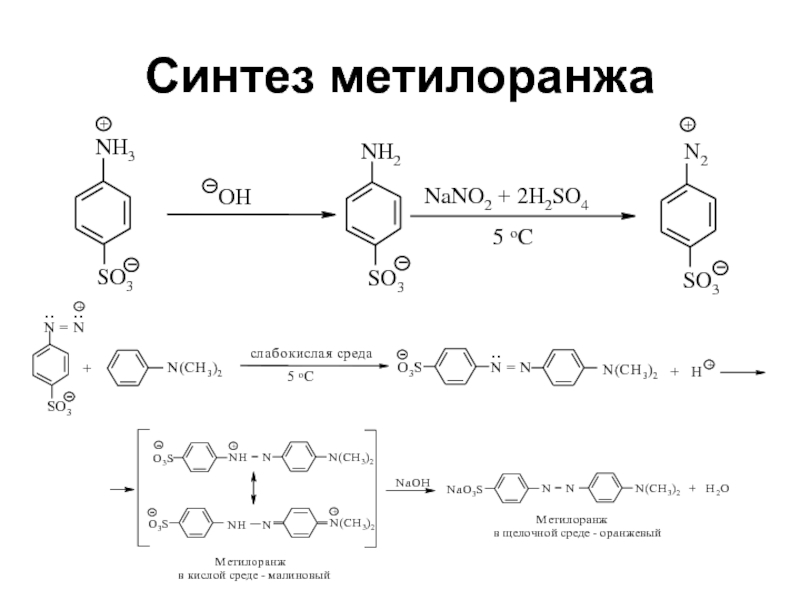
- 74. Синтез метилоранжа
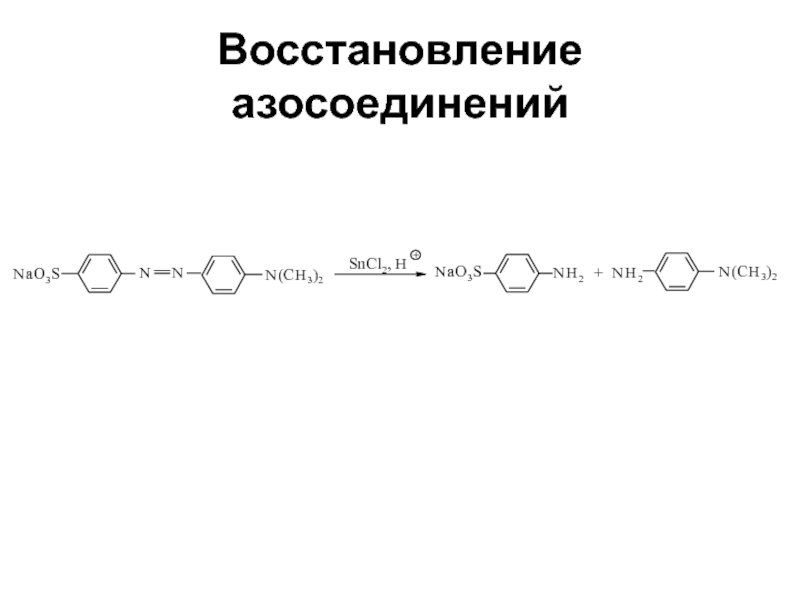
- 75. Восстановление азосоединений
- 76. Восстановление азосоединений
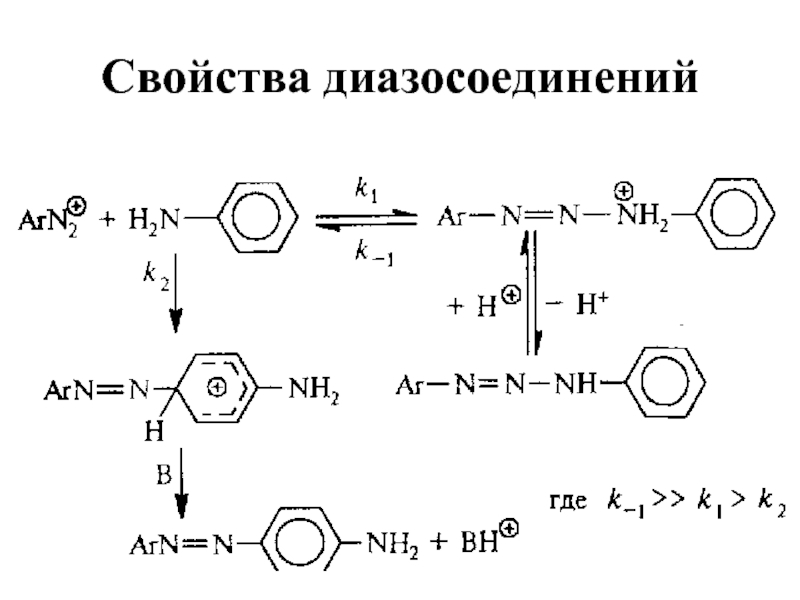
- 77. Свойства диазосоединенийДля первичных и вторичных ароматических аминов азогруппа вступает не в ароматическое кольцо, а в аминогруппу:
- 78. Свойства диазосоединений
- 79. Свойства диазосоединений
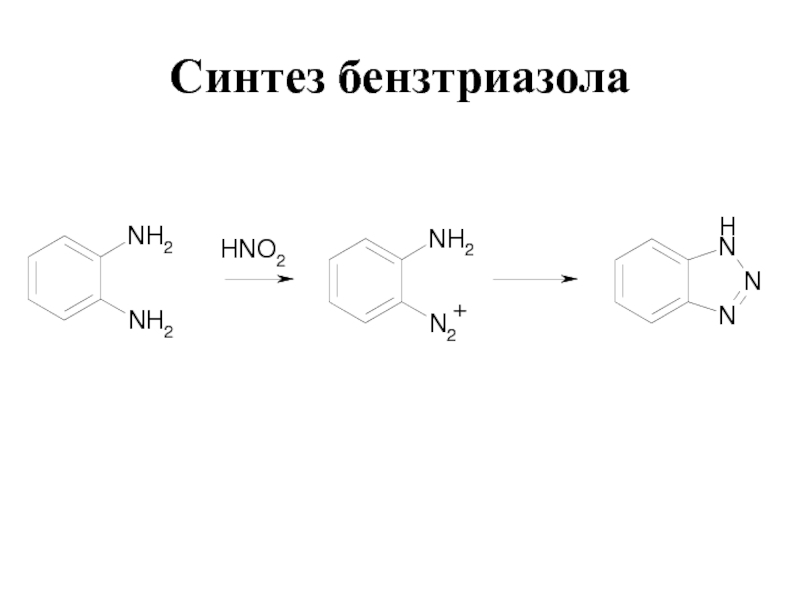
- 80. Синтез бензтриазола
- 81. Реакция с СН-кислотами
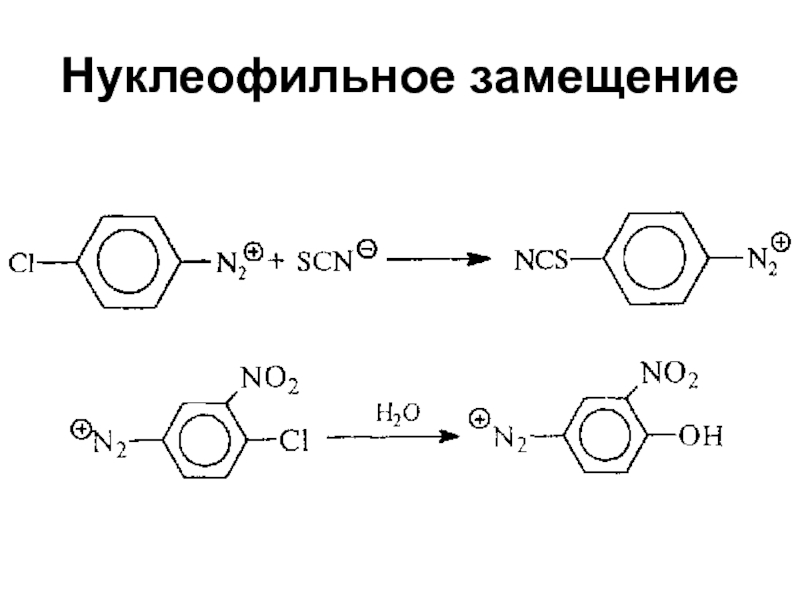
- 82. Нуклеофильное замещение
- 83. Слайд 83
- 84. Скачать презентанцию
Амины (органические производные аммиака)
Слайды и текст этой презентации
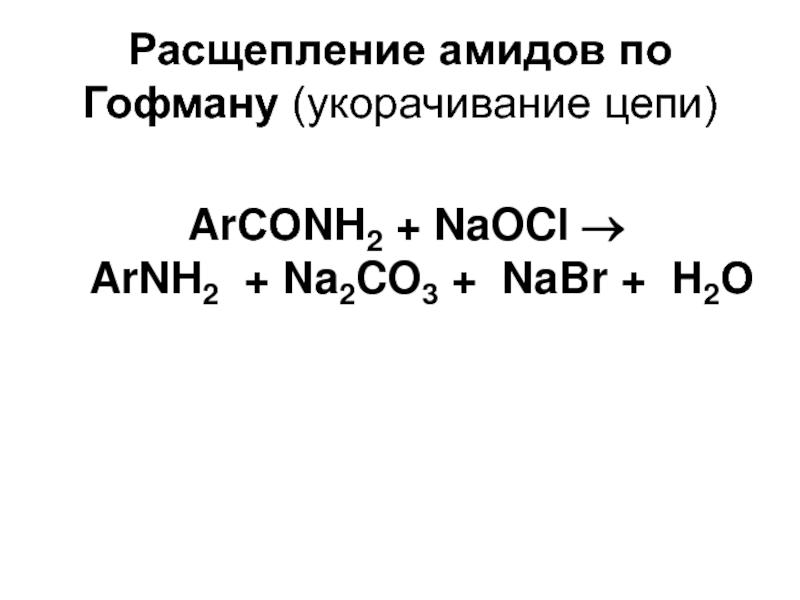
Слайд 11Расщепление амидов по Гофману (укорачивание цепи)
ArСОNH2 + NaOCl →
ArNH2
+ Na2CO3 + NaBr + Н2О
Слайд 12Физические свойства
Ароматические амины – жидкости или твердые тела с характерным
неприятным запахом, сильно токсичны
В воде растворяются мало, накопление аминогрупп ведет
к увеличению растворимости Слайд 13Химические свойства
Амины являются основаниями
Амины способны выступать в качестве нуклеофильных реагентов
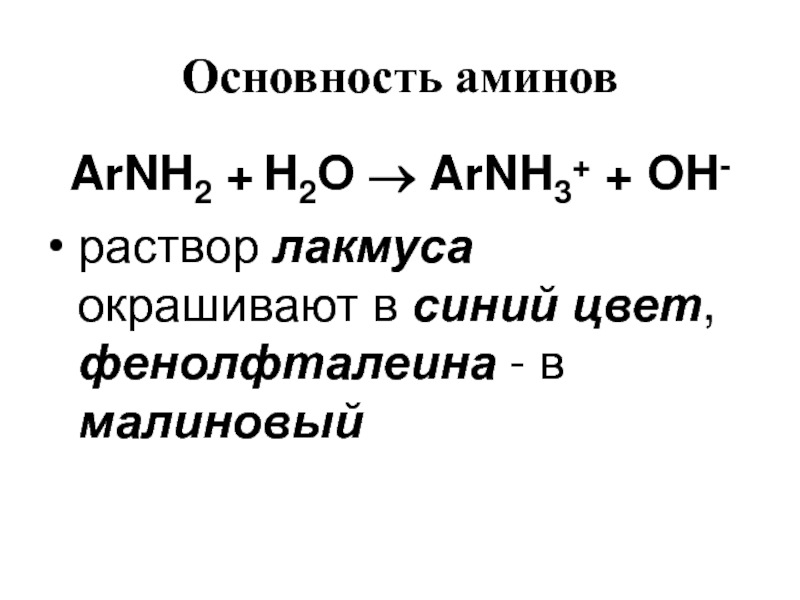
Слайд 14Основность аминов
ArNH2 + H2O → ArNH3+ + OH-
раствор лакмуса
окрашивают в синий цвет, фенолфталеина - в малиновый
Слайд 18Основность (pKBH+)
NH3 9.21
CH3NH2 10.62 C2H5NH2 10.63
(CH3)2NH 10.71 (C2H5)2NH 10.98
(CH3)3N 9.76
(C2H5)3N 10.65
PhNH2 4.58
PhNHCH3 4.85
PhN(CH3)2 5.06
Слайд 24Ароматические амины
Первичные при взаимодействии с азотистой кислотой дают соли
диазония:
PhNH2∙HCl + НОNO →
[Ph-N≡N]Cl + 2 Н2О
Слайд 25Ароматические амины
Вторичные при взаимодействии с азотистой кислотой образуют N-нитрозосоединения
Слайд 26Ароматические амины
Третичные при взаимодействии с азотистой кислотой образуют ароматические нитрозосоединения
Слайд 37Диазосоединения
В которых группа –N2– связана с углеводородным радикалом и неуглеводородным
радикалом Х
Ar–N2X, где X = Br, Cl, NO3, HSO4
- cоли диазонияAr–N2OH - диазогидрат
Слайд 39Нитрозирующие агенты
NO+ >>
H2NO2+ > NOBr > NOCl > N2O3
>>
HNO2
В неводных растворах - алкилнитриты
Для малоосновных аминов – нитрозилсерная
кислотаСлайд 44Реакции с выделением азота
Восстановление фосфорноватистой кислотой (или щелочным раствором
формальдегида)
Слайд 50SN1Ar
1) Скорость не зависит от [Nu]
2) Влияние заместителей в
ароматическом кольце
3) Ar15N+≡N ⇔ ArN+≡N15
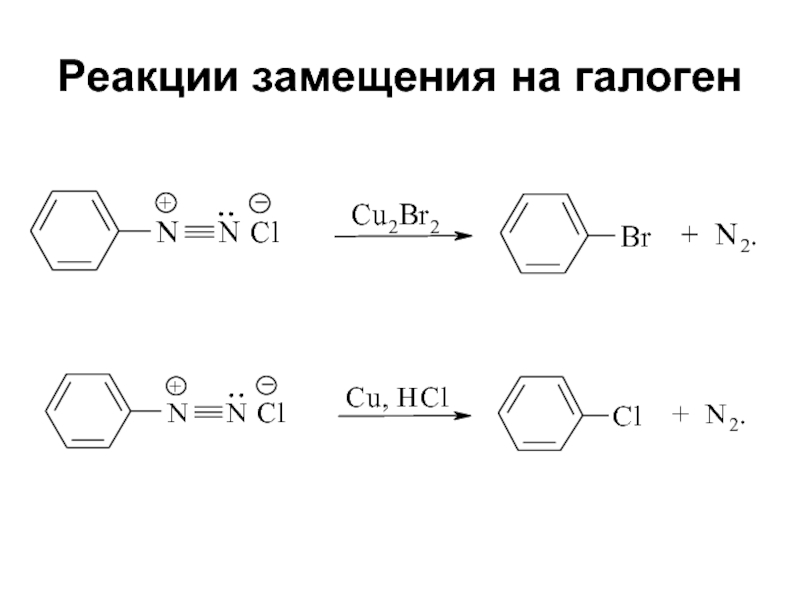
Слайд 52Реакции замещения на галоген
Реакции с использованием галогенида меди (I)
называются реакциями Зандмейера
Реакции с использованием металлической меди называются реакциями Гаттермана
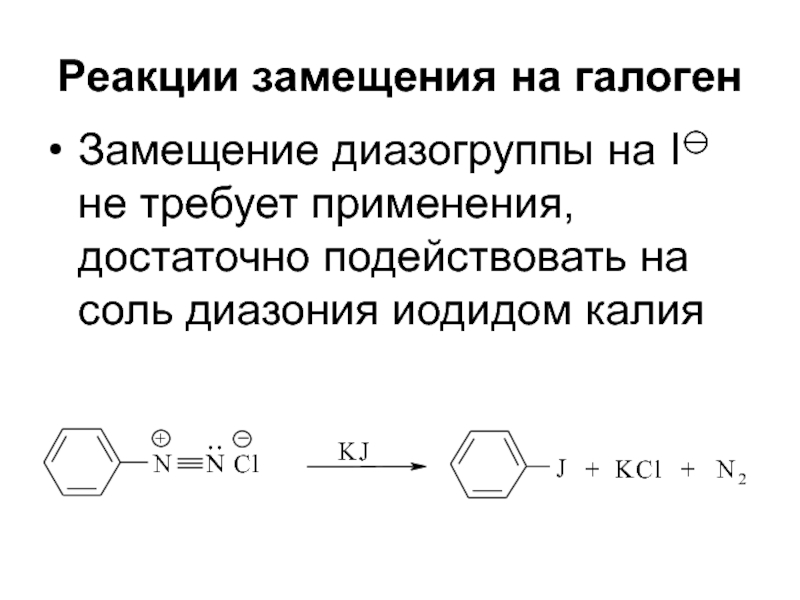
Слайд 54Реакции замещения на галоген
Замещение диазогруппы на I не требует применения,
достаточно подействовать на соль диазония иодидом калия
Слайд 57Замещение на -ОН
Реакция медленно протекает даже в ледяном растворе
Соли
диазония надо использовать сразу после их приготовления
Слайд 63Азосочетание
Соли диазония в определенных условиях реагируют с ароматическими соединениями
с образованием азосоединений Ar–N=N–Ar’
Эти реакции называются реакциями азосочетания
Слайд 64Азосочетание
Замещение обычно протекает в п-положение, если оно занято, сочетание происходит
в о-положение
Слайд 66Окраска веществ
Хромофорные группы:
>C=CC=O, >C=N-, >C=S,
-N=N-, -NO2
хиноидное ядро и
др.
Ауксохромные группы:
-OH, -NH2, -N(CH3)2, -NHCH3,
-COOH, -SO3H и др.
Слайд 67Механизм реакции
Электрофильное замещение SEAr
Электрофильный агент - ион диазония, очень
слабый электрофил
Слайд 70Сочетание с фенолами
В присутствии ОН ион диазония существует в равновесии
с неионизированным соединением
Слайд 71Сочетание с аминами
Высокая кислотность среды способствует тому, что диазосоединение
полностью находится в виде диазокатиона
Слайд 72Сочетание с аминами
Чем выше кислотность, тем выше доля амина
в виде иона аммония
Среда должна быть слабокислой
Слайд 77Свойства диазосоединений
Для первичных и вторичных ароматических аминов азогруппа вступает не
в ароматическое кольцо, а в аминогруппу:
Теги







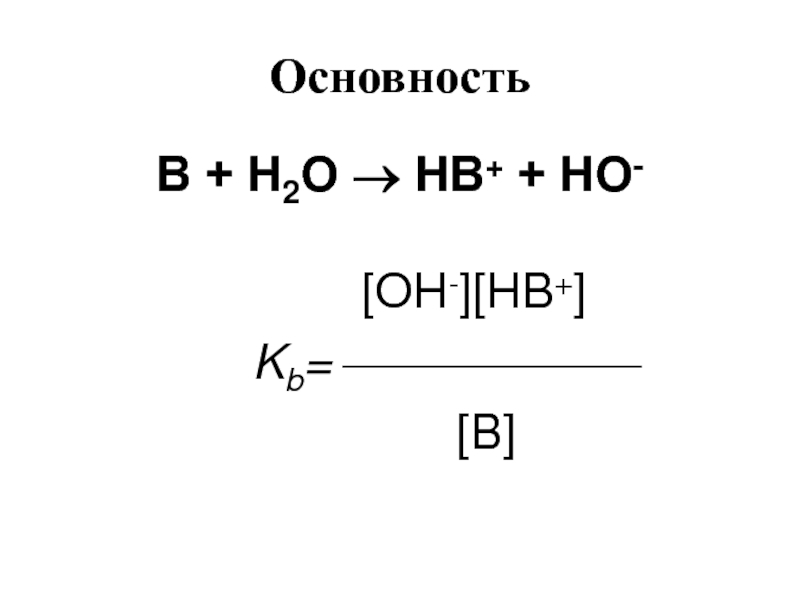




![Амины (органические производные аммиака) Ароматические амины Первичные при взаимодействии с азотистой кислотой дают соли диазония:PhNH2∙HCl Ароматические амины Первичные при взаимодействии с азотистой кислотой дают соли диазония:PhNH2∙HCl + НОNO → [Ph-N≡N]Cl +](/img/thumbs/c7da2967fbf491a848912bbc8c8ef1e3-800x.jpg)









![Амины (органические производные аммиака) SN1Ar1) Скорость не зависит от [Nu]2) Влияние заместителей в ароматическом кольце3) Ar15N+≡N ⇔ ArN+≡N15 SN1Ar1) Скорость не зависит от [Nu]2) Влияние заместителей в ароматическом кольце3) Ar15N+≡N ⇔ ArN+≡N15](/img/thumbs/ab71d04b1af8f27929c13ab908cdb0e9-800x.jpg)




![Амины (органические производные аммиака) Свойства диазосоединенийArN2+ + [Н] → ArNHNH2 Свойства диазосоединенийArN2+ + [Н] → ArNHNH2](/img/thumbs/41beb445dd0ca4fc3a47405486f4d391-800x.jpg)