Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аммиак (9 класс)
Содержание
- 1. Аммиак (9 класс)
- 2. Из истории химических имён.Строение молекулы аммиака.Физические свойства
- 3. Бог Амон в образе баранаVIII в. до н.э. (Музей г. Мероэ, Судан)
- 4. NH3
- 5. NHHHСхема строения атома азота выглядит так:
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
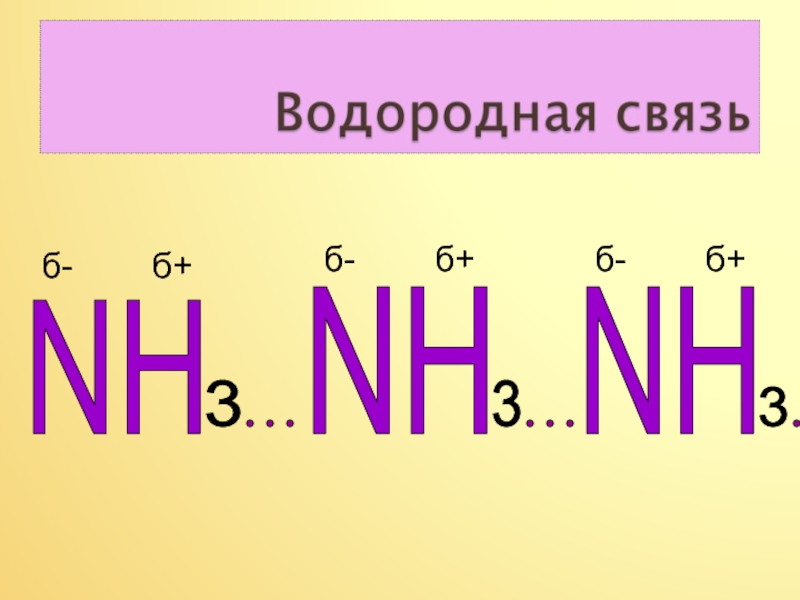
- 10. NHNH333NHб- б+б- б+б- б+
- 11. Вывод. Наличие не поделённой электронной пары на
- 12. Аммиак –это газ, бесцветный, с резким запахом,
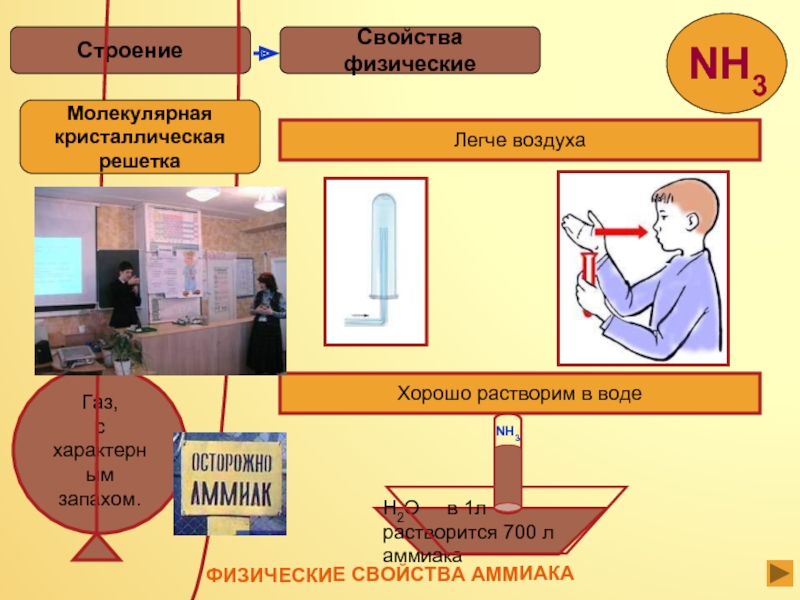
- 13. Свойства физическиеСтроениеЛегче воздухаХорошо растворим в водеH2O
- 14. 1.Взаимодействие с водой. Действие водного раствора аммиака
- 15. Слайд 15
- 16. NH3 + HОН ↔ NH4ОН гидроксид
- 17. Слайд 17
- 18. Растворение аммиака в воде и в кислотах
- 19. NH3 + HCl →
- 20. 1. В отсутствии катализатора NH3
- 21. Аммиак не горит на воздухе, но в
- 22. . CuSO4 +2NaOH→Cu(OH)2+Na2SO44NH3+ Cu(OH)2→[Cu(NH3)4](OH)2
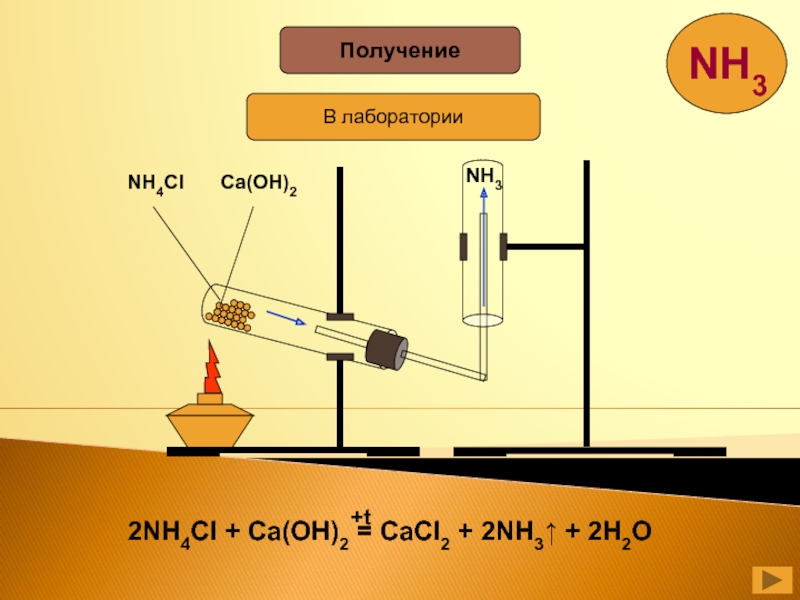
- 23. ПолучениеВ лабораторииNH4ClCa(OH)2NH3
- 24. Слайд 24
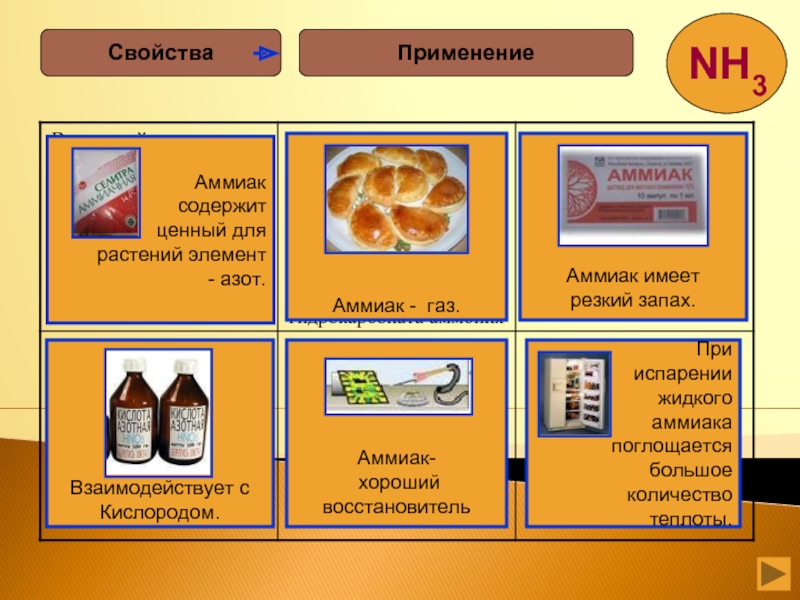
- 25. ПрименениеСвойства
- 26. Чтоб продукты не пропалиВам поможет аммиак, И
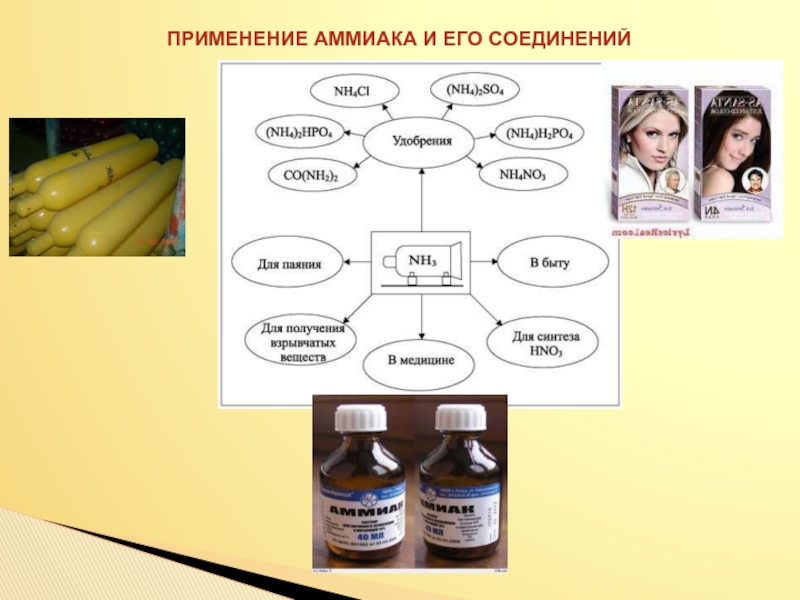
- 27. ПРИМЕНЕНИЕ АММИАКА И ЕГО СОЕДИНЕНИЙ
- 28. Слайд 28
- 29. Слайд 29
- 30. Нельзя прикасаться к
- 31. Контроль по теме «Аммиак».Что узнали?1 уровень1)Аммиак
- 32. 2 уровень1)Молекула аммиака имеет неподелённую электронную пару:А.
- 33. АммиакГазообразныйХорошорастворимВосстановитель при горенииОбразующий соль нашатырьПоражающий слизистые оболочкиПоражает растения
- 34. N2NH3(NH4)2SO4NH4ClNH3 Cоставьте кроссворд, ключевым словом которого будет нашатырь.
- 35. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ЦЕЛЬ УРОКА:
изучение строения молекулы аммиака, его физических и химических
свойств;
применение;Слайд 2Из истории химических имён.
Строение молекулы аммиака.
Физические свойства аммиака. Действие на
организм. Правила обращения с аммиаком.
Химические свойства аммиака.
Способы получения аммиака в
лаборатории и в промышленности.Применение аммиака в областях народного хозяйства.
Экологические проблемы связанные с утечкой аммиака.
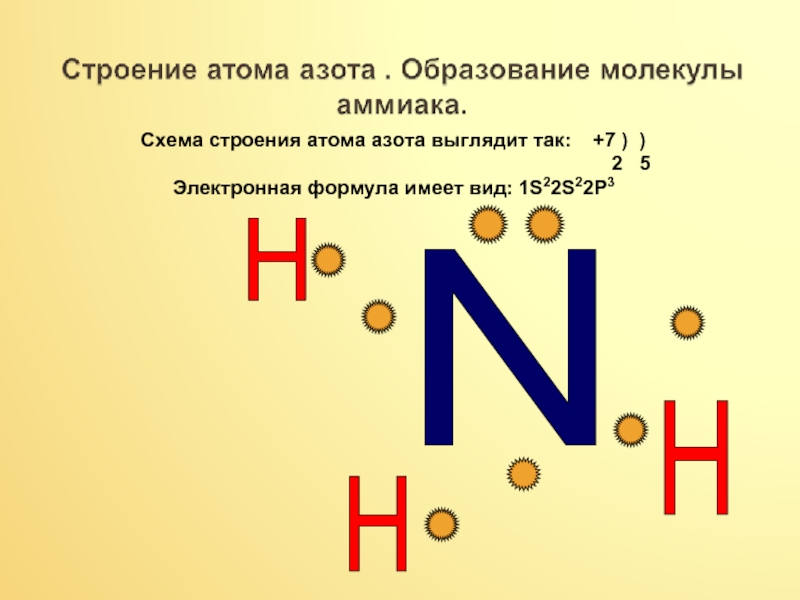
Слайд 5N
H
H
H
Схема строения атома азота выглядит так: +7 ) )
Электронная формула имеет вид: 1S22S22P3
Слайд 11
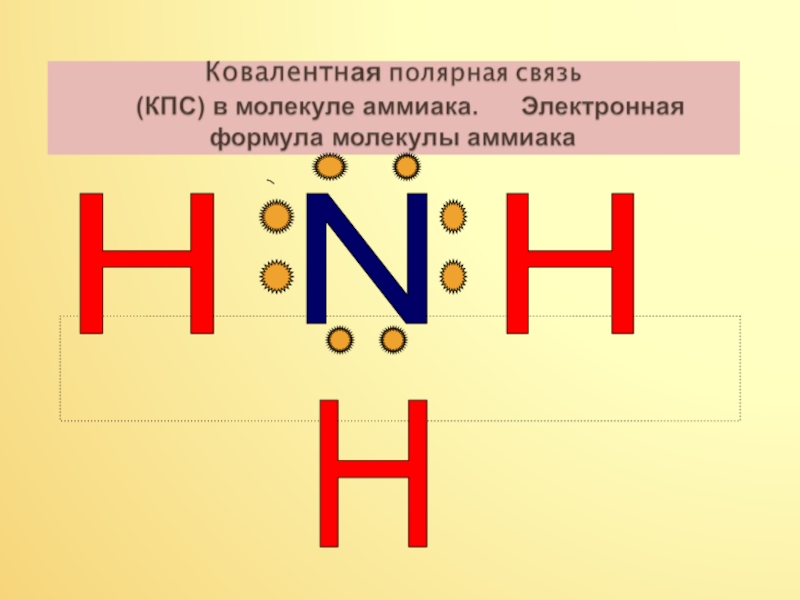
Вывод. Наличие не поделённой электронной пары на атоме азота и
присутствие трёх полярных ковалентных связей в молекуле аммиака , будет
способствовать тому, что он будет вступать в реакции присоединения протона водорода Н+,то есть реагировать с водой и с растворами кислот, которые имеют протоны водорода.
Присутствие водородной связи в молекуле аммиака объясняет его растворение в воде, и лёгкое сжижение этого газа.
Слайд 12Аммиак –это газ, бесцветный,
с резким запахом,
ядовит,
сжижается при
–33,35 °С,
затвердевает при –77,7 °С.
при давлении 9•105
Па сжижается уже при комнатной температуре,хорошо растворим в воде, при 20 °С в 1 объеме воды растворяется 700 объемов аммиака,
а также хорошо растворяется в спиртах, ацетоне.
Кроме того, сжиженный аммиак при испарении поглощает тепло,
при соприкосновении с кожей возникает обморожение различной степени.
Слайд 13Свойства физические
Строение
Легче воздуха
Хорошо растворим в воде
H2O в 1л
растворится 700 л аммиака
NH3
Молекулярная
кристаллическая
решетка
ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА
Слайд 141.Взаимодействие с водой. Действие водного раствора аммиака на индикаторы.
2.Взаимодействие с
кислотами
3.Окисление:
без катализатора;
с катализатором;
4.С солями с образованием комплексного соединения
Слайд 16NH3 + HОН ↔ NH4ОН гидроксид аммония, нашатырный спирт
NH3
+ HОН ↔ NH3 · Н2О аммиачная вода
H2O в 1л растворится 700 л аммиака
NH3
NH3
Слайд 18Растворение аммиака в воде и в кислотах – процесс химический,
в основе которого лежит способность молекул аммиака связывать ионы водорода.
Причина этого – наличие у атома азота свободной электронной пары, которая «перетягивает» протон водорода из молекул воды и кислоты.Слайд 20 1. В отсутствии катализатора NH3 + O2 →
N2 + H2O 4NH3 + 3O2 = 2N2 + 6H2O
2. Горение аммиака С КАТАЛИЗАТОРОМ. В реакции горения аммиак проявляет восстановительные свойства аммиака
NH3 + O2 → NO + H2O
4NH3 + 5O2 = 4NO + 6H2O
Слайд 21Аммиак не горит на воздухе, но в чистом кислороде или
в присутствии катализатора аммиак хорошо окисляется, проявляя свойства восстановителя.
Слайд 26Чтоб продукты не пропали
Вам поможет аммиак,
И растениям, конечно,
Аммиак совсем
не враг.
Если обморок случился –
Может в чувство привести,
Вывести из
опьяненья,Глянец окнам навести.
Слайд 30
Нельзя прикасаться к разлитому веществу, это
может вызвать болезненный ожог кожных покровов.
При утечке аммиака важно в
первую очередь защитить кожу и органы дыхания, а также избегать падания аммиака в глаза.Категорически запрещается делать искусственное дыхание, если человек надышался аммиачными парами, так как это только ускорит процесс окисления и вызовет удушье.
При отравлении аммиаком нельзя пить, а нужно закапать в глаза альбуцид или промыть глаза раствором борной кислоты.
В нос закапать теплое подсолнечное, оливковое или персиковое масло, а лицо, руки и вообще пораженные участки тела промыть 2-процентным раствором борной кислоты.
Слайд 31 Контроль по теме «Аммиак».Что узнали?
1 уровень
1)Аммиак ____________ растворяется в
воде.
2)Раствор аммиака в воде называют ___________ водой или ___________ спиртом.
3)Под
действием аммиака влажная фенолфталеиновая бумажка меняет свою окраску на ________________.4)При взаимодействии аммиака с концентрированной соляной кислотой образуется вещество в виде клубов белого дыма, называемого _______________.
5)Аммиак в реакциях проявляет ______________ свойства…
6) На каких свойствах аммиака основаны методы борьбы с его утечкой?
7) На каких свойствах аммиака основано его применение в медицине, в холодильных установках?
Слайд 322 уровень
1)Молекула аммиака имеет неподелённую электронную пару:
А. Одну
Б. Две В. Три Г. Пять
2) Какое вещество является восстановителем в реакции NH3 + O2 N2 + H2O
А. Аммиак Б. Кислород В. Азот Г. Вода
3) Аммиак не взаимодействует с:
А. Серной кислотой Б. Соляной кислотой В. Гидроксидом натрия Г. Водой
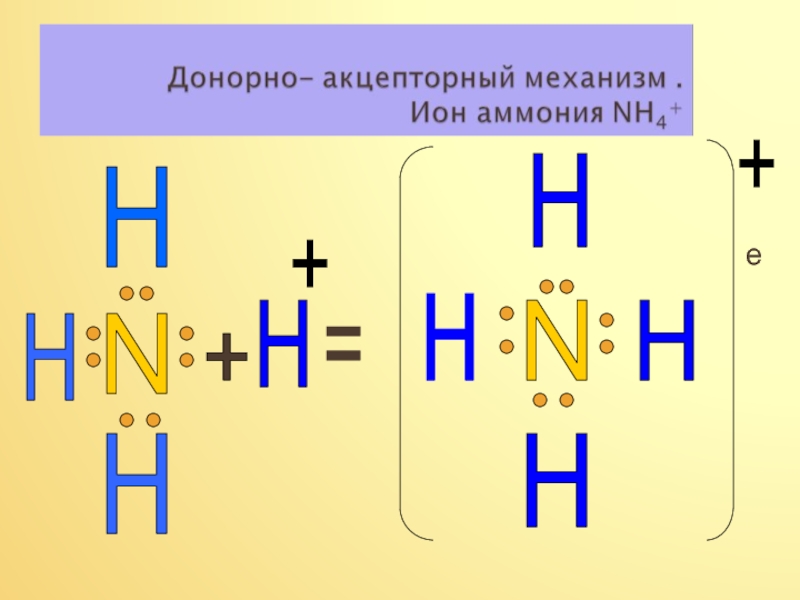
4) Установите соответствие:
Свойства азота Химические уравнения реакций
1. Реакции, связанные с изменением А. NH3 + H2O ↔NH4OH
степени окисления азота. Б. 2NH3↔N2 + 3H2
2. Реакции, связанные с образованием В. 4NH3 + 3O2 = 2N2 +6H2O
ковалентной связи по донорно-акцептор - Г. NH3 + HCl = NH4Cl
ному механизму.
5) Составить уравнение химической реакции аммиака с азотной кислотой HNO3.
6) Почему окрашенная в аммиаке фенолфталеиновая бумажка со временем обесцвечивается? Составьте соответствующие уравнения реакций.















2 . CuSO4 +2NaOH→Cu(OH)2+Na2SO44NH3+ Cu(OH)2→[Cu(NH3)4](OH)2](/img/thumbs/a268bcdae9cf81682b2da313271edbdc-800x.jpg)