свойства фосфорной кислоты через проведение химического эксперимента;
На основе Интернет-ресурсов, специальной
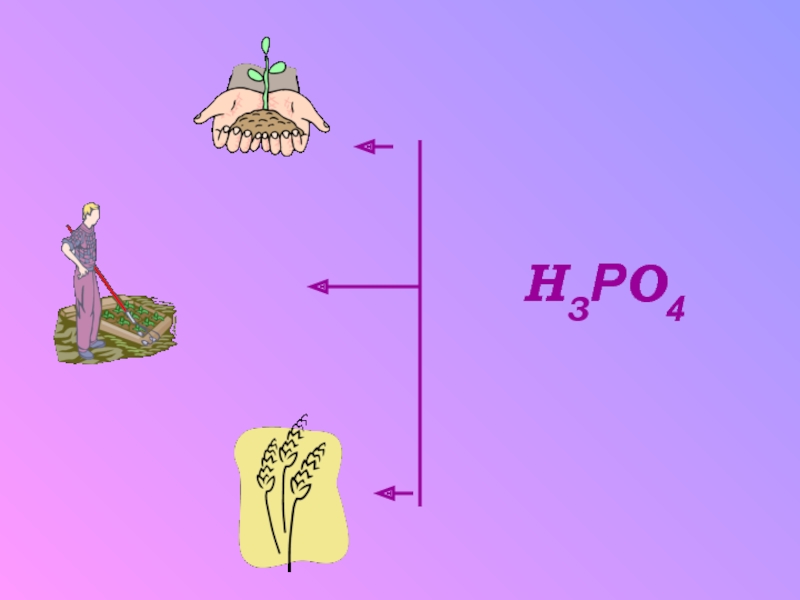
литературы проиллюстрировать применение и получение фосфорной кислоты.развивающие:
Пробудить интерес к самостоятельному поиску информации в Интернете, специальной литературе;
Выразить свое отношение к проблемам экологии при промышленном получении фосфорной кислоты и ее применение.
воспитательные:
На основе материала данной темы, эксперимента умения обучающихся наблюдать, сравнивать, делать выводы.