Название работы
Автор: Ширяева Екатерина Константиновна,
учитель МБОУ «СОШ №31» п. Восток
Красноармейского муниципального района
Приморского края.
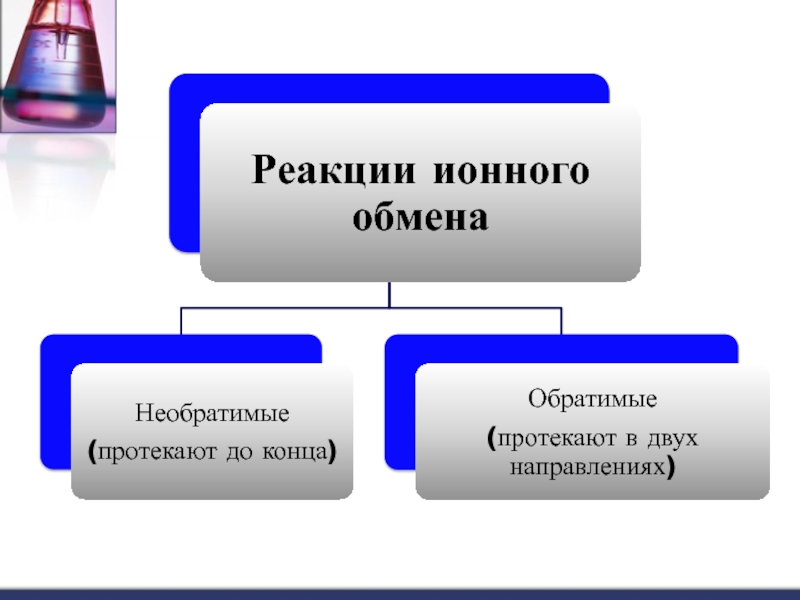
«Реакции ионного обмена»
п. Восток,2015г.
Слайд 2Цели презентации:
научить школьников составлять ионные уравнения реакций;
рассмотреть условия протекания реакций
ионного обмена до конца;
формировать системный подход и способность предсказывать результат
реакций на основе полученных знаний;
раскрыть значение реакций ионного обмена.
Презентация может быть использована для дистанционного обучения.
Слайд 3Методические рекомендации
Слайд 6. Определение условий прохождения реакций «до конца» (курсор
наводим на стаканы –клик).
Выпадение осадка –записываем уравнение реакции
-клик.
Слайд 7. При определении растворимости веществ используем таблицу . После записи реакции в ионном виде возвращаемся на слайд 6.
Выделение газа, образование слабого электролита (действия аналогичны).
В слайдах 15-20 используются триггеры. На слайде 19 проверка ответов – клик на цифры . Правильный ответ , неправильный ответ .
Уравнение
реакции
В презентации используются гиперссылки, триггеры.
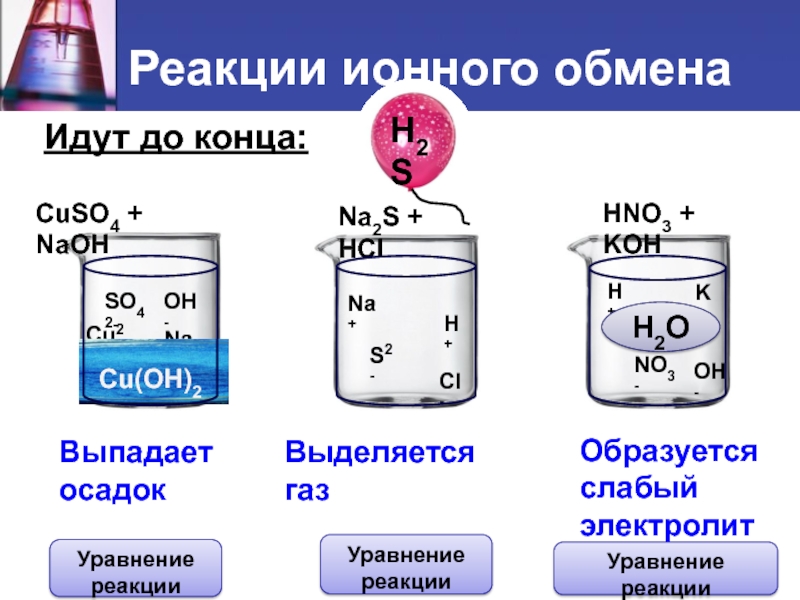
Слайд 6 Идут до конца:
CuSO4 + NaOH
Na2S + HCl
HNO3
+ KOH
Cu2+
SO42-
Na+
OH-
Na+
S2-
H+
Cl-
H+
NO3-
K+
OH-
Сu(OH)2
H2S
H2O
Выпадает
осадок
Выделяется газ
Образуется
слабый
электролит
Реакции ионного обмена
Уравнение
реакции
Уравнение
реакции
Уравнение реакции
Слайд 7Алгоритм составления уравнений
Молекулярное уравнение
CuSO4+2NaOH = Cu(OH)2 + Na2SO4
Полное ионное
уравнение
Сокращенное ионное уравнение
Cu
2+
+
SO4
2-
+
2
Na
+
+
2
OH
-
=
Cu(OH)2
+
2
Na
+
+
SO4
2-
Cu
2+
+
2OH
-
=
Cu(OH)2
1.Записать уравнение реакции в
молекулярном виде
2.По таблице
растворимости определить
растворимость каждого вещества
3.Составить полное ионное уравнение (записать
диссоциацию растворимых исходных веществ
и продуктов реакции)
4.Найти одинаковые ионы в левой и
правой частях, сократить их и записать
сокращенное ионное уравнение
Т1
Слайд 8Не расписываются на ионы:
Вода H2O.
Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH
и др.).
Слабые основания (NH4OH, Fe(OH)2, Cu(OH)2, и др.).
Нерастворимые соли(↓): (AgCl
, BaSO4, CaCO3, FeS и др.).
Амфотерные гидрооксиды (↓): Al(OH)3, Zn(OH)2, Cr(OH)3 и др.
Газообразные вещества( CO2, SO2, H2, H2S, NH3 и др.).
Оксиды металлов и неметаллов (Li2O, MgO, P2O5, SiO2, и т.д).
Слайд 9Выключить поиск
Включить поиск
Обозначения
Баженов А.А.
Баженов А.А.
_
Р
Р
_
Р
М
Н
Н
Н
_
Н
Н
Н
Н
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Н
Р
Р
Р
Р
Р
Р
М
Р
Р
Р
Р
Р
Р
Р
Н
Р
М
Н
Н
Н
Н
Н
Н
_
_
Р
Р
Р
Р
Н
М
М
М
М
?
Н
Н
М
?
?
Р
Р
Р
Р
М
Н
М
Р
Р
Р
_
Н
Р
Р
Р
Р
Р
Р
Р
Н
Н
Н
Н
Н
Н
?
Н
Н
?
?
Н
?
Р
Р
?
Н
Н
Н
Н
?
?
Н
Н
?
?
Р
_
Р
Р
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Н
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
_
_
Баженов А.А.
Таблица растворимости
.
OH-
Ионы
NO3-
Cl-
S2-
SO32-
SO42-
CO32-
SiO32-
PO43-
CH3COO-
H+
NH4+
K+
Na+
Ag+
Ba2+
Ca2+
Mg2+
Zn2+
Cu2+
Hg2+
Pb2+
Fe2+
Fe3+
Al3+
OH-
H+
Ионы
Баженов А.А.
NO3-
Cl-
S2-
SO32-
SO42-
CO32-
SiO32-
PO43-
CH3COO-
NH4+
K+
Na+
Ag+
Ba2+
Ca2+
Mg2+
Zn2+
Cu2+
Hg2+
Pb2+
Fe2+
Fe3+
Al3+
Т
1
2
3
4
Слайд 10Составление уравнений
Молекулярное уравнение
Na2S+2HCl = H2S
+ 2NaCl
Полное ионное уравнение
Сокращенное ионное уравнение
Na
+
+
S
2-
+
2
H
+
+
2
Cl
-
=
H2S
+
2
Na
+
+
Cl
-
S
2-
+
2H
+
=
H2S
2
2
Т2
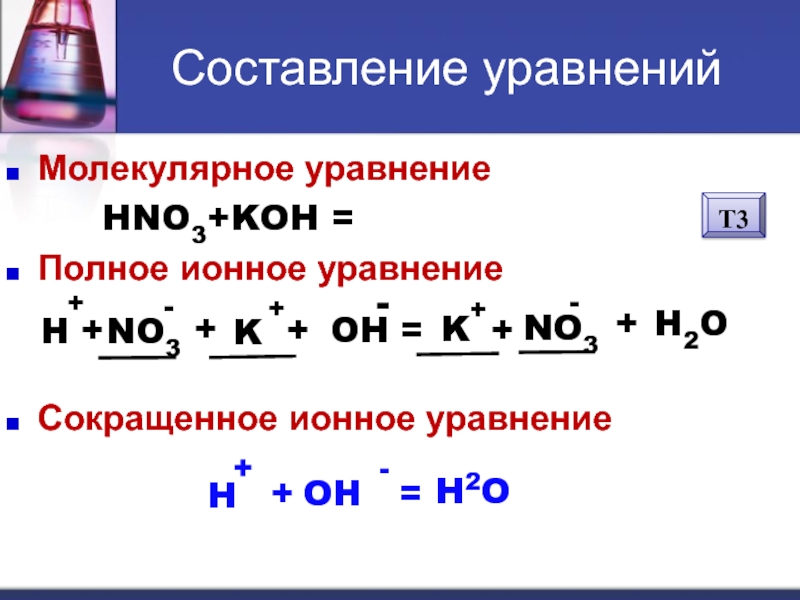
Слайд 11Составление уравнений
Молекулярное уравнение
HNO3+KOH = KNO3 +
H2O
Полное ионное уравнение
Сокращенное ионное уравнение
H
+
+
NO3
-
+
K
+
+
OH
-
=
H2O
+
K
+
+
NO3
-
H
+
+
OH
-
=
H2O
Т3
Слайд 12Не расписываются на ионы:
Вода H2O.
Слабые кислоты (HNO2, H2CO3, H2SO3, CH3COOH
и др.).
Слабые и нерастворимые основания (NH4OH, Fe(OH)2, Cu(OH)2, и др.).
Нерастворимые
соли(↓): (AgCl , BaSO4, CaCO3, FeS и др.).
Амфотерные гидрооксиды (↓): (Al(OH)3, Zn(OH)2, Cr(OH)3 и др.).
Газообразные вещества( CO2, SO2, H2, H2S, NH3 и др.).
Оксиды металлов и неметаллов (Li2O, MgO, P2O5, SiO2, и др.).
Слайд 13Обратимые реакции
Na2SO4 + KNO3
Na+
SO42-
K+
NO3-
1.Нет осадка
2.Не выделяется газ
3.Не образуется
слабый
электролит
Слайд 14Составление уравнений
Молекулярное уравнение
Na2SO4+2KNO3 2NaNO3 + K2SO4
Полное ионное уравнение
2Na
+
+
SO4
2-
+
2
K
+
+
2
NO3
-
+
2
K
+
+
SO4
2-
2
NO3
-
Na
+
+
2
Обратимые реакции – реакции, идущие
во взаимно
противоположных направлениях
Т4
Слайд 15Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах
с образованием осадка:
1.SO42-и H+ ; Ag+ и Cl-
2.Cl- и
Fe 2+ ; Fe2+ и OH-
3.OH- и Cu2+ ; Na+ и SiO32-
4.Ba2+ и SO42- ; Cu2+ и OH-
AgCl
Fe(OH)2
Cu(OH)2
BaSO4
Cu(OH)2
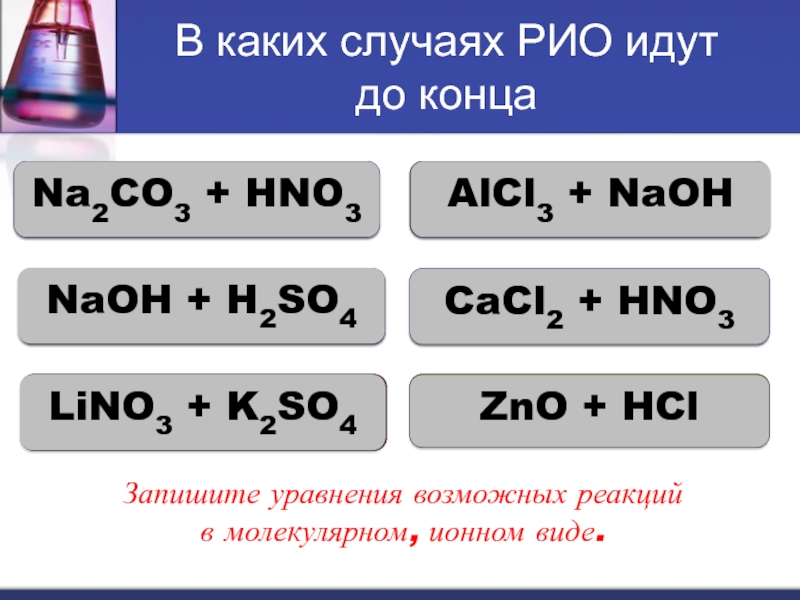
Слайд 16В каких случаях РИО идут
до конца
Молодец
Молодец
Молодец
Ошибка
Ошибка
Молодец
Na2CO3 + HNO3
AlCl3 +
NaOH
NaOH + H2SO4
CaCl2 + HNO3
LiNO3 + K2SO4
ZnO + HCl
Запишите уравнения
возможных реакций
в молекулярном, ионном виде.
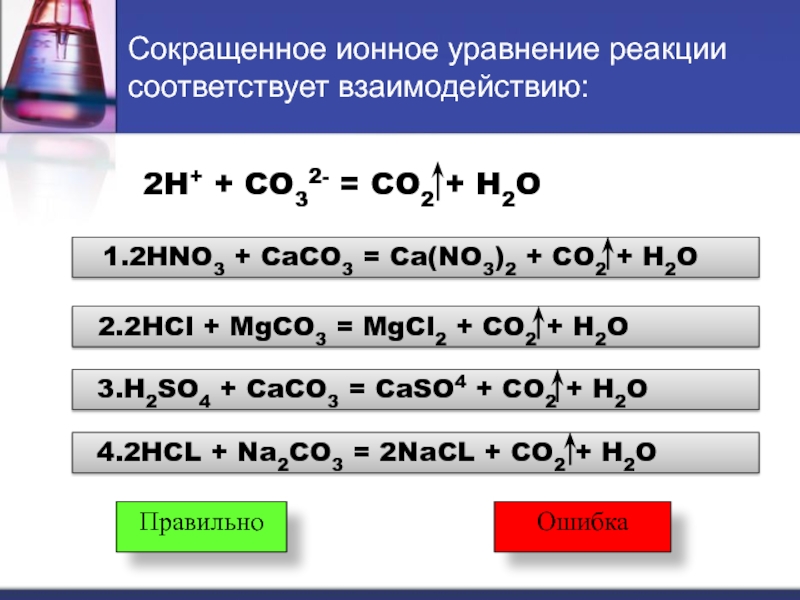
Слайд 17Сокращенное ионное уравнение реакции соответствует взаимодействию:
2H+ + CO32- = CO2
+ H2O
1.2HNO3 + CaCO3 = Ca(NO3)2 + CO2
+ H2O
2.2HCl + MgCO3 = MgCl2 + CO2 + H2O
3.H2SO4 + CaCO3 = CaSO4 + CO2 + H2O
4.2HCL + Na2CO3 = 2NaCL + CO2 + H2O
Правильно
Ошибка
Слайд 18Сокращенное ионное уравнение реакции соответствует взаимодействию:
Al2O3 + 6H+ = 2Al3+
+ 6H2O
1.Al2O3 + 3CO2 = Al2(CO3)3
2.Al(NO3)3 +
3KOH = 3KNO3 + Al(OH)3
3.Al2O3 + 3H2SO4 = Al2(SO4)3 + 6H2O
4.AlCL3 + H2O = AlOHCl2+ + HCl
Правильно
Ошибка
Слайд 19Назовите числа правильных ответов
1.Выберите ряд, в котором каждое вещество
не
записывается в виде ионов при
составлении ионных уравнений.
Вопрос 1.
Вопрос 2.
Вопрос
3.
Вопрос 4.
H2S, Na2S, CuSO4
CO2, H2SiO3,
H2SO3
KCl, Ca(HCO3)2, HI
H2CO3, K2CO3,
Cu(OH)2
1
2
3
4
Сокращенное ионное уравнение
H+ + OH- = H2O
соответствует реакции:
H2SO4+Zn(OH)2
HCl + Al(OH)3
HNO3 + NaOH
H2CO3 + KOH
1
2
3
4
Выберите пары веществ, которые в водном
растворе взаимодействуют с
образованием газа.
Na2SO3 и HNO3
KHCO3 и HCl
NaHS и NaOH
NaHS и H2SO4
1
2
3
4
Суммы всех коэффициентов в полном и
сокращенном ионных уравнениях реакции
Fe(OH)3 + H2SO4= равны соответственно:
28 и 3
22 и 16
28 и 18
14 и 10
1
2
3
4
Вопрос
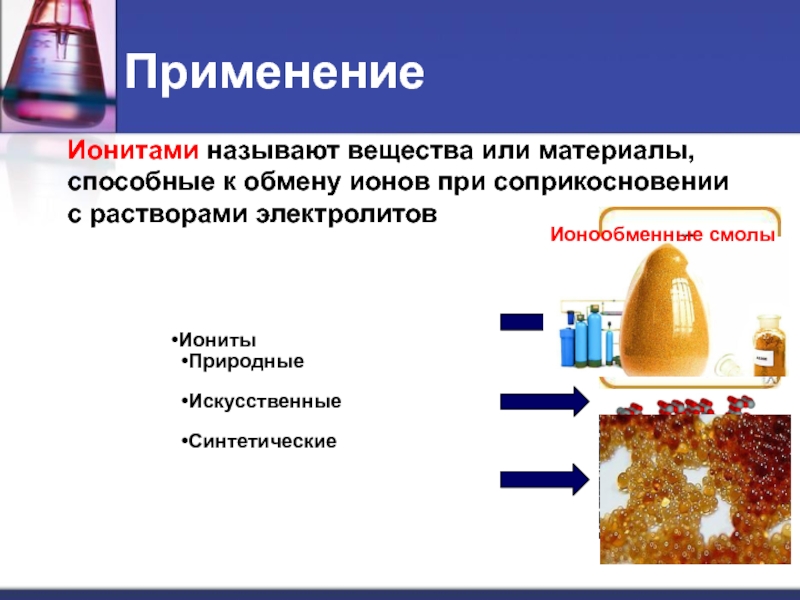
Слайд 20Применение
Ионитами называют вещества или материалы,
способные к обмену ионов при
соприкосновении
с растворами электролитов
Цеолит
Ионообменные смолы
Слайд 21Применение ионитов
Для уменьшения жёсткости воды путём замены обусловливающих её ионов
кальция и магния на другие, например, натрия.
Для обессоливания воды,
при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит.
Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо.
Очистка сточных вод промышленных предприятий.
Очистка воды
Слайд 22Применение ионитов
В пищевой промышленности:
1.Очистка соков в производстве сахара.
2.В производстве дрожжей,
фруктовых соков,
глицерина, глюкозы, сгущенного молока, какао,
кофе со сгущенным
молоком.
Слайд 23Применение ионитов
Для извлечения металлов
С помощью ионитов извлекаются
редкие и рассеянные
элементы из
полиметаллических руд.
В сельском хозяйстве иониты
используются для доставки
растениям необходимых им
элементов.
Mo
W
Слайд 24Применение ионитов
В медицине:
1.Для увеличения сроков хранения крови.
2.Для производства, выделения и
очистки антибиотиков.
3.Использование ионитов, селективно извлекающих
токсические вещества из крови человека.
Слайд 25Лестница успеха
1
2
3
4
5
6
Выберите свой уровень успеха
Слайд 26Интернет -ресурсы
http://www.openclass.ru/node/53366(таблица растворимости Баженов А.А.)
http://shopfurniture.ru/?ps_category=kofeiniki-i-vse-dlya-kofe&paged=2 (стакан)
http://vsem-darom.ru/products/categories/3199/severodvinsk (шарик)
http://do.gendocs.ru/docs/index-265718.html (лестница успеха)
http://ru.123rf.com/photo_8623287_3d-human-ladder-wall-success-business-up-red.html (человечек
с портфелем)
http://krasnoyarsk.pulscen.ru/products/sulfougol_11329010 Сульфоуголь
http://promtek-k.ru/index/sulfougol/0-170 (сульфоуголь)
http://novostey.com/other/news384529.html (Сахар)
http://www.artfile.ru/b.php?i=719068(фруктовые соки)
http://жарптица24.рф/product/bakaleya/konservatsiya_molochnaya/moloko_sguschennoe_tselnoe_glavprodukt_8_5__380gr(сгущеное (молоко)
https://ru.wikipedia.org/wiki/Иониты (Зёрна ионита)
http://www.voda-eko.ru/ionoobmennaya-smola-dlya-filtrov.html(Ионообменная смола)
http://www.aqua-therm.ru/articles/articles_217.html(Иониты)
http://kiev.all.biz/napolniteli-dlya-tualeta-domashnih-zhivotnyh-bgc4142(цеолит)
http://biobeauty.by/sostav-i-deysavie-masok-biobeauty.html
(строение цеолита)
http://visfox-oster.blogspot.ru/2012/04/blog-post_12.html (иониты)
Слайд 27Интернет -ресурсы
http://www.uefima.ru/health/xranenie-donorskoj-krovi.html(хранение крови)
http://youreld.clan.su/?page2(пенициллин)
http://ogorod01.narod.ru/obschie_podkormka_rasteniy.html (растение)
http://www.tiensmed.ru/news/tetraciklinus1.html (тетрациклин)
http://www.periodictable.ru/074W/W.html (Молибден, вольфрам)
Слайд 28Литература
Неорганическая химия(в схемах, рисунках, таблицах, формулах, химических реакциях), А.П. Гаршин,
«Лань» Санкт-Петербург,2000г
Книга для чтения по неорганической химии. В. А. Крицман,
Москва «Просвещение»1994г.
Химия 8 класс. О.С. Габриелян, Москва «ДРОФА» 2014г.