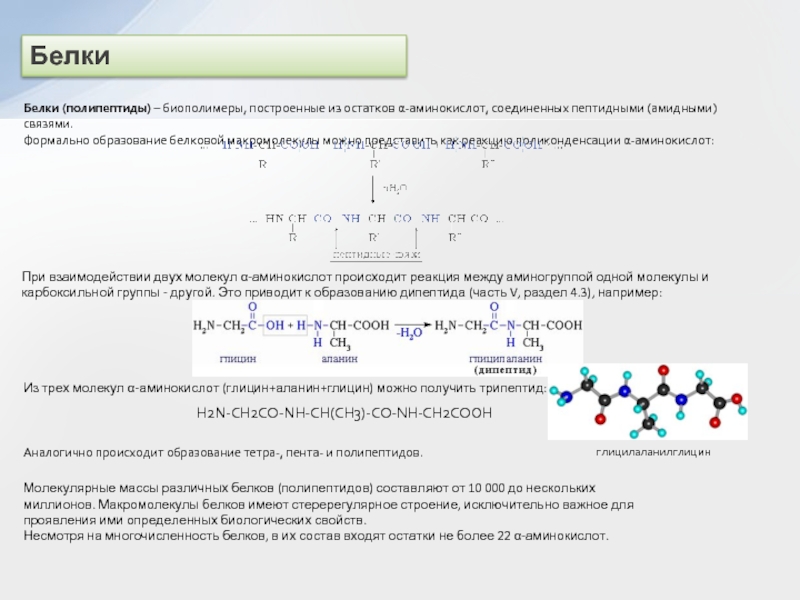
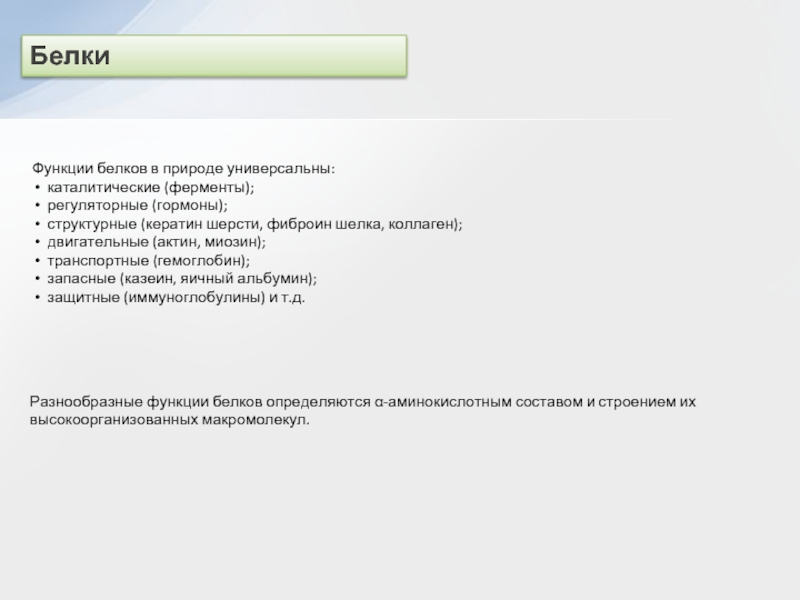
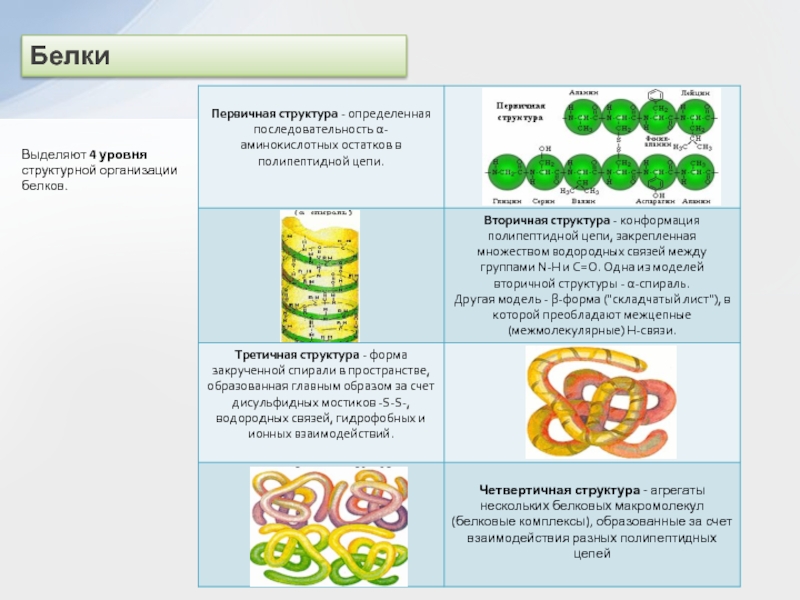
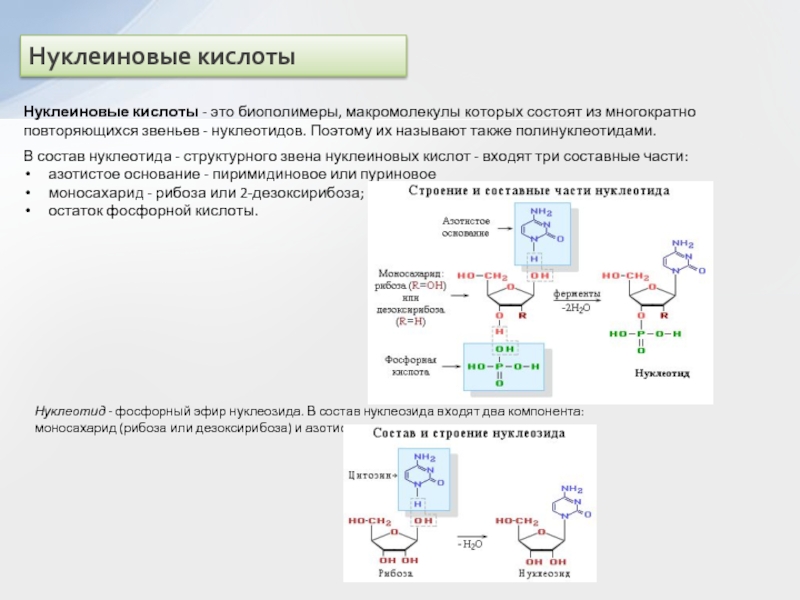
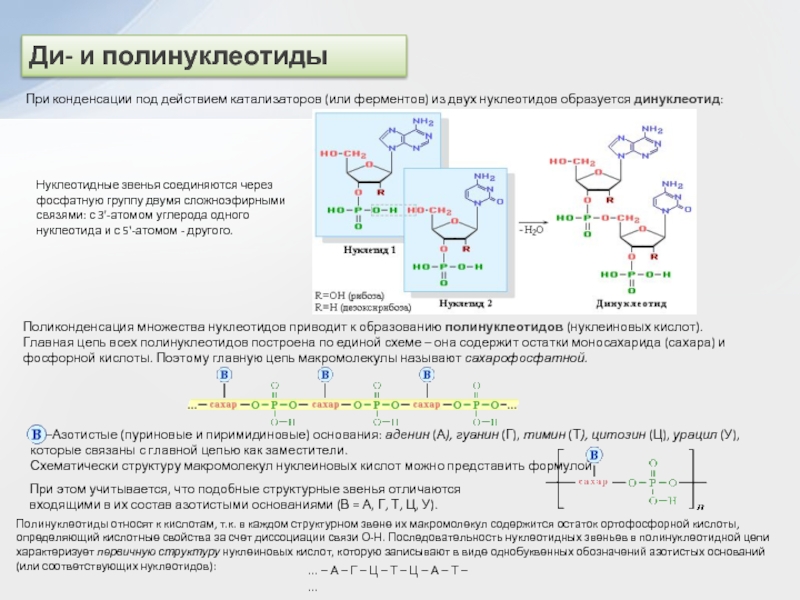
двух нуклеотидов образуется динуклеотид:
Нуклеотидные звенья соединяются через фосфатную группу двумя
сложноэфирными связями: с 3'-атомом углерода одного нуклеотида и с 5'-атомом - другого.
Поликонденсация множества нуклеотидов приводит к образованию полинуклеотидов (нуклеиновых кислот).
Главная цепь всех полинуклеотидов построена по единой схеме – она содержит остатки моносахарида (сахара) и фосфорной кислоты. Поэтому главную цепь макромолекулы называют сахарофосфатной.
–Азотистые (пуриновые и пиримидиновые) основания: аденин (А), гуанин (Г), тимин (Т), цитозин (Ц), урацил (У), которые связаны с главной цепью как заместители.
Схематически структуру макромолекул нуклеиновых кислот можно представить формулой:
При этом учитывается, что подобные структурные звенья отличаются входящими в их состав азотистыми основаниями (В = А, Г, Т, Ц, У).
Полинуклеотиды относят к кислотам, т.к. в каждом структурном звене их макромолекул содержится остаток ортофосфорной кислоты, определяющий кислотные свойства за счет диссоциации связи О-Н. Последовательность нуклеотидных звеньев в полинуклеотидной цепи характеризует первичную структуру нуклеиновых кислот, которую записывают в виде однобуквенных обозначений азотистых оснований (или соответствующих нуклеотидов):
... – А – Г – Ц – Т – Ц – А – Т – ...






![Химия. Азотсодержащие соединения Получение аминов3. Восстановление нитрилов с образованием первичных аминов:R-C N + 4[H] Получение аминов3. Восстановление нитрилов с образованием первичных аминов:R-C N + 4[H] R-CH2NH2 Этим способом в](/img/thumbs/3ca04311c9e39bf506976d794c84305c-800x.jpg)