Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хлор
Содержание
- 1. Хлор
- 2. Положение в таблице Строение атома Физические свойства История открытия Минералы Получение Химические свойства Применение
- 3. Положение в таблицеХлор - химический элемент седьмой
- 4. Слайд 4
- 5. Строение атомаЗаряд ядра +17, электронная конфигурация внешней
- 6. Слайд 6
- 7. ВозбужденияВ невозбужденном состоянии галогены имеют валентность, равную
- 8. Слайд 8
- 9. Молекула хлора двухатомна. Связь одинарна и образуется
- 10. Физические свойстваС возрастанием молекулярной массы температуры плавления
- 11. Физические свойстваХлор – ядовитый газ желто-зеленого цвета с
- 12. Физические свойства
- 13. История открытияПервым из галогенов был открыт хлор
- 14. В природе встречается два стабильных изотопа хлора:35Cl
- 15. МинералыКаменная соль = поваренная соль = галитКарналлитСильвин
- 16. ПолучениеОсновной промышленный способ получения хлора – электролиз
- 17. Получение2KMnO4+16HCl (конц.)= 2KCl + 2MnCl2 + 8H2O + 5Cl2
- 18. Химические свойстваХлор – активный окислитель. Энергично реагирует с
- 19. Хлор - один из самых активных неметаллов.
- 20. Cu+Cl2=CuCl22Fe+3Cl2 = 2FeCl3
- 21. H2 + Cl2 = 2 HCl(на свету)
- 22. Образует соединения с другими галогенами:Cl2 + F2
- 23. Хлор растворяется вводе (в 1 объеме воды
- 24. С Бескислородными КислотамиCl2 + HBr = 2HCl
- 25. Хлор в органикеХлор является активным реагентом в
- 26. Применение хлораХлор применяют во многих отраслях промышленности,
- 27. Для обеззараживания воды — «хлорирования». В
- 28. Производство хлорорганических инсектицидов — веществ, убивающих
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Положение в таблице
Хлор - химический элемент седьмой группы, главной подгруппы,
третьего периода периодической системы элементов Д. И. Менделеева, порядковый номер
17, относительная атомная масса 35,4527, относится к галогенам.Общее название элементов VIIA группы – галогены – происходит от греческих слов – "галс" – соль и "генес" – рождающий, т. е. "солероды". У галогенов наиболее ярко по сравнению с остальными элементами выражены свойства неметаллов. Говорят, галогены – типичные неметаллы.
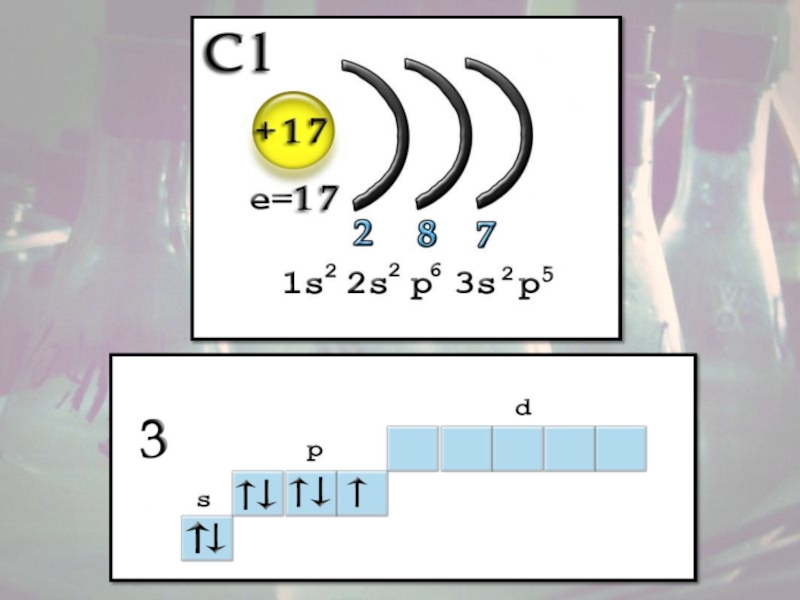
Слайд 5Строение атома
Заряд ядра +17, электронная конфигурация внешней электронной оболочки атома:
3s23p5. Хлор проявляет степени окисления –1, +1, +3, +5, +7 (+4,
+6 – редко).При движении по группе сверху вниз число энергетических уровней увеличивается, значит увеличивается
радиус атома и ослабляется связь валентных электронов с ядром. Таким образом, среди галогенов самый маленький атом у фтора и самый большой у астата. Легче всего оторвать электрон от атома At и труднее – от атома F.
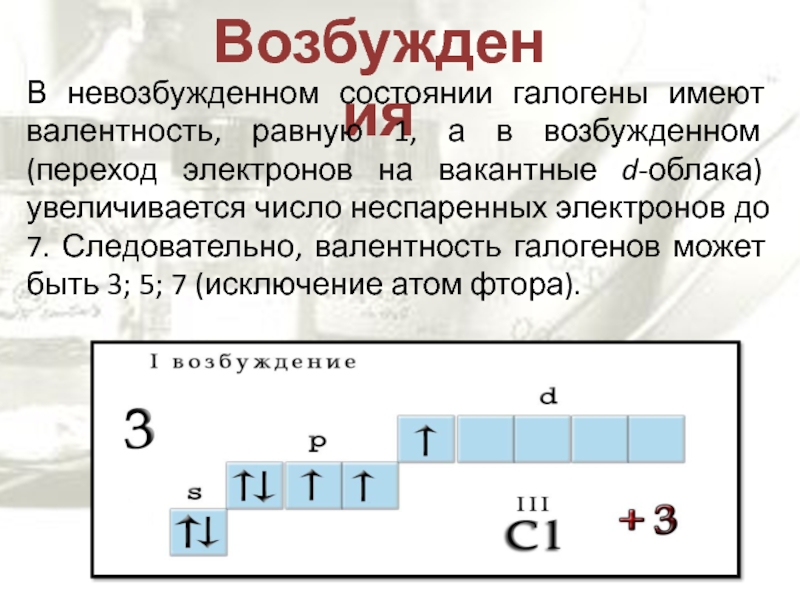
Слайд 7Возбуждения
В невозбужденном состоянии галогены имеют валентность, равную 1, а в
возбужденном (переход электронов на вакантные d-облака) увеличивается число неспаренных электронов
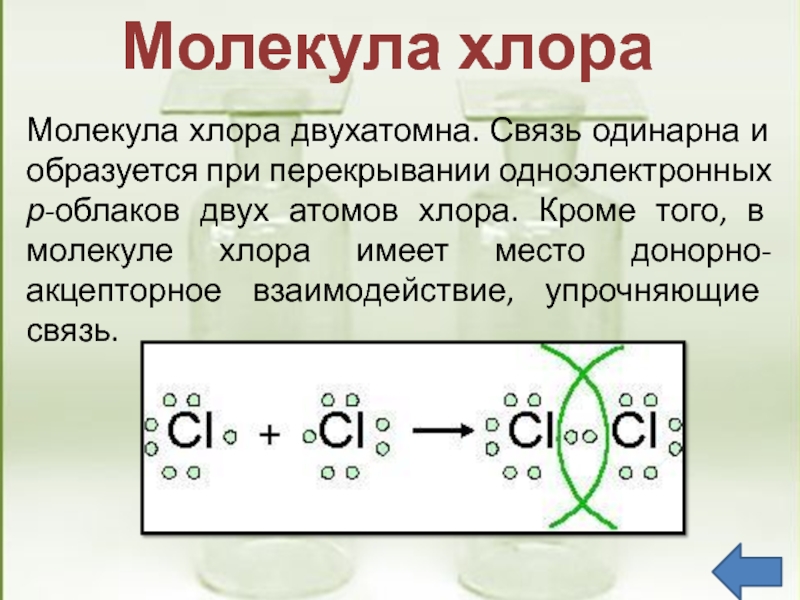
до 7. Следовательно, валентность галогенов может быть 3; 5; 7 (исключение атом фтора).Слайд 9Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных
р-облаков двух атомов хлора. Кроме того, в молекуле хлора имеет
место донорно-акцепторное взаимодействие, упрочняющие связь.Молекула хлора
Слайд 10Физические свойства
С возрастанием молекулярной массы температуры плавления и кипения веществ,
состоящих из молекул одинакового строения, повышаются.
Все галогены окрашены: фтор – светло-желтый,
хлор – желтовато-зеленый, бром – красно-коричневый, йод – серо-фиолетовый.За исключением фтора, который бурно реагирует с водой, галогены мало растворимы в воде. Чтобы приготовить концентрированный раствор, используют другие растворители. Водные растворы галогенов называются соответственно хлорной, бромной и йодной водой, в них галогены сохраняют в значительной мере свои свойства.
Слайд 11Физические свойства
Хлор – ядовитый газ желто-зеленого цвета с резким запахом. Это
первое химическое оружие. Во время Первой мировой войны 1914–1918 гг.
его применяли в качестве боевого отравляющего вещества. Хлор тяжелее воздуха в2,5 раза, поэтому стелется по земле и в виде газового облака переносится ветром на значительные расстояния. Хлор вызывает раздражение дыхательных путей, а вдыхание большого его количества вызывает смерть от удушья. При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение 5 минут.
Слайд 13История открытия
Первым из галогенов был открыт хлор (К. Шееле, 1774
год). Полученный желто-зеленый газ шведский ученый принял за сложное вещество.
Лавуазье и Бертолле считали, что этот газ является оксидом неизвестного элемента "мурия".В 1807 году английский химик Гемфри Дэви получил тот же газ, что и Шееле. Три года пытался Дэви выделить из него "мурий", но безуспешно. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" – желто-зеленый). Через пять лет Гей-Люсак дал газу название хлор. В жидком виде хлор был впервые получен в 1823 году М. Фарадеем.
Слайд 14В природе встречается два стабильных изотопа хлора:35Cl (75,77%) и 37Cl
(24,23%).
Содержание хлора в земной коре составляет 1,7% (по массе). Важнейшие
минералы: галит NaCl, сильвин KCl, бишофит MgCl2·H2O, сильвинит KCl·NaCl, карналлит KCl·MgCl2·6H2O. Кроме того, он содержится в виде соединений в морской, речной, озерной водах. Важнейший биоэлемент, необходим для нормальной жизнедеятельности организма. В живом организме содержится 0,15 % от массы тела, входит в состав клеточной и других биологических жидкостей (желудочный сок, плазма).Распространение в природе
Слайд 16Получение
Основной промышленный способ получения хлора – электролиз хлоридов щелочных металлов
(NaCl, KCl). Также его получают окислением HCl кислородом воздуха в
присутствии катализаторов – хлорида меди (II) и хлорида железа (III):4HCl + O2 = 2Cl2 + 2H2O
В лаборатории молекулярный хлор получают взаимодействием HCl с перманганатом калия, оксидом марганца (IV), бихроматом калия и др.:
2KMnO4+16HCl (конц.) = 2KCl+2MnCl2+8H2O+5Cl2
При нагревании:
MnO2 + 4 HCl = MnCl2 + Cl2 + 2 H2O
6HCl + KClO3 = 3Cl2 + KCl + 3H2O
Слайд 18Химические свойства
Хлор – активный окислитель. Энергично реагирует с металлами и большинством
неметаллов (за исключением O2, N2 и благородных газов). Вступает также
в реакции диспропорционирования, для протекания которых наиболее благоприятна щелочная среда, способствующая образованию простых и сложных анионов.Слайд 19Хлор - один из самых активных неметаллов. При взаимодействии с
металлами с переменной валентностью (Fe, Cr) в отличие от соляной
кислоты заставляет их проявлять большую степень окисления:С Металлами
2Al + 3Cl2 = 2AlCl3
2K + Cl2 = 2 КCl
2 Fe + 3Cl2 = 2 FeCl3
Cu + Cl2 = CuCl2
Слайд 21H2 + Cl2 = 2 HCl(на свету)
С Неметаллами
2Cl2 + C = CCl4
3Cl2 + 2P (крист.) =
2PCl35 Cl2 + 2 P = 2PCl5
Слайд 22Образует соединения с другими галогенами:
Cl2 + F2 = 2ClF
Cl2 +
3F2 = 2ClF3, t = 200–400 °C
Cl2 + 5F2 = 2ClF5
5Cl2 + 2Sb
= 2SbCl5Слайд 23Хлор растворяется вводе (в 1 объеме воды растворяется 2 объема
хлора) с образованием "хлорной воды":
Cl2 + H2O = HCl +
HClOС Водой
Со щелочами
Cl2 + 2KOH(хол) = KCl + KClO(гипохлорит) + H2O
Cl2 + 6KOH(гор) = 5KCl + KClO3(хлорат) + 3H2O
Слайд 24С Бескислородными Кислотами
Cl2 + HBr = 2HCl + Br2
Cl2 +
HI = 2HCl + I2
Cl2 + 2NaI = 2NaCl +
I2Cl2 + FeCl2 = 2FeCl3
С Солями
Слайд 25Хлор в органике
Хлор является активным реагентом в органическом синтезе. Его
атомы входят в состав молекул соединений, относящихся к различным классам
органических веществ.CnH2n+2 + Cl2 (на свету) = CnH2n+1Cl + HCl [р. Семенова]
CnH2n + Cl2 = CnH2nCl2
CnH2n-2 + Cl2 – в несколько стадий
C6H6 + Cl2 (AlCl3) = C6H5Cl + HCl
C6H6 + Cl2 (на свету) = гексахлоран
Гомологи бензола + Cl2 (на свету) = замещение
по радикальному механизму (Cl к альфа-H)
5. R-CH2-COOH + Cl2 (PCl5) = R-CHCl-COOH + HCl
Слайд 26Применение хлора
Хлор применяют во многих отраслях промышленности, науки и бытовых
нужд:
Основным компонентом отбеливателей является хлорная вода
В производстве поливинилхлорида,
пластикатов, синтетического каучука, из которых изготавливают изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Слайд 27 Для обеззараживания воды — «хлорирования».
В химическом производстве соляной
кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
Слайд 28 Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов
насекомых, но безопасных для растений. На получение средств защиты растений
расходуется значительная часть производимого хлора. Использовался как оружие массового поражения и в производстве других отравляющих веществ массового поражения: иприт, фосген.