металдарының жалпы сипаттамасы
№6 есеп (164 бет)
Үй тапсырмасын қорытындылау
Жаңа сабақты түсіндіру
§
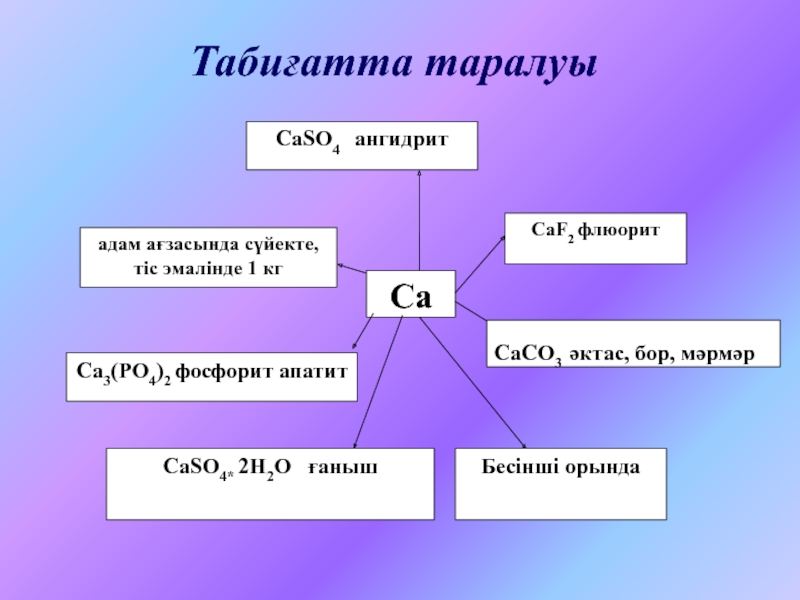
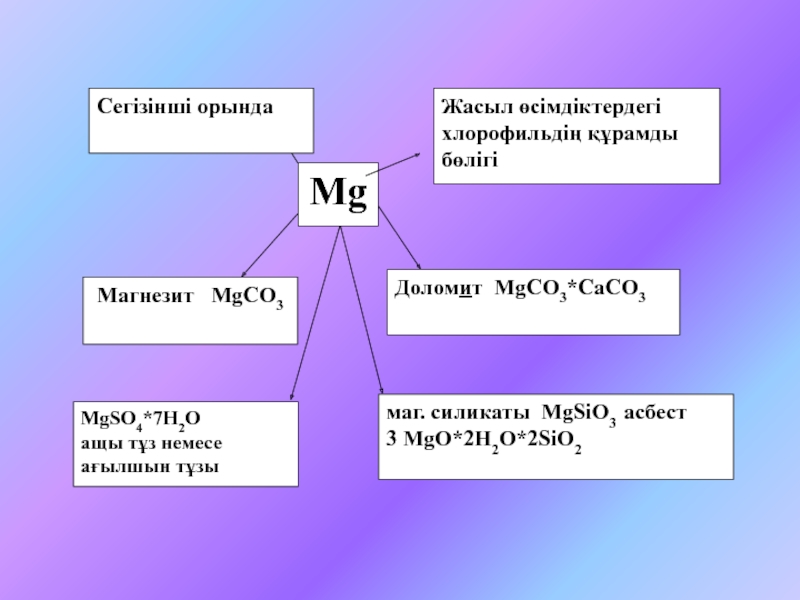
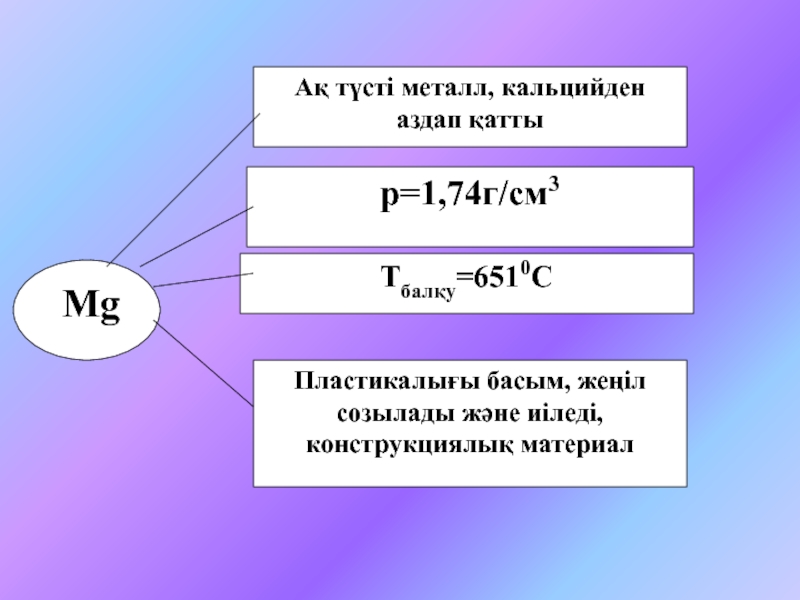
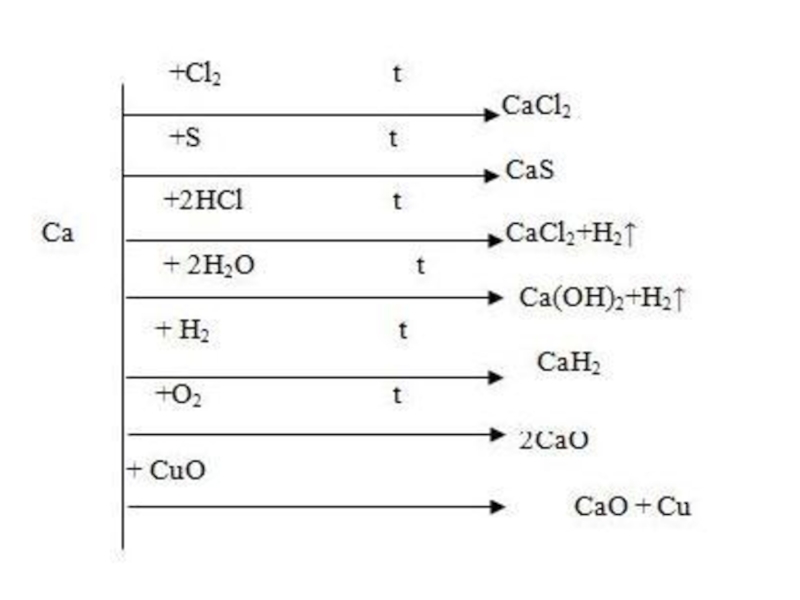
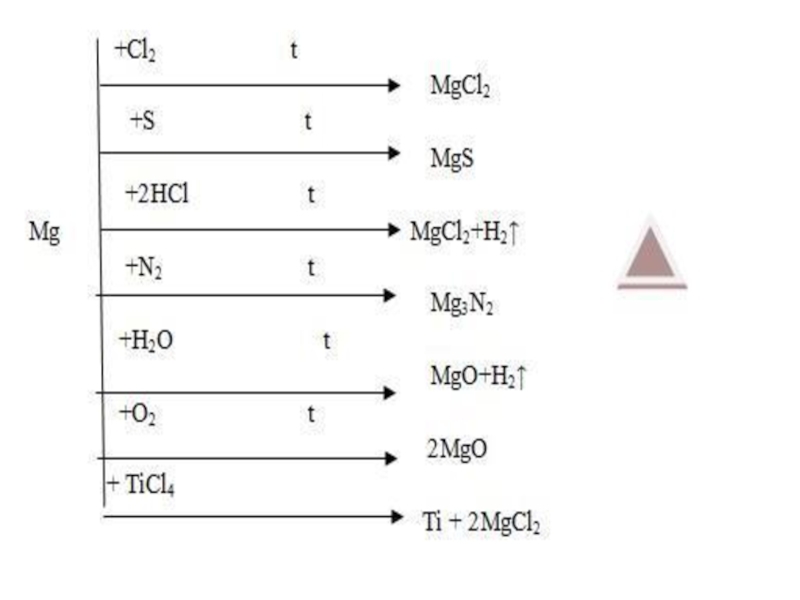
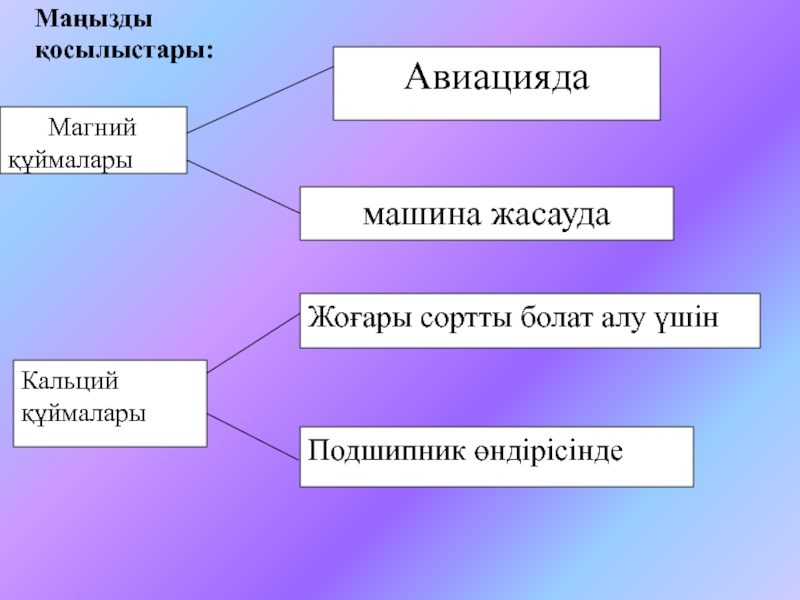
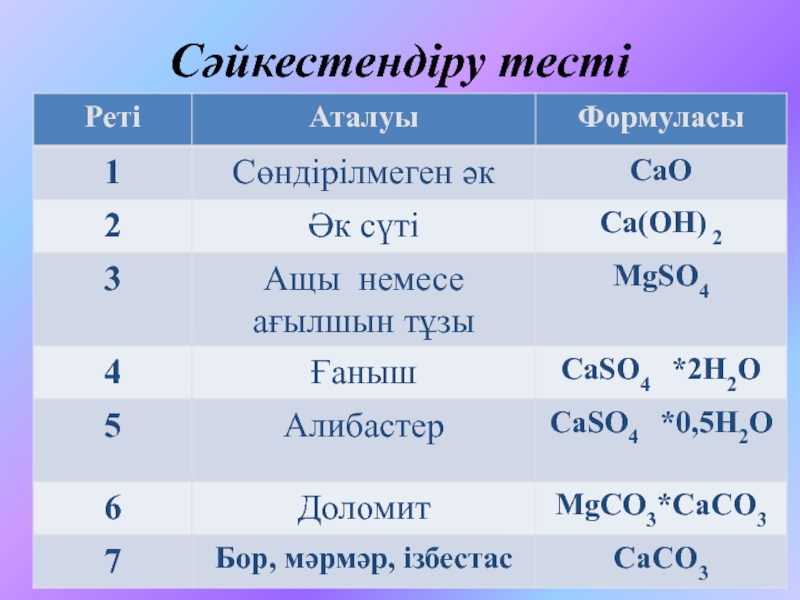
6.6. Магний және кальций§ 6.7. Кальций және магний қосылыстары. Олардың табиғаттағы және техникадағы рөлі
Жаңа сабақты бекіту
Үйге тапсырма беру
Оқушылардың білімін бағалау