Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обобщение, систематизация и коррекция знаний по органической химии.
Содержание
- 1. Обобщение, систематизация и коррекция знаний по органической химии.
- 2. ОСНОВНЫЕ ТЕМЫ ПОВТОРЕНИЯ:Органическая химия;Реакции органической химии;Насыщенные углеводороды;Альдегиды;Кетоны;Спирты и фенолы;Алканы.
- 3. ОРГАНИЧЕСКАЯ ХИМИЯ.Органических веществ очень много (около 10
- 4. РЕАКЦИИ ОРГАНИЧЕСКОЙ ХИМИИ.Название крупных классов органических реакций
- 5. НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫОсновные источники насыщенных углеводородов – нефть
- 6. АЛЬДЕГИДЫВосстановление. Альдегиды способны к восстановлению, основной продукт
- 7. ПОВТОРЯЕМ ФОРМУЛЫ
- 8. КЕТОНЫ.Существует три основных типа реакций кетонов.Первый связан
- 9. СПИРТЫ И ФЕНОЛЫ.Спиртами называют алифатические соединения, содержащие
- 10. ПОВТОРЯЕМ ФОРМУЛЫR = CH2–OH
- 11. АЛКАНЫ.Гомологический ряд алканов (первые 10 членов)Метан CH4
- 12. ДОРОГУ ОСИЛИТ ИДУЩИЙ! ЖЕЛАЮ ВСЕМ УДАЧИ
- 13. Скачать презентанцию
ОСНОВНЫЕ ТЕМЫ ПОВТОРЕНИЯ:Органическая химия;Реакции органической химии;Насыщенные углеводороды;Альдегиды;Кетоны;Спирты и фенолы;Алканы.
Слайды и текст этой презентации
Слайд 1ОБОБЩЕНИЕ, СИСТЕМАТИЗАЦИЯ И КОРРЕКЦИЯ ЗНАНИЙ ПО ОРГАНИЧЕСКОЙ ХИМИИ.
Лысюк Ольга Сергеевна,
учитель химии МБОУ «СОШ№2» г. Усинска
Слайд 2ОСНОВНЫЕ ТЕМЫ ПОВТОРЕНИЯ:
Органическая химия;
Реакции органической химии;
Насыщенные углеводороды;
Альдегиды;
Кетоны;
Спирты и фенолы;
Алканы.
Слайд 3ОРГАНИЧЕСКАЯ ХИМИЯ.
Органических веществ очень много (около 10 млн.). Они построены
гораздо сложнее, чем неорганические вещества,
и поэтому их свойства
заметно отличаются от свойств неорганических соединений: температуры плавления и кипения органических соединений значительно ниже; разлагаются и обугливаются, как правило, при более низких температурах; большинство органических веществ реагирует между собой гораздо медленнее, чем неорганическое вещества. Органические соединения (как природные так и синтетические) играют большую в жизни человека. Это пища, топливо, натуральные и искусственные ткани, каучуки, красители, лекарства. Многие органические вещества тесно связаны с процессами жизнедеятельности животных и растительных организмов (например белки, нуклеиновые кислоты). Успехи современной органической химии огромны. Органический синтез позволил получить довольно сложные соединения - некоторые гормоны, ферменты, витамины, красители. Еще более трудные задачи встанут перед органической химией завтра, когда химики смогут синтезировать более сложные органические соединения. Органические вещества используются практически во всех отраслях промышленности: пищевой, лакокрасочной, текстильной, фармацевтической, кожевенной и т.д. Без органической химии нельзя сегодня представить современную медицину, сельское хозяйство, машиностроение и транспорт, электропромышленность, строительство.Слайд 4РЕАКЦИИ ОРГАНИЧЕСКОЙ ХИМИИ.
Название крупных классов органических реакций часто связывают с
химической природой действующего реагента или с типом вводимой в соединение
органической группы:а) галогенирование – введение атома галогена;
б) гидрохлорирование, т.е. воздействие HCl;
в) нитрование – введение нитрогруппы NO2;
г) металлирование – введение атома металла;
д) алкилирование – введение алкильной группы;
е) ацилирование – введение ацильной группы RC(O).
Крупный класс образуют реакции конденсации. При которых происходит формирование новых связей С-С с одновременным образованием легко удаляемых неорганических или органических соединений. Конденсацию, сопровождаемую выделением воды, называют дегидратацией. Конденсационные процессы могут также проходить внутримолекулярно, то есть, в пределах одной молекулы.
Слайд 5НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
Основные источники насыщенных углеводородов – нефть и природный газ.
Реакционная способность насыщенных углеводородов очень низкая, они могут реагировать только
с наиболее агрессивными веществами, например, с галогенами или с азотной кислотой. При нагревании насыщенных углеводородов выше 450 С° без доступа воздуха разрываются связи С-С и образуются соединения с укороченной углеродной цепью. Высокотемпературное воздействие в присутствии кислорода приводит к их полному сгоранию до СО2 и воды, что позволяет эффективно использовать их в качестве газообразного или жидкого моторного топлива.При замещении одного или нескольких атомов водорода какой-либо функциональной группой образуются соответствующие производные углеводородов. Соединения, содержащие группировку С-ОН, называют спиртами, НС=О – альдегидами, СООН – карбоновыми кислотами (слово «карбоновая» добавляют для того, чтобы отличить их от обычных минеральных кислот, например, соляной или серной). Соединение может содержать одновременно различные функциональные группы, например, СООН и NH2, такие соединения называют аминокислотами. Введение в состав углеводорода галогенов или нитрогрупп приводит соответственно к галоген- или нитропроизводным
Слайд 6АЛЬДЕГИДЫ
Восстановление. Альдегиды способны к восстановлению, основной продукт восстановления — первичные
спирты.
Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие
карбоновые кислоты.Реакция «серебряного зеркала». Альдегид + Ag2O (в аммиачном растворе) = Кислота + 2Ag.
Реакция «медного зеркала». Окислителем здесь выступает Cu(OH)2, гидроксид меди (II)
R—COH + 2Cu(OH)2 → R—COOH + Cu2O + 2H2O
Присоединение синильной кислоты. Используется для удлинения углеродной цепи.
R—COH + HCN → R-CH(OH)-CN
Присоединение гидросульфита натрия. Используется для выделения альдегидов из растворов.
R—COH + NaHSO3 → R-CH(OH)-SO3Na
Слайд 8КЕТОНЫ.
Существует три основных типа реакций кетонов.
Первый связан с нуклеофильной атакой
по атому углерода карбонильной группы.
Взаимодействие со спиртами:
CH3COCH3 + 2C2H5OH
→ C2H5—O—C(CH3)2—O—C2H5c реактивами Гриньяра:
C2H5—C(O)—C2H5 + C2H5MgI → (C2H5)3—COMgI → (C2H5)3—COH, третичный спирт. Реакции с альдегидами, и особенно с метаналем идут заметно активнее, при этом с альдегидами образуются вторичные спирты, а с метаналем — первичные.
Также кетоны реагируют с азотистыми основаниями, например, с аммиаком и первичными аминами с образованием иминов:
CH3—C(O)—CH3 + CH3NH2 → CH3—C(N—CH3)—CH3 + H2O
Второй тип реакций — депротонирование бета-углеродного атома, по отношению к карбонильной группе. Образующийся карбанион стабилизирован за счёт сопряжения с карбонильной группой, лёгкость удаления протона возрастает, поэтому карбонильные соединения являются сравнительно сильными С—Н кислотами.
Третий — координация электрофилов по неподелённой паре атома кислорода, например, таких кислот Льюиса, как AlCl3.
Слайд 9СПИРТЫ И ФЕНОЛЫ.
Спиртами называют алифатические соединения, содержащие гидроксильную группу (алканолы,
алкенолы, алкинолы); гидроксиарены или ароматические гидроксипроизводные называются фенолами. Название спирта
образуется прибавлением суффикса -ол к названию соответствующего углеводорода или на основе углеводородного радикала. В зависимости от строения углеводородного радикала различают спирты: первичные, вторичные, третичные.Фенолы характеризуются более сильными кислотными свойствами, чем спирты, последние в водных растворах не образуют карбониевые ионы AIk – O–, что связано с меньшим поляризующим действием (электроакцепторными свойствами акильных радикалов по сравнению с ароматическими).
Спирты и фенолы тем не менее легко образуют водородные связи, поэтому все спирты и фенолы имеют более высокие температуры кипения, чем соответствующие углеводороды.
Если углеводородный радикал не обладает ярко выраженными гидрофобными свойствами, то эти спирты хорошо растворяются в воде. Водородная связь обусловливает способность спиртов переходить при отвердении в стеклообразное, а не кристаллическое состояние.
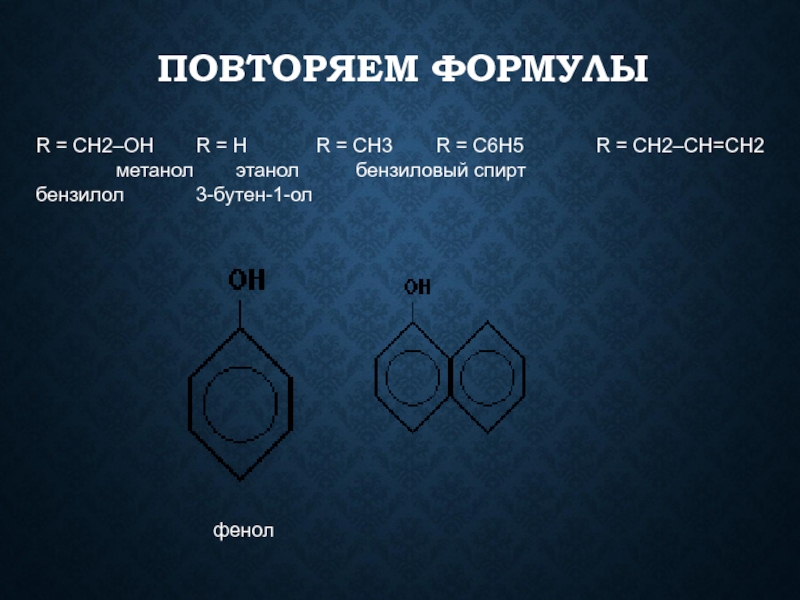
Слайд 10ПОВТОРЯЕМ ФОРМУЛЫ
R = CH2–OH R = H
R = CH3 R
= C6H5 R = CH2–CH=CH2метанол этанол бензиловый спирт
бензилол 3-бутен-1-ол
фенол