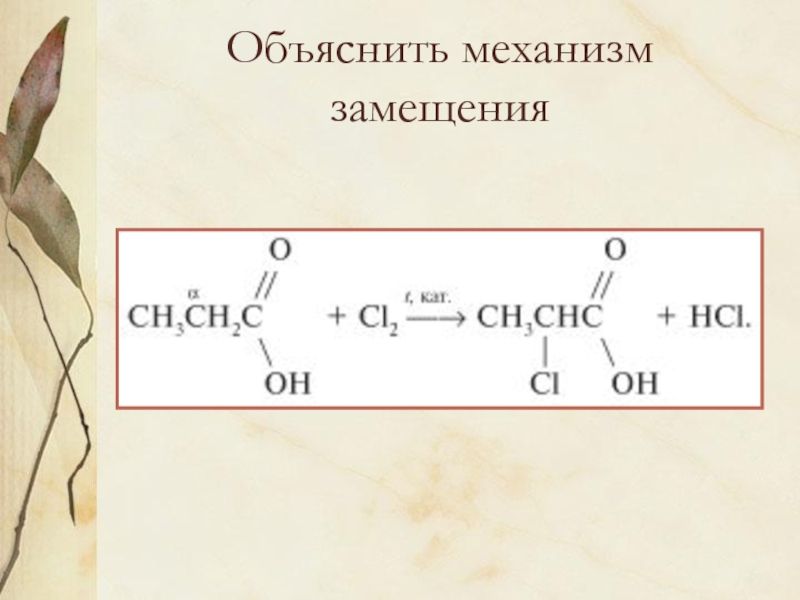
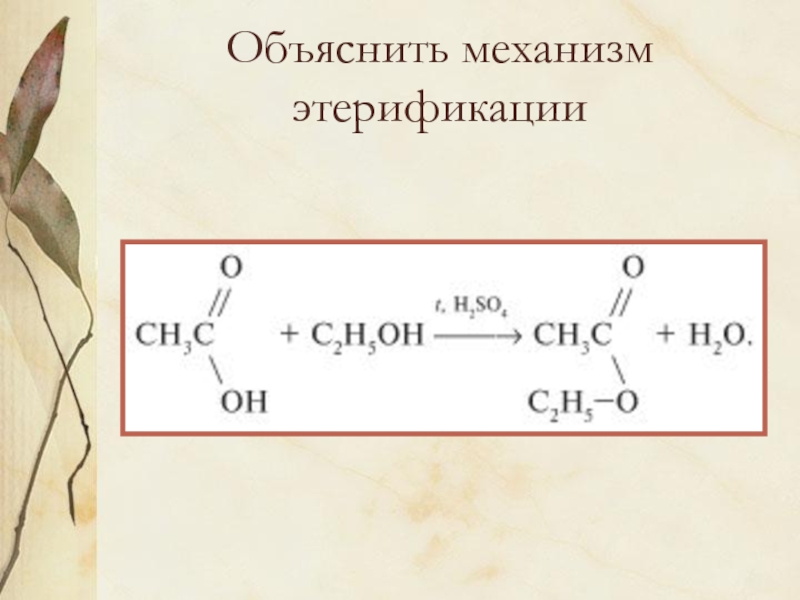
Слайд 1Карбоновые кислоты.
Электронные эффекты и взаимное влияние атомов.
Элективное занятие по органической
химии
В 10 классе естественнонаучного профиля
Автор: Ким Н.В.
учитель химии
МОУСОШ №6 г.
Нягани
ХМАО-Югры
Тюменской области, 2010 год.
Слайд 2
КИСЛОТЫ БРЕНСТЕДА
Для характеристики кислотности и основности органических соединений
применяют теорию Бренстеда.
Основные положения этой теории.
Кислота – это частица, отдающая
протон (донор Н+);
основание – это частица, принимающая протон (акцептор Н+).
Кислотность всегда характеризуется в присутствии оснований и наоборот.
А-Н(кислота) +В(основание) → А (сопряженное основание) + В-Н+ (сопряженная кислота).
Слайд 3 Кислоты Бренстеда делятся на 4 вида в зависимости от
кислотного центра:
1) SH-кислоты (тиолы);
2) ОН-кислоты (спирты, фенолы, карболовые кислоты);
3) НN-кислоты (амины, амиды);
4) Ф-СН-кислоты (УВ).
В этом ряду сверху вниз кислотность уменьшается
Слайд 4 Сила кислоты определяется стабильностью образующегося аниона.
Чем стабильнее анион, тем сильнее кислота.
Стабильность аниона зависит от делокализации (распределения) «отрицательного» заряда по всей частице (аниону).
Чем больше делокализован «отрицательный» заряд, тем стабильнее анион и сильнее кислота.
Слайд 5
Делокализация заряда зависит:
1) от электроотрицательности (ЭО) гетероатома.
Чем больше ЭО гетероатома, тем сильнее соответствующая кислота.
Например: R-OH
и R-NH2.
Спирты более сильные кислоты, чем амины, т. к. ЭО (О) → ЭО(N);
Слайд 6
Делокализация заряда зависит
2) от поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем
сильнее соответствующая кислота. Например: R-SH и R-ОН.
Тиолы более
сильные кислоты, чем спирты,
т. к. атом S более поляризован, чем атом О;
Слайд 7 Делокализация заряда зависит:
3) от характера заместителя R
(его
длины, наличия сопряженной системы, делокализации электронной плотности).
Например:
СН3-ОН,
СН3-СН2-ОН, СН3-СН2-СН2-ОН. Кислотность меньше, так как увеличивается длина радикала.
Слайд 8Сравнение кислотности
При одинаковом кислотном центре сила спиртов, фенолов и карбоновых
кислот не одинакова.
Фенолы являются более сильными кислотами, чем спирты
за счет р, s-сопряжения (+М) группы (-ОН). Связь О—Н более поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями (FeCl3) – качественная реакция на фенолы.
Слайд 9Сравнение кислотности
Карбоновые кислоты по сравнению со спиртами, содержащими одинаковый R,
являются более сильными кислотами, так как связь О—Н значительно поляризована
за счет( – М)-эффекта группы > С = О.
Кроме того, карбоксилат-анион более стабилен, чем анион спирта за счет р, s-сопряжения в карбоксильной группе;
Слайд 10Делокализация заряда зависит
4) от введения заместителей в радикал. ЭА-заместители (электроноакцепторные) увеличивают
кислотность, ЭД-заместители уменьшают кислотность;
5) от характера растворителя.
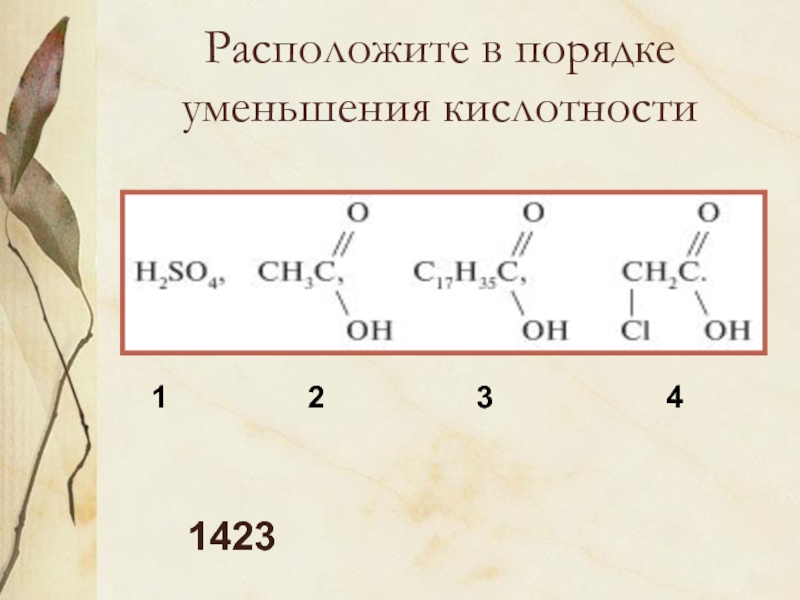
Слайд 12Расположите в порядке уменьшения кислотности
1
2
3
4
1423
Слайд 14Тест ЕГЭ - 2006
1. Среди следующих веществ наиболее выраженные кислотные
свойства проявляет:
а) фенол
в) вода
б) 2,4,6-тринитрофенол г) этанол.
б
2. Даны вещества: 1) уксусная кислота;
2) угольная кислота; 3) пропионовая кислота;
4) фенол; 5) этанол; 6) хлоруксусная кислота.
Расположите номера этих веществ в порядке усиления их кислотных свойств в водных растворах.
542316
Слайд 15Использованные источники
1. Габриелян О.С., Остроумов И.Г., Карцова А.А. Органическая химия.
– Москва. Просвещение. 2004.
2. Габриелян О.С., Остроумов И.Г. Настольная книга
учителя. Химия.- Москва. Дрофа. 2004.
3. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии (в двух томах). – Москва. Экзамен. 2004.
4. Потапов В.М., Чертков И.Н. Строение и свойства органических соединений. – Москва. Просвещение, 1984.
5. Книга для чтения по органической химии (Сост. П.Ф.Буцкус). – Москва. Просвещение. 1985.
6. Методические указания по органической химии для слушателей вечерней химической школы. (МХТИ им. Д.И.Менделеева). – Москва. 1990.
http://www.chemistry.ssu.samara.ru/chem5/index5.htm