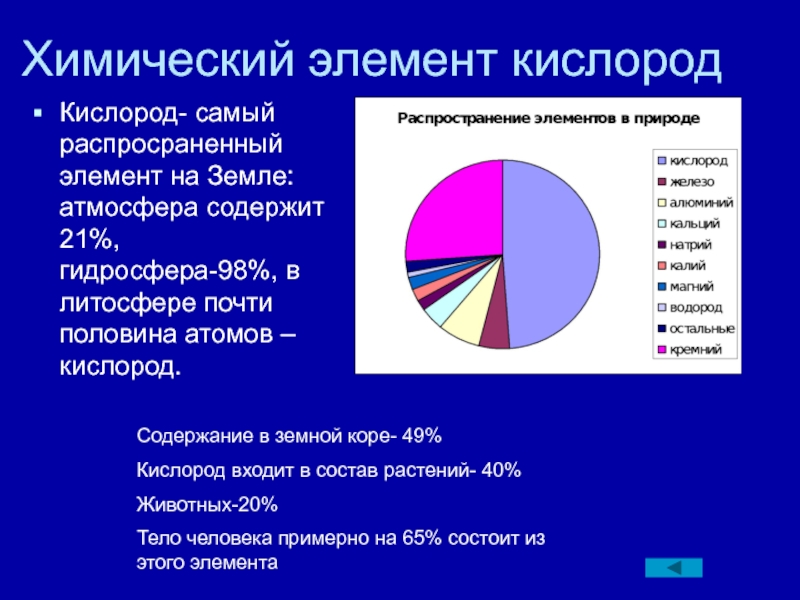
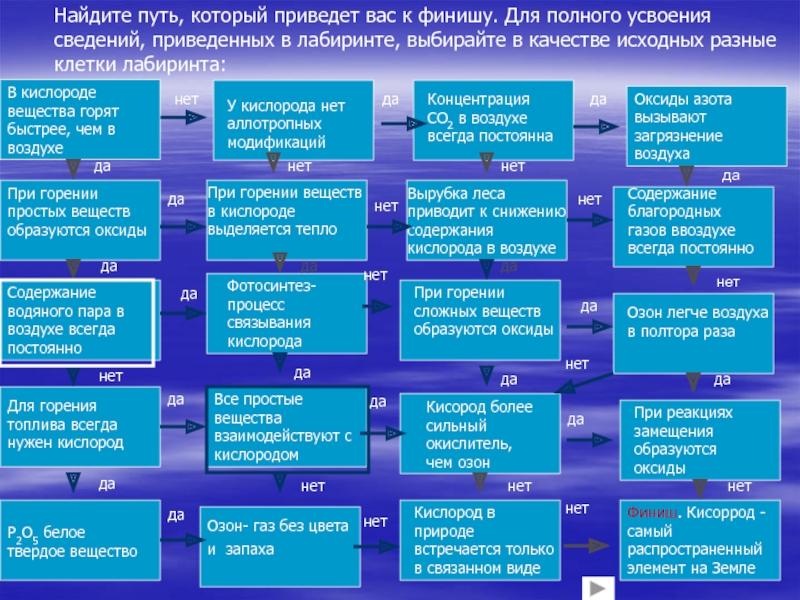
сведений, приведенных в лабиринте, выбирайте в качестве исходных разные клетки
лабиринта:
В кислороде вещества горят быстрее, чем в воздухе
У кислорода нет аллотропных модификаций
При горении простых веществ образуются оксиды
При горении веществ в кислороде выделяется тепло
Концентрация СО2 в воздухе всегда постоянна
Оксиды азота вызывают загрязнение воздуха
Содержание благородных газов ввоздухе всегда постоянно
Вырубка леса приводит к снижению содержания кислорода в воздухе
нет
да
да
да
Содержание водяного пара в воздухе всегда постоянно
Фотосинтез- процесс связывания кислорода
При горении сложных веществ образуются оксиды
Озон легче воздуха в полтора раза
Для горения топлива всегда нужен кислород
Все простые вещества взаимодействуют с кислородом
Кисород более сильный окислитель, чем озон
При реакциях замещения образуются оксиды
P2O5 белое твердое вещество
Озон- газ без цвета и запаха
Кислород в природе встречается только в связанном виде
Финиш. Кисоррод - самый распространенный элемент на Земле
нет
нет
нет
да
нет
да
нет
нет
да
нет
да
да
да
да
да
нет
да
нет
да
да
нет
да
да
нет
да
нет
да
нет