Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
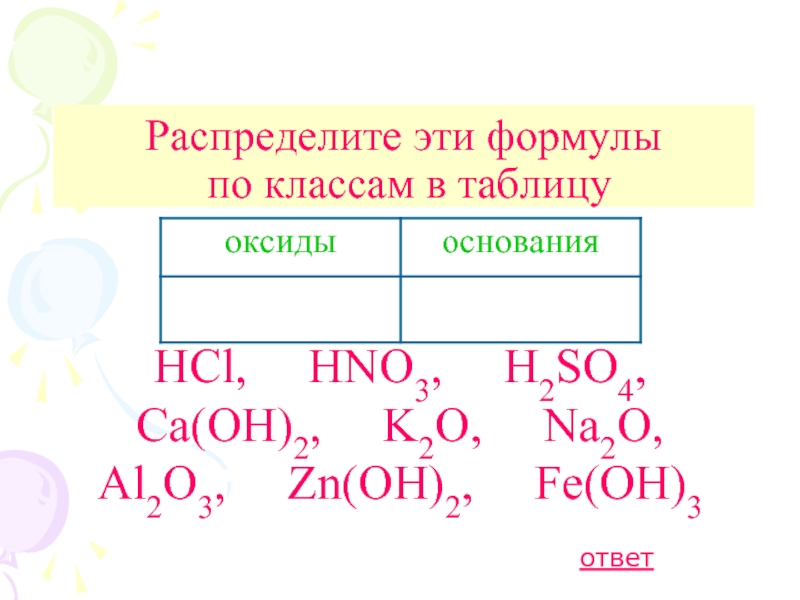
Кислоты, их классификация и свойства
Содержание
- 1. Кислоты, их классификация и свойства
- 2. Класификация: При обычныхусловиях кислоты могут быть
- 3. 1. Кислородсодержащие ( фосфорная, азотная).2. Бескислородные (соляная, сероводородная).
- 4. III. Основность.1. Одноосновные ( соляная, азотная).2. Двухосновные (сероводородная, серная).3. Трёхосновные (фосфорная).
- 5. IV. Растворимость в воде.1. Растворимые ( серная, сероводородная, азотная).2. Нерастворимые ( кремниевая).
- 6. V. Летучесть.1. Летучие ( сероводородная, соляная, азотная),
- 7. VI. Степень электролитической диссоциации.1. Сильные ( серная, соляная, азотная).2. Слабые ( сероводородная, сернистая, угольная).
- 8. VII. Стабильность.1. Стабильные (серная, фосфорная, соляная).2. Нестабильные (сернистая, угольная, кремнивая).
- 9. Типичные реакции кислот.1. Кислота + основание. HCl
- 10. 3. Кислота + металл а) металл стоит
- 11. в) для растворов кислот ( т.е. для
- 12. 4. Кислота + соль.Протекает только в случае,
- 13. Основания, их классификация и свойства.
- 14. Классификация оснований.Растворимость в воде: растворимые ( NaOH,
- 15. Физические свойства.Твёрдые вещества, имеют различную окраску.Состоят из
- 16. Типичные реакции оснований.Основание + кислота → соль
- 17. 3. Щёлочь + соль → новое основание
- 18. Скачать презентанцию
Класификация: При обычныхусловиях кислоты могут быть : твёрдыми ( фосфорная, кремниевая), жидкими (серная кислота) и газообразными ( хлороводород, бромоводород, сероводород), которые в водных растворах образуют кислоты.
Слайды и текст этой презентации
Слайд 4III. Основность.
1. Одноосновные ( соляная, азотная).
2. Двухосновные (сероводородная, серная).
3. Трёхосновные
(фосфорная).
Слайд 5IV. Растворимость в воде.
1. Растворимые ( серная, сероводородная, азотная).
2. Нерастворимые
( кремниевая).
Слайд 6V. Летучесть.
1. Летучие ( сероводородная, соляная, азотная), легко переходят в
газообразное состояние, т.е. испаряются.
2. Нелетучие ( серная, кремниевая, фосфорная).
Слайд 7VI. Степень электролитической диссоциации.
1. Сильные ( серная, соляная, азотная).
2. Слабые
( сероводородная, сернистая, угольная).
Слайд 8VII. Стабильность.
1. Стабильные (серная, фосфорная, соляная).
2. Нестабильные (сернистая, угольная, кремнивая).
Слайд 9Типичные реакции кислот.
1. Кислота + основание.
HCl + NaOH =
NaCl + H2O
2. Кислота + оксид металла.
СuO +
H2SO4 = CuSO4 + H2OСлайд 103. Кислота + металл
а) металл стоит до водорода
Zn
+ 2HCl = ZnCl2 + H2
б) должна получиться растворимая
соль( если соль нерастворима, то реакция прекращается, т.к. соль покрывает поверхность металла оксидной плёнкой).Слайд 11в) для растворов кислот ( т.е. для растворимых в воде).
г)
концентрированные кислоты ( серная, азотная) взаимодействуют иначе.
Слайд 124. Кислота + соль.
Протекает только в случае, если образуется:
а)
осадок
H2SO4 + BaCl2 = BaSO4 + 2HCl
б) газ
2HNO3
+ CaCO3 = Ca(NO3)2 + H2O + CO2
Слайд 14Классификация оснований.
Растворимость в воде:
растворимые ( NaOH, KOH)
нерастворимые (Cu(OH)2, Fe(OH)2
)
Степень электролитической диссоциации:
сильные (щёлочи)
слабые (нерастворимые основания)
3. Кислотность (число гидроксогрупп)
однокислотные
двухкислотные
Слайд 15Физические свойства.
Твёрдые вещества, имеют различную окраску.
Состоят из ионов металла и
гидроксогрупп,
Число гидроксогрупп равно степени окисления металла,
Образуют при диссоциации гидроксид
ионы ( OH- ), которые обусловливают ряд свойств: мылкость, изменение окраски индикатора, взаимодействие с другими веществами.Слайд 16Типичные реакции оснований.
Основание + кислота → соль + вода
( реакция нейтрализации)
NaOH + HNO3 → NaNO3 + HOH
Щёлочь
+ оксид неметалла → соль + водаNaOH + N2O3 → NaNO2 + HOH
Слайд 173. Щёлочь + соль → новое основание + новая соль
(протекает если образуется осадок или газ)
2KOH + CuSO4 → Cu(OH)2
+ K2SO4NaOH +NH4Cl → NaCl + NH3 + HOH
Теги