Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Коррозия металлов
Содержание
- 1. Коррозия металлов
- 2. Слайд 2
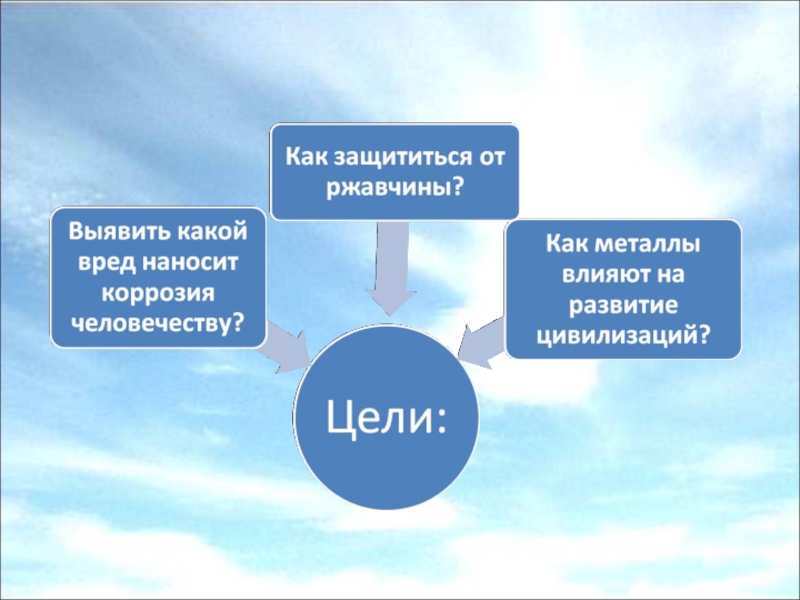
- 3. Задачи: Выяснить, что влияет на коррозию железаУзнать,
- 4. Содержание 1. Введение2. Коррозия металлов3.Классификация видов коррозии4.Сущность
- 5. Корро́зия (от лат. corrosio — разъедание) — это
- 6. Виды коррозий газовая коррозия;атмосферная коррозия;коррозия в неэлектролитах;коррозия в электролитах;подземная коррозия;биокоррозия;коррозия под воздействием блуждающих токов.
- 7. Химическая коррозия. Химическая коррозия — разрушение металла в
- 8. Из жизненного опыта мы знаем, что предметы,
- 9. Слайд 9
- 10. Электрохимическая коррозия. Разрушение металла под воздействием возникающих
- 11. Защита от коррозииЗамена металлов новыми конструкционными материаламиНанесение
- 12. Способы защиты металлов от коррозии
- 13. Газотермическое напыление. Газотермическое напыление – это процесс
- 14. Пассивация металлов Каждый школьник знает, что серная
- 15. Ингибиторы коррозии металлов Ингибиторы – это вещества,
- 16. Ингибиторы в нефтегазовой отрасли На месторождениях и
- 17. Нанотехнологий против коррозий Как сделать машины и
- 18. Экономический ущерб от коррозии Экономические потери от
- 19. Какой вред коррозия наносит экономике народного хозяйства?
- 20. Какой вред коррозия наносит природе?
- 21. Первую пробирку с водой плотно закроем и
- 22. В том, что коррозия происходит, можно убедиться
- 23. Результаты опытаЧерез 14 дней
- 24. В результате эксперимента мы доказали, коррозия железа
- 25. Влияние гальванической пары на коррозию металлов. В
- 26. В случае анодного покрытия при нарушении поверхностного
- 27. Польза коррозии Разрушение металлов и сплавов можно
- 28. Выводы и предложения Коррозия –это процесс произвольного
- 29. Литература Шлугeр М. А., Ажогин Ф. Ф.,
- 30. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
Общеобразовательная средняя школа №4
г.Аксай 2012
КОРРОЗИЯ МЕТАЛЛОВ
Направление:Химия
Выполнил: Турежанов А.
9д класс
Слайд 3Задачи:
Выяснить, что влияет на коррозию железа
Узнать, в каких средах
металл корродирует быстрее
Продолжить формировать навыки работы с реактивами и
лабораторным оборудованием Продолжить учиться наблюдать, обобщать, делать выводы
Продолжить учиться оформлять работы в виде докладов и компьютерных презентаций
Слайд 4Содержание
1. Введение
2. Коррозия металлов
3.Классификация видов коррозии
4.Сущность процессов коррозии
5. Борьба
с коррозией
6. Экономический ущерб от коррозий
7. Практическая часть исследования
8. Выводы
и предложенияСлайд 5Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов
в результате химического или физико-химического взаимодействия с окружающей средой.
Кислородная коррозия
железа в воде: 4Fe + 2Н2О + ЗО2 = 2(Fe2O3+Н2О)Слайд 6Виды коррозий
газовая коррозия;
атмосферная коррозия;
коррозия в неэлектролитах;
коррозия в электролитах;
подземная коррозия;
биокоррозия;
коррозия
под воздействием блуждающих токов.
Слайд 7Химическая коррозия.
Химическая коррозия — разрушение металла в результате химического взаимодействия
металла с агрессивной (коррозионно-активной)средой. Например, образование окалины при взаимодействии материалов
на основе железа при высокой температуре с кислородом:4Fe + 3O2 → 2Fe2O3
Слайд 8Из жизненного опыта мы знаем, что предметы, сделанные из железа,
окисляются во влажном воздухе и ржавеют:
Fe - 2ē ?Fe2+Кислород является окислителем:
4Fe + 6Н2О + ЗО2 = 4Fe(OH)3
Гидроксид железа (ІІІ)присоединяет молекулы воды и образует бурое вещество:
Fe(OH)3+xH2O- Fe(OH)3 * xH2O
Образовавшееся вещество- это и есть ржавчина, состав её постоянно меняется.
Слайд 10Электрохимическая коррозия.
Разрушение металла под воздействием возникающих в коррозионной среде
гальванических элементов называют электрохимической коррозией. При электрохимической коррозии (наиболее частая
форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.) как, например, при ржавлении железа во влажной атмосфере:4Fe + 3O2 + 6H2O → 4FeO(OH)•H2O
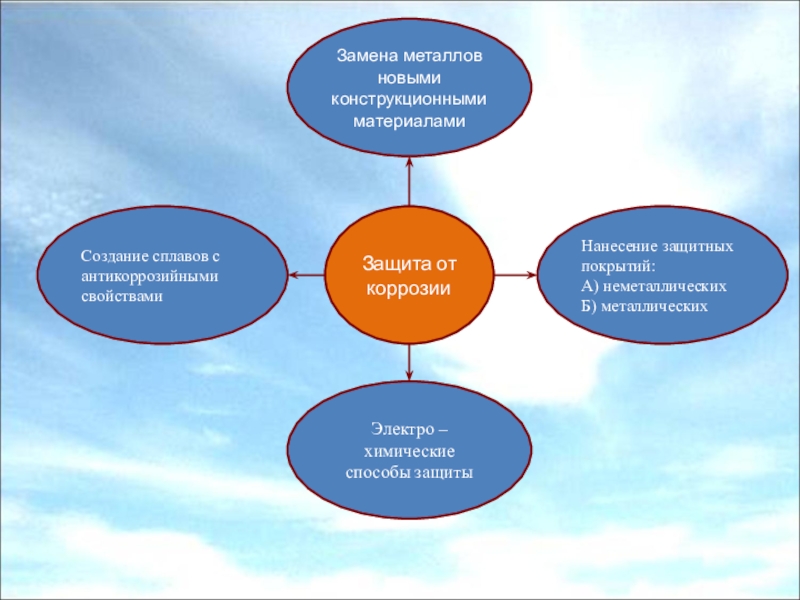
Слайд 11Защита от коррозии
Замена металлов новыми конструкционными материалами
Нанесение защитных покрытий:
А) неметаллических
Б)
металлических
Создание сплавов с антикоррозийными свойствами
Электро – химические способы защиты
Слайд 13Газотермическое напыление.
Газотермическое напыление – это процесс нагрева и переноса
конденсированных частиц распыляемого материала газовым или плазменным потоком для формирования
нужного материала. Распыление с помощью плазмы обычно называют газопламенным напылением. Электродуговое напыление энергетически более выгодно, однако позволяет напылять только металлические материалы.Слайд 14Пассивация металлов
Каждый школьник знает, что серная кислота взаимодействует с
железом в соответствии с уравнением
Fe + H2SO4 = FeSO4 + H2
Несколько иначе идет реакция железа с
HNO3:Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Вероятно, многие обратили внимание на то, что серную и азотную кислоты перевозят по железной дороге в стальных цистернах. Об этом свидетельствуют надписи, например «Осторожно, серная кислота». Как это согласуется с теми знаниями, которые отражены в школьных учебниках? Все дело в том, что по железной дороге перевозят не разбавленные, а концентрированные кислоты. Зачем же перевозить воду? Разбавить кислоту можно и на месте потребления.
Оказывается, что в отличие от разбавленных концентрированная серная, так же как и концентрированная азотная кислоты, не взаимодействует с железом. Правильнее сказать, что кратковременное взаимодействие происходит, но оно быстро прекращается, потому что в крепких растворах этих кислот железо пассивируется.
Слайд 15Ингибиторы коррозии металлов
Ингибиторы – это вещества, способные в малых
количествах замедлять протекание химических процессов или останавливать их. Название ингибитор
происходит от лат. inhibere, что означает сдерживать, останавливать. Ингибиторы взаимодействуют с промежуточными продуктами реакции или с активными центрами, на которых протекают химические превращения.Одним из наиболее простых ингибиторов атмосферной коррозии металлов является нитрит натрия NaNO2.
Слайд 16Ингибиторы в нефтегазовой отрасли
На месторождениях и Карачаганак существует потенциальная
возможность коррозионного разрушения оборудования под воздействием агрессивных сред со скоростями,
соответственно: 4 и 3 мм/год, обусловленная высоким содержанием в продукции сероводорода, двуокиси углерода, серы и большими рабочими нагрузками, возникающими в элементах конструкций. Для зашиты конструкций разработаны синтезированные на основе амидоаминов, имидазолинов и аминосолей ингибиторы коррозии: Нефтехим-1, Нефтехим-2, Нефтехим-3 эффективность которых подтверждена результатами лабораторных и промысловых испытаний, многолетней практикой их применения на промыслах. Скорость коррозии при использовании данных ингибиторов составляет 0,014...0,042 мм/год при допустимой норме - 0,15 мм/год.В настоящее время ингибитор Нефтехим-1 выпускается по ТУ 2415-001-0015181694 Стерлитамакским ЗАО «Каустик», Нефтехим-3 - по ТУ-38 УССР 201.479.89, г.
На месторождении Карачаганак ингибиторы применяются с 1997 года.
Слайд 17Нанотехнологий против коррозий
Как сделать машины и трубы долговечнее?
Российские учёные
научились эффективно бороться с коррозией. Новые технологии теперь позволяют выпускать
металл, который будет служить на порядок дольше современных образцов. Люди науки говорят, что они свою задачу почти выполнили. Теперь дело за производителями. Некоторые крупные предприятия уже сегодня используют в производстве разработки российских учёных.Новое покрытие, созданное на основе нанотехнологий, защищает металл от вредного воздействия окружающей среды в десятки раз лучше, чем, например, обычная полимерная краска. Плёнка, которая покрывает металл, настолько тонкая, что её не увидишь невооруженным глазом. В лабораториях Института физической химии и электрохимии молодые учёные продолжают исследовать свойства новых материалов.
Слайд 18Экономический ущерб от коррозии
Экономические потери от коррозии металлов огромны.
В СШАЭкономические потери от коррозии металлов огромны. В США по
последним данным NACEЭкономические потери от коррозии металлов огромны. В США по последним данным NACE ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВПЭкономические потери от коррозии металлов огромны. В США по последним данным NACE ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд долларов). В Германии этот ущерб составил 2,8 % от ВВП. По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.В России за год производят проката из черныхметаллов около 47 миллионов тонн. По данным Института физической химии РАН, каждая шестая домна работает "впустую": коррозия съедает до 10 процентовпроизводимого металла. В денежном выражении потери составляют сотни миллионов рублей. Государство терпит огромные убытки, что, естественно,отрицательно влияет на экономические показатели страны.
Слайд 21Первую пробирку с водой плотно закроем и опустим в сосуд
с водой горлышком вниз. Следующие три пробирки наполним раствором поваренной
соли и опустим горлышком вниз в сосуды с водой. В последнюю пробирку нальём растворы поваренной соли, гидроксида натрия и опустим в пятый сосуд.В каждую пробирку поместим одинаковые по размеру железные гвозди. Железный гвоздь в третьей пробирке обернём медной, а в четвёртой- цинковой проволокой. Из специального аппарата пропустим кислород так, чтобы он вытеснил воду и растворы солей из пробирок.
Во всех пробирках есть корродируемое железо и окисляющие его вещества- вода и кислород. Цель данного опыта- наблюдение за тем, как происходит коррозия железа в растворе соли, смеси растворов поваренной соли и гидроксида натрия, при соприкосновении железа с цинковой и медной проволоками.
Исследовательская работа
Слайд 22В том, что коррозия происходит, можно убедиться по тому ,
как вода поднимается в пробирку вместо кислорода, а также по
количеству образовавшегося осадка. Сравнив первую и вторую пробирки, можно увидеть, что во второй пробирке уровень воды поднялся более высоко, образовалось большее количество осадка, следовательно, произошла сильная коррозия. Раствор поваренной соли(т.е. хлорид- ионы)ускоряет коррозию железа. Этим объясняется то, что погружение в морскую воду часто судов быстрее других подвергается коррозий. Процесс коррозий ускоряет также другие ионы, находящиеся в морской воде.Сравним вторую и пятую пробирки. В пятой пробирке коррозия не произошла, так как здесь имеются ионы OH- , которые ее замедляют.
Слайд 24В результате эксперимента мы доказали, коррозия железа происходит во влажной
среде
Быстро, если металл непосредственно соприкасается с жидкостью
Интенсивно, если металл
находится в растворе соли содержащей катион менее активного металлаЕсли металл соприкасается с более активным металлом, то коррозия его замедляется (например железо с цинком)
Если металл соприкасается с менее активным металлом, то коррозия его усиливается (например железо с медью)
Вывод:
Слайд 25Влияние гальванической пары на коррозию металлов.
В две пробирки налить
по нескольку мл воды, добавить в каждую из них 1-
2 мл раствора серной кислоты и несколько капелл красной кровяной соли К3(Fe(CN)6).В одну пробирку опустить канцелярскую скрепку, в которой зажат кусочек цинка, в другую- скрепку с кусочком олова. В одной из пробирок (там где было олово) раствор синеет: в этой
пробирке идет разрушение железа (скрепки), так как образуется гальваническая пара Fe-Sn, в которой более активный металлом является железо; в другой пробирке раствор остаётся бесцветным, так как в гальванической паре Zn-Fe более активным является цинк, он разрушается, предохраняя железную скрепку.
Слайд 26В случае анодного покрытия при нарушении поверхностного слоя возникает гальваническая
пара Zn- Fe, в которой разрушается более активный металл (Zn).
В случае катодного покрытия при нарушений поверхностного слоя возникает гальваническая пара Sn- Fe, в которой первым разрушается железо. Поэтому анодноепокрытие более долговечно, чем катодное хотя последнее широко распространено в декоративных целях.
Слайд 27Польза коррозии
Разрушение металлов и сплавов можно применить как один
из способов борьбы с космическим мусором.
Одним из направлений может быть
ее применение для разрушения конструкций в труднодоступных местах . Если бы железо, подобно серебру и золоту, не ржавело, то мы не существовали бы, и ни одно растение не зеленело бы на Земле. Растворённая в воде ржавчина составляет часть пищи растений и придаёт им зеленый цвет. Та же «ржавчина» снабжает железом нашу кровь и придаёт ей красный