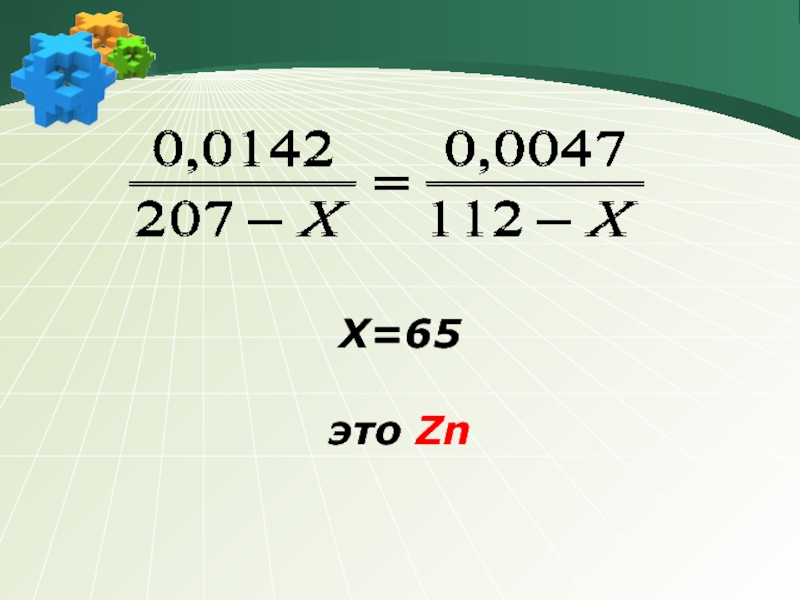
стаж 33 года.
Почетный работник общего образования РФ.
Победитель конкурса лучших
учителей РФ 2006,2011г.Лауреат «Гранта Москвы» 2010г.
Эксперт ЕГЭ по химии.
Методист ООО «БИНОМ лаборатории знаний».
Автор книги «Готовимся к ЕГЭ по химии».
Автор 11 публикаций в журналах «Химия в школе», «Химия. Все для учителя», «Образование в современной школе», «Химия для школьников» и «Химия . 1 сентября»
Соавтор сборника «Программа по химии. Основная школа: 8-9 классы»
Методист создания учебника «Химия. Учебник для 8-9 класса», автор Д.М. Жилина
Барышова Ирина Валентиновна