Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксиды азота
Содержание
- 1. Оксиды азота
- 2. Содержание Виды оксидов азота. Оксид азота(I). Оксид азота(II). Оксид азота(III). Оксид азота(IV). Азотный ангидрид.
- 3. Виды оксидов азотаN2O
- 4. Оксид азота(I) - N2O (“веселящий газ”)Физические свойства.
- 5. Оксид азота(II) - NOФизические свойства. Бесцветный газ,
- 6. Химические свойства. Очень реакционноспособное вещество. Может проявлять
- 7. Оксид азота(III) - азотистый ангидридФизические свойства. Это
- 8. Оксид азота(IV) - NO2 и его димер
- 9. Химические свойства. Взаимодействие с водой:
- 10. Оксид азота(V) - азотный ангидридСтроение.
- 11. Химические свойства. Оксид азота(V) - кислотный оксид.1.
- 12. Спасибо за внимание
- 13. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Содержание
Виды оксидов азота.
Оксид азота(I).
Оксид азота(II).
Оксид азота(III).
Оксид азота(IV).
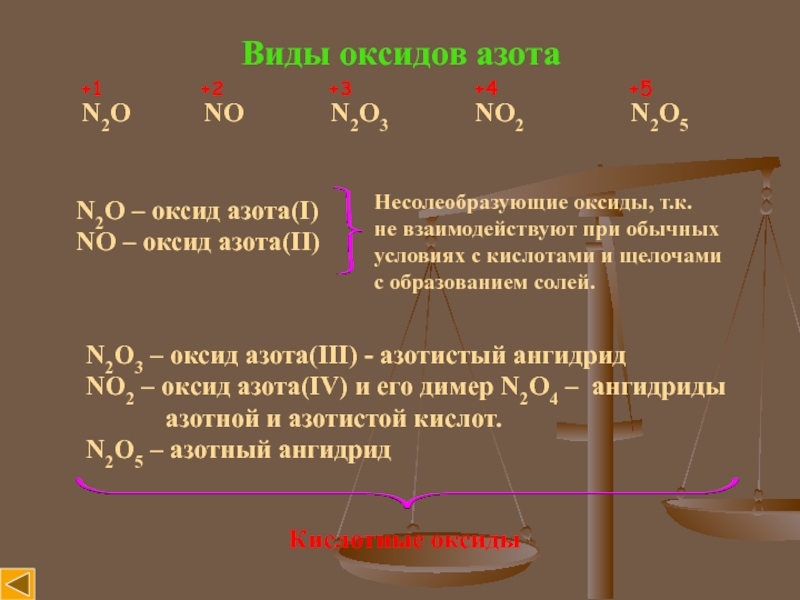
Слайд 3Виды оксидов азота
N2O NO
N2O3
NO2 N2O5+1 +2 +3 +4 +5
N2O – оксид азота(I)
NO – оксид азота(II)
Несолеобразующие оксиды, т.к.
не взаимодействуют при обычных
условиях с кислотами и щелочами
с образованием солей.
N2O3 – оксид азота(III) - азотистый ангидрид
NO2 – окcид азота(IV) и его димер N2O4 – ангидриды
азотной и азотистой кислот.
N2O5 – азотный ангидрид
Кислотные оксиды
Слайд 4Оксид азота(I) - N2O (“веселящий газ”)
Физические свойства. Бесцветный газ с
тошнотворным
cладковатым запахом, обладает анестезирующим действием.
Растворим в воде. t0(плав) =
-910С, t0(кип) = -88,60С. Получение. Разложение нитрата аммония при нагревании:
NH4NO3 = N2O + 2H2O
Нагрев должен быть не более 2450С.
Химические свойства.
1. Разлагается при 7000С с образованием кислорода:
2N2O = 2N2 + O2
Поэтому поддерживает горение и является окислителем.
2. С водородом:
N2O + H2 = N2 + H2O
Слайд 5Оксид азота(II) - NO
Физические свойства. Бесцветный газ, при низких
температурах -
голубая жидкость. В твердом состоянии -
димеризован (N2O2). Не растворим в
воде. t0(плав) = -1640С, t0(кип) = - 151,70С.
Получение. 1. При реакции неактивных металлов с
разбавленной азотной кислотой:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2. При каталитическом окислении аммиака:
4NH3 + 5O2 = 4NO + 6H2O
3. При взаимодействии с кислородом воздуха:
N2 + O2 = 2NO (t0 ≥ 20000C, кат. Pt/Rh)
4. При взаимодействии нитритов с серной кислотой:
2 NaNO2 + H2SO4 = Na2SO4 + NO + NO2 + H2O
Слайд 6Химические свойства. Очень реакционноспособное вещество. Может проявлять и окислительные и
восстановительные свойства.
1. При обычной температуре окисляется кислородом
воздуха:2NO + O2 = 2NO2
2. Восстановитель:
NO + NO2 = N2O3
2NO + Cl2 = 2NOCl (нитрозилхлорид)
3. Окислитель:
2NO + 2SO2 = 2SO3 + N2
2NO + 2Н2 = N2 + 2Н2О (2000С)
2NO + 2Cu = N2 + 2CuO (5000С)
2NO + 2H2S = N2 + 2S + 2Н2О (3000С)
4. Взаимодействует с органическими веществами. Примененяется. В производстве азотной кислоты.
Слайд 7Оксид азота(III) - азотистый ангидрид
Физические свойства. Это синяя жидкость при
обычных
условиях. В твердом состоянии - белое или голубоватое
вещество. t(плав)
= -1020С.Получить можно при сильном охлаждении эквимолярной
смеси NO и NO2:
NO + NO2 = N2O3
Химические свойства. N2O3 - кислотный оксид.
Взаимодействие со щелочами:
2NaOH + N2O3 = 2NaNO2 + H2O
Взаимодействие с водой:
N2O3 + H2O(хол) = 2HNO2
3N2O3 + H2O(гор) = 2HNO3 + 4NO
Окисляется кислородом воздуха при -100С:
2N2O3 + О2 = 4NO2
Слайд 8Оксид азота(IV) - NO2
и его димер N2O4
Физические
свойства. Это красно-бурый газ с резким запахом.
При низких температурах из-за
наличия у атомов азотанеспаренных электронов димеризуется в N2O4. Димер в
жидком состоянии бесцветный, в твердом - белый. t(пл) = -11,20С.
Хорошо растворяется в холодной воде. Насыщенный раствор
имеет ярко-зеленый цвет.
Получение.
Термическим разложением нитратов металлов,
расположенных в ряду активности в интервале Al-Сu:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Взаимодействием меди с концентрированной азотной
кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
Окислением оксида азота(II):
2NO + O2 = 2NO2
Слайд 9Химические свойства.
Взаимодействие с водой:
2NO2 + H2O(хол)
= HNO3 + HNO2
3NO2 + H2O(гор) =
2HNO3 + NOВзаимодействие с растворами щелочей:
2NO2 + 2КОН = КNO3 + КNO2 + Н2О
При растворении в воде в присутствии кислорода:
4NO2 + 2H2O + О2 = 4HNO3
Используется в промышленном способе получения
азотной кислоты.
Хороший окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 4Cu = 4CuO + N2 (500-6000C)
Слайд 10Оксид азота(V) - азотный ангидрид
Строение.
N O N
Физические свойства. Белое кристаллическое вещество, летучее, неустойчивое. При нагревании возгоняется и
плавится. В воде легко растворяется.
Получение. Действие дегидратирующего агента Р4О10 на
азотную кислоту:
4HNO3 + P4O10 = 2N2O5 + 4HPO3
O
O
O
O
N2O5
Слайд 11Химические свойства. Оксид азота(V) - кислотный оксид.
1. При растворении в
воде образует азотную кислоту:
N2O5 + H2O
= 2HNO32. Со щелочами образует нитраты:
N2O5 + 2NaOH = 2NaNO3 + H2O
Малоустойчив и легко разлагается уже при
комнатной температуре:
2N2O5 = 4NO2 + O2
Прb нагревании разлагается со взрывом.
Сильный окислитель:
N2O5 + 5Сu = 5CuO + N2 (5000C)
На практике реакции не проводятся ввиду его
труднодоступности и малой устойчивости