Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Оксиды углерода
Содержание
- 1. Оксиды углерода
- 2. Нахождение в природе Один из распространенных
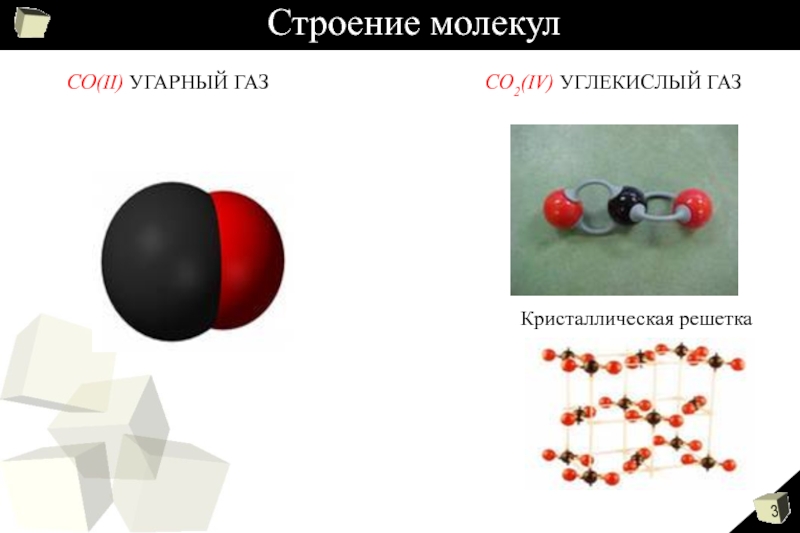
- 3. Строение молекул СО(II) УГАРНЫЙ ГАЗСО2(IV) УГЛЕКИСЛЫЙ ГАЗКристаллическая решетка
- 4. 1. В лаборатории:
- 5. Получение. Видеоопыты.СО(II) УГАРНЫЙ ГАЗСО2(IV) УГЛЕКИСЛЫЙ ГАЗ
- 6. СО(II) УГАРНЫЙ ГАЗ Безцветный газ,
- 7. Химические свойства:1. Восстановительные свойства:
- 8. Свойства углекислого газа
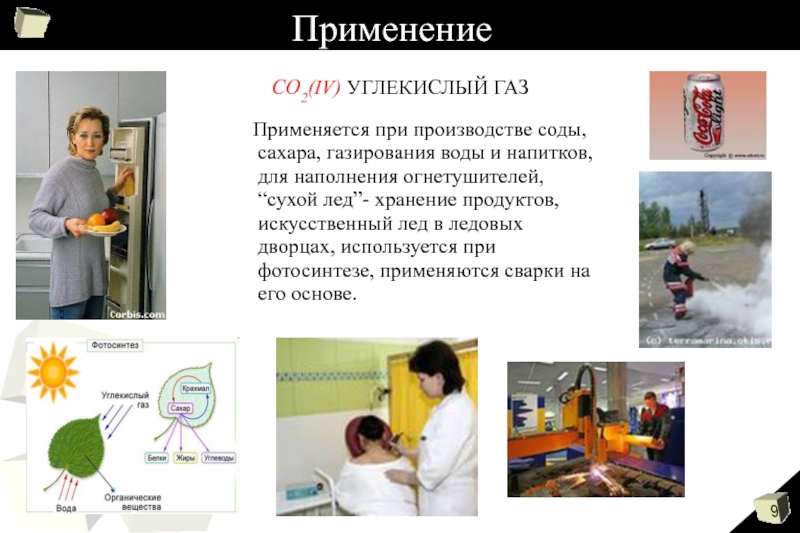
- 9. Применение Применяется при производстве соды,
- 10. Применение Применяется для обработки мяса
- 11. Домашнее заданиепр. 31, упр.№ 8 стр.154.
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Нахождение в природе
Один из распространенных оксидов – диоксид
углерода CO2 – содержится в составе вулканических газов.
Слайд 4 1. В лаборатории:
НСООН→Н2О+СО↑
2.В промышленности:
С+О2= СО2↑+
QСО2+C= СО↑ - Q
1. В лаборатории:
СаСО3+2НСl→CaCl2+H2O+CO2 ↑
2.В промышленности:
СаСО3→СаО+CO2 ↑
Сравнительная характеристика оксидов
СО(II) УГАРНЫЙ ГАЗ
СО2(IV) УГЛЕКИСЛЫЙ ГАЗ
Получение:
Слайд 6СО(II) УГАРНЫЙ ГАЗ
Безцветный газ, без запаза, легче
воздуха, плохо растворим в воде. Сильный яд!!! Связываясь с гемоглобином
крови, нарушает ее транспортную функцию и вызывает удушье.СО2(IV) УГЛЕКИСЛЫЙ ГАЗ
Безцветный газ, без запаза, в 1,5 раза тяжелее воздуха, мало растворим в воде, не поддерживает горение, дыхание.
Сравнительная характеристика оксидов
Физические свойства:
Слайд 7Химические свойства:
1. Восстановительные свойства:
2СО+О2= 2СО2↑
CuО+СО=СО2↑ +Cu
Fе2О3+СО=СО2↑ +Fе
2.
Горение:2СО+О2= 2СО2↑
1.Взаимодействие с основными оксидами:
СО2+СаО=СаСО3
2. Взаимодействие с водой:
СО2+Н2О↔Н2СО3
3.Взаимодействие с основаниями (качественная реакция):
СО2+Са(ОН)2=СаСО3 +Н2О
Сравнительная характеристика оксидов
СО(II) УГАРНЫЙ ГАЗ
СО2(IV) УГЛЕКИСЛЫЙ ГАЗ
Слайд 9Применение
Применяется при производстве соды, сахара, газирования воды
и напитков, для наполнения огнетушителей, “сухой лед”- хранение продуктов, искусственный
лед в ледовых дворцах, используется при фотосинтезе, применяются сварки на его основе.СО2(IV) УГЛЕКИСЛЫЙ ГАЗ
Слайд 10Применение
Применяется для обработки мяса животных и
рыбы, придает им ярко красный цвет и вид свежести, не
изменяя вкусовых качествЯвляется хорошим восстановителем в металлургическом производстве. Образуется при неполном сгорании кокса в доменной печи. Используется для обезболивания, при трансплантации органов.
СО(II) УГАРНЫЙ ГАЗ