Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация Повторение "Классификация неорганических соединений" 8 класс
Содержание
- 1. Презентация Повторение "Классификация неорганических соединений" 8 класс
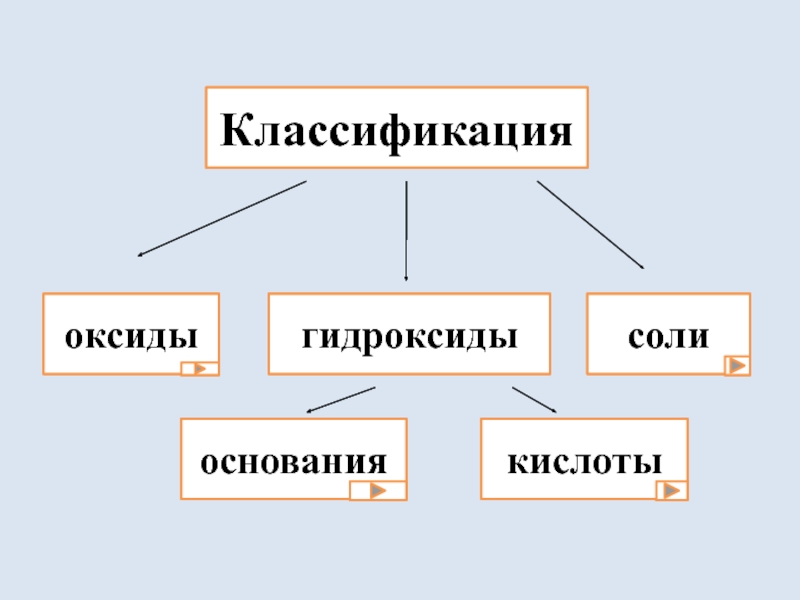
- 2. Классификация оксидыгидроксидысолиоснованиякислоты
- 3. Оксиды MxOyЗапишите по три примера для каждого
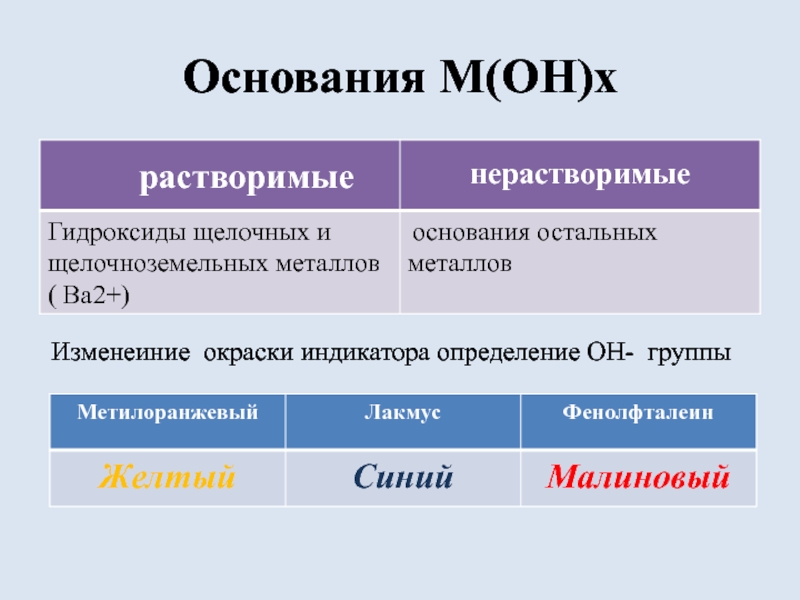
- 4. Основания M(OH)xрастворимыенерастворимыеИзменеиние окраски индикатора определение ОН- группы
- 5. Свойства оснований
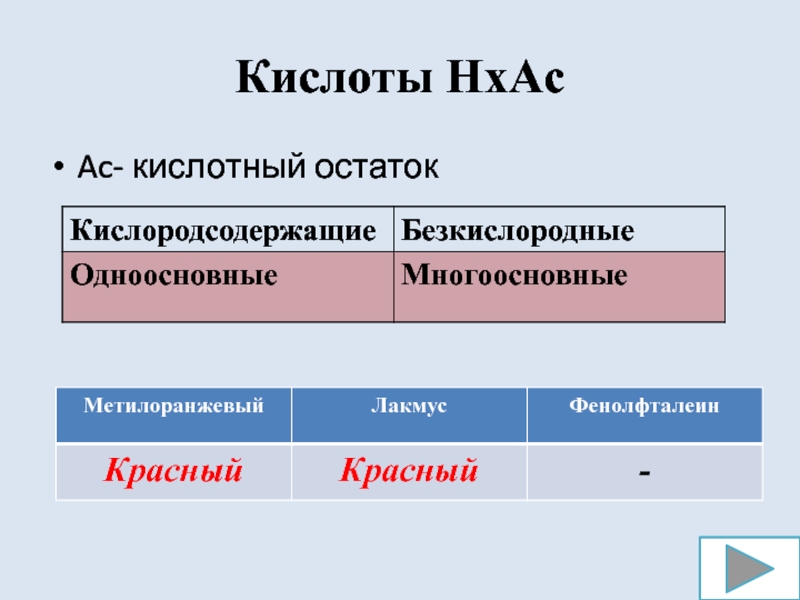
- 6. Кислоты HxAcAc- кислотный остаток
- 7. Свойства кислотКислоты + металл ( в станд
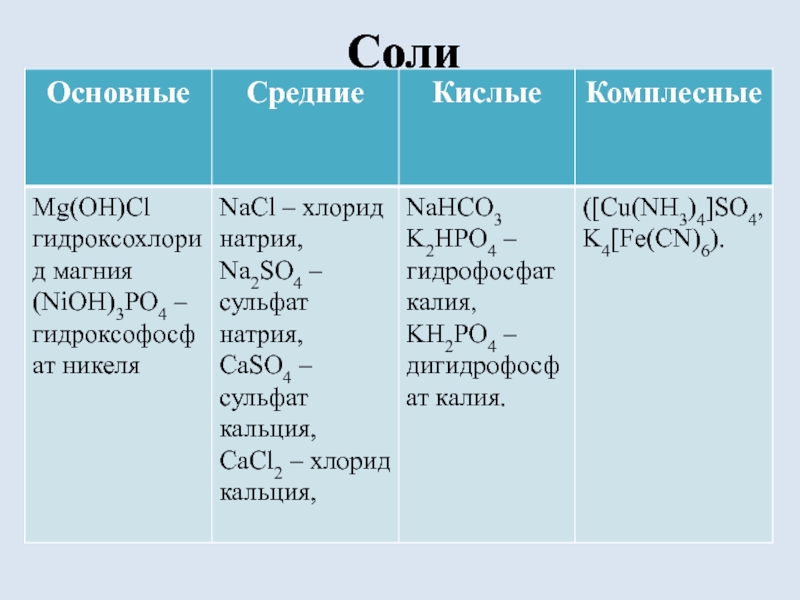
- 8. Соли
- 9. Задания1.Лишнее вещество.а) SO3, HNO3, FeO, K2O, CO2,
- 10. Литератураhttp://nsportal.ru/shkola/khimiya/library/2014/08/26/klassifikatsiya-klassov-neorganicheskikh-soedineniy-8-klassХимия 8 С.О. Габриелян , 2011
- 11. Скачать презентанцию
Классификация оксидыгидроксидысолиоснованиякислоты
Слайды и текст этой презентации
Слайд 3Оксиды MxOy
Запишите по три примера для каждого типа оксида.
Химические свойства
оксидов:
оксид = соль ( соединение)Оксид + основание = соль +вода ( обмена)
кислоты = соль +вода ( обмена)
металл с основным оксидом = новый металл + оксид
(замещение)
Слайд 5Свойства оснований
кислотные оксиды = соль + вода (обм)
Основание + кислоты = соль + вода (нейтрал)
( растворимые)
амфотерные основания = комплекс соль
соль(р-р) = основание + соль
Приведите примеры уравнений реакций для каждого
типа реакции.
Дома повторить получение оснований.
Слайд 7Свойства кислот
Кислоты + металл ( в станд ряду напряжение до
водорода) = соль + водород (замещение)
Исключение концентрированная серная кислота и
азотная кислота любой концентрацииосновной оксид = соль +вода (обмен)
Кислота + основание = соль+ вода (нейтрализация)
соль (более слабой кислоты) = соль + кислота
HI, HClO4, HBr, HCl, H2SO4, HNO3, HMnO4, H2SO3, H3PO4, HF, HNO2, H2CO3, H2S, H2SiO3 сила кислот уменьшается
Приведите примеры уравнений реакций для каждого
типа реакции.
Дома повторить получение оснований.
Слайд 9Задания
1.Лишнее вещество.
а) SO3, HNO3, FeO, K2O, CO2, CuO.
б) O3, H2SO4,
Al(OH)3, HCl, H3PO4, H2CO3
в) Zn(OH)2, KOH, Fe(OH)2, Ba, NaOH, Ba(OH)2
г)
KNO3, FeSO4, NaCl, Al2S3, BaO, CaCO3 2.Закончите уравнения реакций(напишите реакции ионного обмена)
Ba(OH)2+ H3PO4 =
CaO + CO2 =
NaOH+ CuSO4=