Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Расчёты по химическим уравнениям 8 класс
Содержание
- 1. Расчёты по химическим уравнениям 8 класс
- 2. Цель: научиться вести расчеты по уравнению химической
- 3. Что означает запись?3О2НNО33ОN2 3 молекулы кислорода1 молекула
- 4. Уравнение химической реакции – это условная запись
- 5. Составьте схему уравнение2. При взаимодействии форфора с
- 6. 1) Na +
- 7. 012345678910старт 1) СН4 → С
- 8. .
- 9. Дано:n(P2О5) =4 мольn (О2) = ?Решение:
- 10. ?АЛГОРИТМ РЕШЕНИЯ ЗАДАЧNmVnNxmxVxnx1. Написать уравнение реакцииПо известному
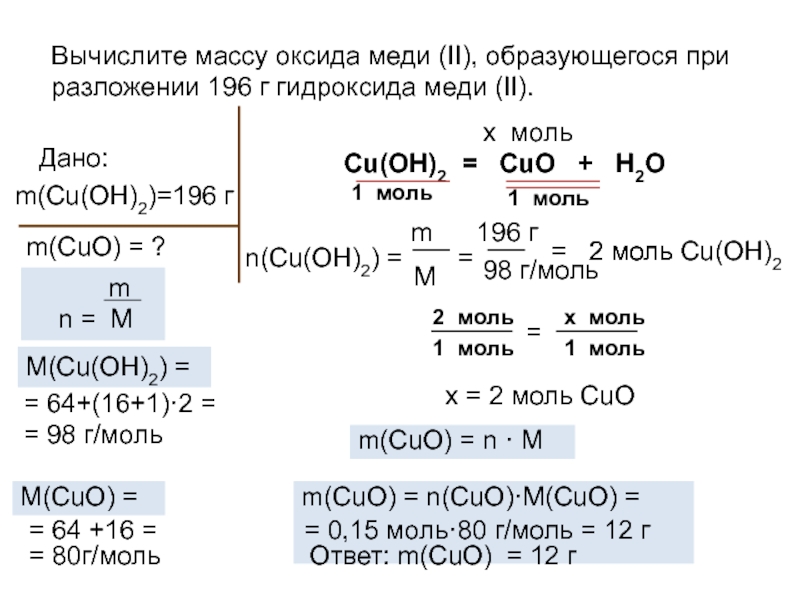
- 11. Вычислите массу оксида меди (II), образующегося при
- 12. 2H2
- 13. Какой объем кислорода (н.у.) образуется при разложении
- 14. САМОСТОЯТЕЛЬНАЯ РАБОТА:ВАРИАНТ 1: 1. Вычислите массу меди,
- 15. Домашнее задание:§ 28, с.160-166,
- 16. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Что означает запись?
3О2
НNО3
3О
N2
3 молекулы кислорода
1 молекула азотной кислоты
3 атома
кислорода
1 молекула азота
3НСl
3 молекулы хлороводородной кислоты
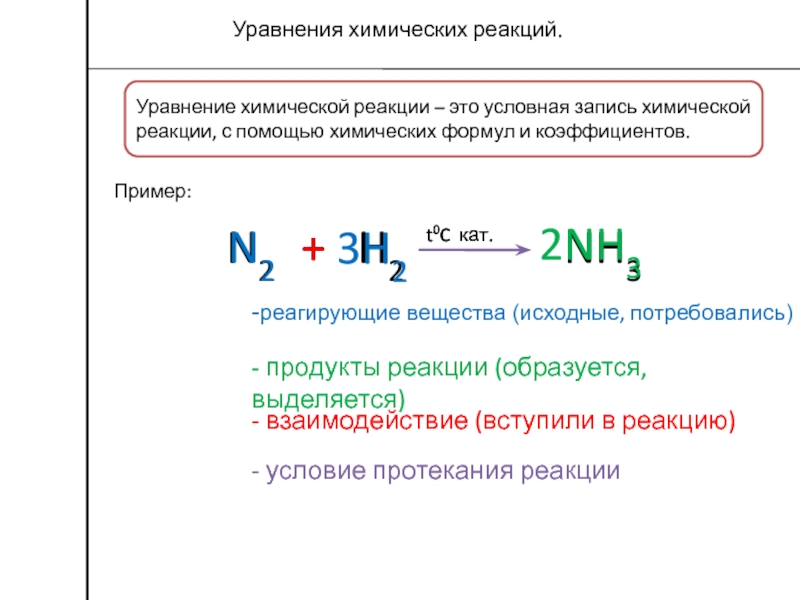
Слайд 4Уравнение химической реакции – это условная запись химической реакции, с
помощью химических формул и коэффициентов.
Пример:
Уравнения химических реакций.
N2
+
3H2
2NH3
t0C кат.
-реагирующие вещества
(исходные, потребовались)- продукты реакции (образуется, выделяется)
- взаимодействие (вступили в реакцию)
- условие протекания реакции
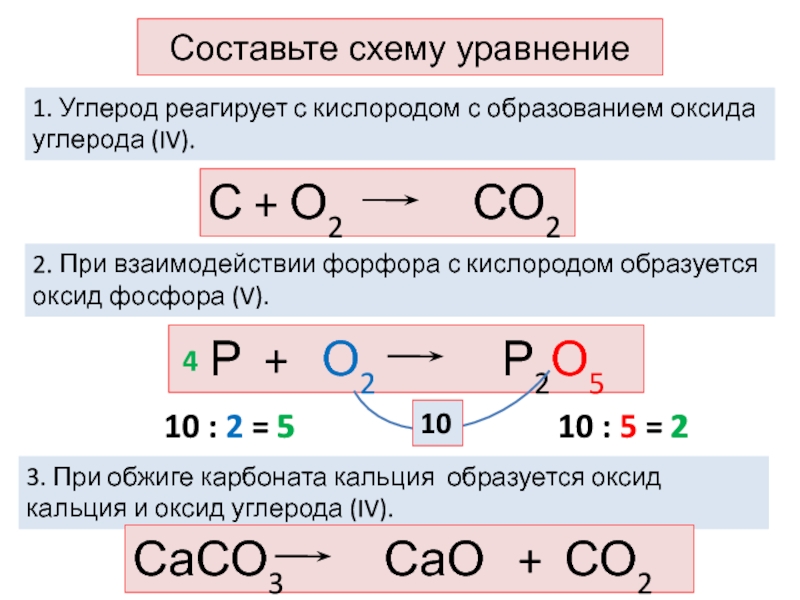
Слайд 5Составьте схему уравнение
2. При взаимодействии форфора с кислородом образуется оксид
фосфора (V).
1. Углерод реагирует с кислородом с образованием оксида
углерода (IV). С + О2 СО2
Р + О2 Р2О5
3. При обжиге карбоната кальция образуется оксид кальция и оксид углерода (IV).
10
10 : 5 = 2
10 : 2 = 5
5
2
4
СаСО3 СаО + СО2
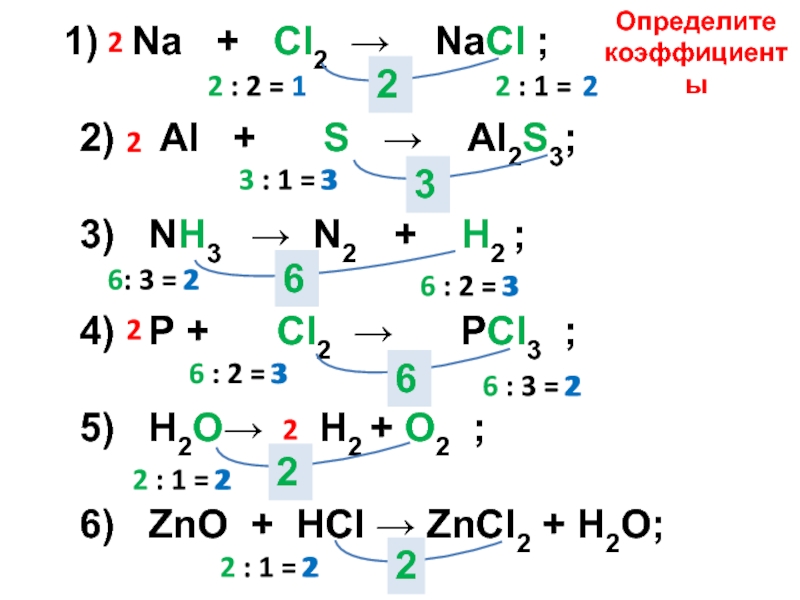
Слайд 6 1) Na + Сl2 →
NaСl ;
2) Аl + S → Аl2S3;
3) NН3 → N2 + Н2 ;
4) Р + Сl2 → РСl3 ;
5) Н2О→ Н2 + О2 ;
6) ZnО + НСl → ZnСl2 + Н2О;
2
3
6
6
2
2
2 : 1 =
2 : 2 = 1
2
3 : 1 = 3
3
2
6: 3 = 2
6 : 2 = 3
6 : 2 = 3
6 : 3 = 2
2 : 1 = 2
2
3
3
2
2
2 : 1 = 2
2
2
2
2
2
Определите
коэффициенты
Слайд 70
1
2
3
4
5
6
7
8
9
10
старт
1) СН4 → С + Н2
;
2) Н2 + О2 → Н2О ;
3) Zn + НСl → ZnСl2 + Н2
4) Са + О2 → СаО
5) Fe + О2 → Fe 3О4
1) Р + Сl2 → РСl3
2) Zn + O2 → ZnO
3) РbО + С → СО2 + Рb
4) Cа + НСl → СаСl2 + Н2
5) НgО → Нg + О2
Вариант I.
Вариант II.
Самостоятельная работа
Определите коэффициенты
Слайд 9Дано:
n(P2О5) =4 моль
n (О2) = ?
Решение:
x моль 4 моль
4P + 5 О2 = 2 P2О5 5 моль 2 моль
Пропорция:
x 4 моль
5 моль 2 моль
x · 2 = 5 · 4
x = 10 моль О2
Ответ: n(О2) = 10 моль
Условие. Вычислите количество вещества кислорода, необходимое для получения 4 моль оксида фосфора.
=
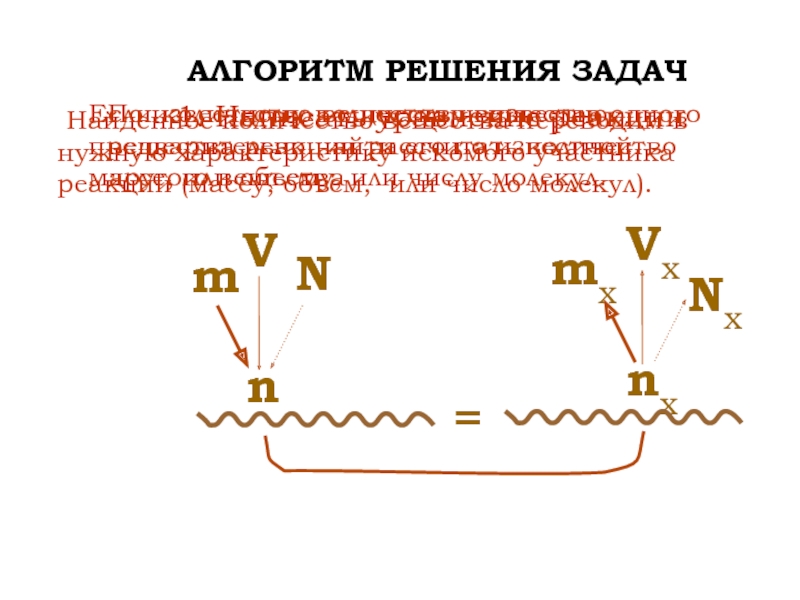
Слайд 10?
АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ
N
m
V
n
Nx
mx
Vx
nx
1. Написать уравнение реакции
По известному количеству вещества одного
вещества реакции рассчитать количество другого вещества
Если количество вещества неизвестно, предварительно
найти его по известной массе, или объему, или числу молекул. Найденное количество вещества переводим в нужную характеристику искомого участника реакции (массу, объем, или число молекул).
Слайд 11Вычислите массу оксида меди (II), образующегося при разложении 196 г
гидроксида меди (II).
Cu(OH)2 = CuO +
H2OДано:
m(Cu(OH)2)=196 г
m(CuO) = ?
m
n = М
n(Cu(OH)2) =
m
M
M(Cu(OH)2) =
=
196 г
98 г/моль
=
2 моль Cu(OH)2
2 моль
х моль
1 моль
1 моль
2 моль
1 моль
=
х моль
1 моль
х = 2 моль CuO
m(CuO) = n(CuO)·M(CuO) =
m(CuO) = n · M
M(CuO) =
= 64+(16+1)·2 =
= 98 г/моль
= 64 +16 =
= 80г/моль
= 0,15 моль·80 г/моль = 12 г
Ответ: m(CuO) = 12 г
Слайд 12 2H2 + О2
= 2H2O
Дано:
m(H2) = 8 г m(О2) = ?
m
n = М
n(H2) =
m
M
M(Н2)=
=
8 г
2 г/моль
=
4 моль
4 моль хмоль
2 моль
1 моль
4 моль
2 моль
=
х моль
1 моль
х = 2 моль (О2)
m(О2) = n(О2) ·M(О2) =
m(О2) = n · M
M(О2) =
1·2 = 2г/моль
2·16=32г/моль
= 2 моль·32 г/моль = 64 г
Ответ: m(О2) = 64г
Определите массу кислорода необходимого для сжигания 8 г водорода.
Слайд 13Какой объем кислорода (н.у.) образуется при разложении 120 г оксида
магния.
Дано:
m(MgO) = 120 г
V(O2) = ?
MgO =
Mg + O2↑M(MgO) =
= 40 г/моль
Vm = 22,4 л/моль
n(MgO) =
m
M
=
120 г
40 г/моль
= 3 моль
3 моль
x моль
2 моль 1 моль
3 моль
2 моль
=
х моль
1 моль
х = 1,5 моль O2
V(O2) = n · Vm
V(O2) = n(O2)·Vm =
24+16 =
2
2
0,15 моль· 22,4 л/моль
=3,36 г
Ответ: V(O2) = 3,36 л
Слайд 14САМОСТОЯТЕЛЬНАЯ РАБОТА:
ВАРИАНТ 1:
1. Вычислите массу меди, которая образуется при
взаимодействии 4 г водорода с оксида меди (II).
CuO + H2 = Cu + H2O2 моль х моль
2. Составьте условие и решите: Са + O2 = СаО
ВАРИАНТ 2:
1. В реакцию с серной кислотой вступило 20 г гидроксида натрия. Рассчитайте массу образовавшейся соли сульфата натрия.
2NaOH + H2SO4 = Na2SO4 + 2H2O
2 моль х моль
2. Составьте условие и решите: Мg + O2 = МgО