Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
РАСТВОРЕНИЕ. РАСТВОРИМОСТЬ. ТИПЫ РАСТВОРОВ.
Содержание
- 1. РАСТВОРЕНИЕ. РАСТВОРИМОСТЬ. ТИПЫ РАСТВОРОВ.
- 2. ФИЗИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВЯкоб Вант-ГоффСванте АррениусВильгельм Освальд1887 годРастворение--результат
- 3. Физико-химическая теория растворов.1906год Д.И.МенделеевГидратная теория растворов. При взаимодействии растворённого
- 4. опыт 1В пробирку поместите белые кристаллы CuSO4,
- 5. Б) В двух пробирках даны тёмно-красные кристаллы
- 6. ДОМАШНЕЕ ЗАДАНИЕЗакончить уравнения реакций, расставить коэффициенты и
- 7. РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ при 20ºС (г/100г воды)Хорошо растворимыеМалорастворимыеПрактически нерастворимые>1г
- 8. ЗАДАЧАВ организме человека в среднем содержится 5
- 9. ЗАДАНИЕПостройте график растворимости медного купороса CuSO4 .
- 10. Пользуясь графиком определите:Какую массу CuSO4 ·5H2 O
- 11. ОТВЕТ: m(гем.) = 630 г
- 12. ТИПЫ РАСТВОРОВ
- 13. ВЕЩЕСТВАХорошо растворимыеМалорастворимыеПрактически нерастворимые>1г
- 14. Слайд 14
- 15. КРОССВОРДO2
- 16. ДОМАШНЕЕ ЗАДАНИЕ§ 34Упражнения 4, 5, 6.Страница 142ДОМАШНЕЕ
- 17. Уже звенит звонок.Спасибо за урок.Уже звенит звонок.Спасибо за урок.Уже звенит звонок.Спасибо за урок.
- 18. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1РАСТВОРЕНИЕ.
РАСТВОРИМОСТЬ.
ТИПЫ РАСТВОРОВ.
Презентация Сергеевой Виктории Юрьевны
Учитель химии ГОУ №256
Слайд 2ФИЗИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ
Якоб Вант-Гофф
Сванте Аррениус
Вильгельм Освальд
1887 год
Растворение--результат диффузии, т.е. физический
процесс.
Слайд 3Физико-химическая теория растворов.
1906год Д.И.Менделеев
Гидратная теория растворов.
При взаимодействии растворённого вещества с водой
образуются гидраты.
CuSO4-белые кристаллы
CuSO4 . 5H2 O-голубые кристаллы
Кристаллогидрат сульфата меди (II)
Медный
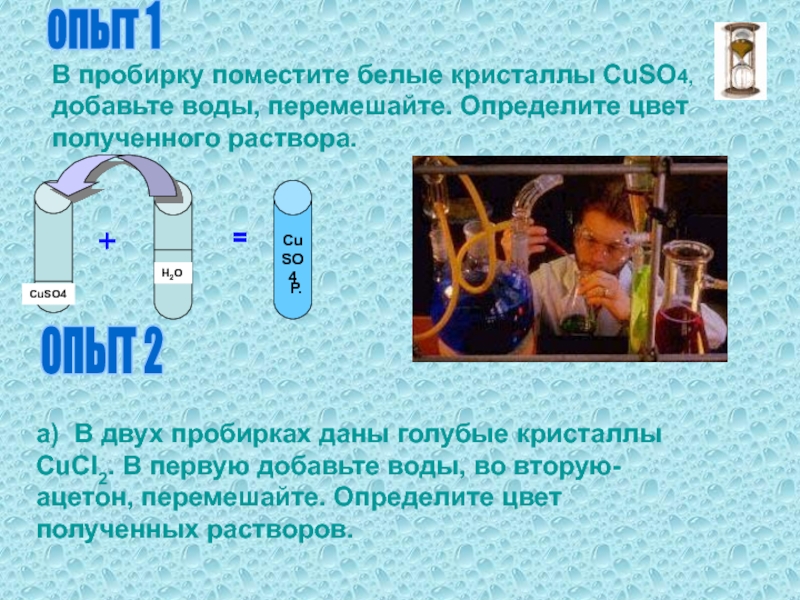
купорос.Слайд 4опыт 1
В пробирку поместите белые кристаллы CuSO4, добавьте воды, перемешайте.
Определите цвет полученного раствора.
CuSO4
CuSO4
Н2О
+
=
Р.
ОПЫТ 2
а) В двух пробирках даны
голубые кристаллы СuCI2. В первую добавьте воды, во вторую- ацетон, перемешайте. Определите цвет полученных растворов. Слайд 5Б) В двух пробирках даны тёмно-красные кристаллы СоСI2.В первую пробирку
добавьте воды, во вторую – ацетон,
CuСI2
CuCI2
Н2О
+
=
Р.
CoCI2
CoCI2
Н2О
+
=
Р.
CuСI2
CuCI2
Ацет.
+
=
Р.
CoCI2
CoCI2
Ацет.
+
=
Р.
ВЫВОД
Растворение- физико-химический процесс.
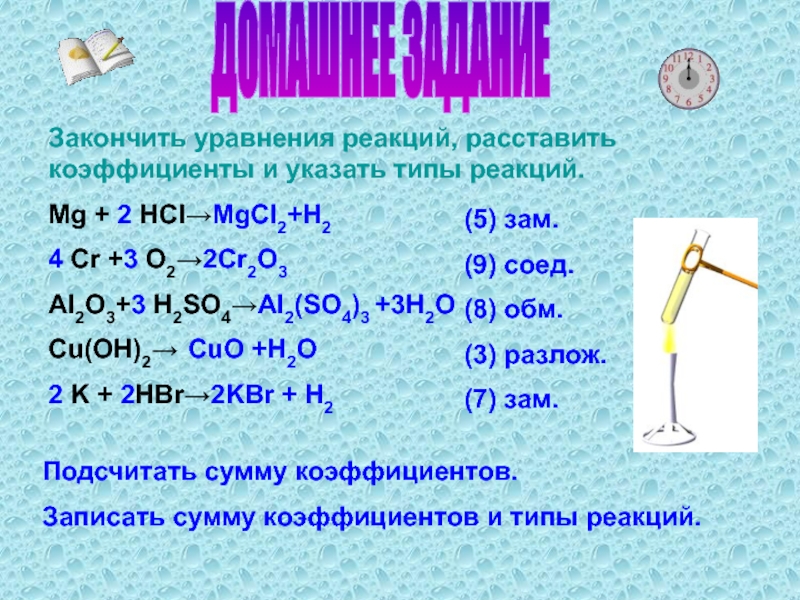
Слайд 6ДОМАШНЕЕ ЗАДАНИЕ
Закончить уравнения реакций, расставить коэффициенты и указать типы реакций.
Mg
+ 2 HCI→MgCI2+H2
4 Cr +3 O2→2Cr2O3
AI2O3+3 H2SO4→AI2(SO4)3 +3H2O
Cu(OH)2→ CuO +H2O
2
K + 2HBr→2KBr + H2Подсчитать сумму коэффициентов.
Записать сумму коэффициентов и типы реакций.
(5) зам.
(9) соед.
(8) обм.
(3) разлож.
(7) зам.
Слайд 7РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ
при 20ºС (г/100г воды)
Хорошо растворимые
Малорастворимые
Практически нерастворимые
>1г
меди
CuSO4 – 222 г
Нитрат калия
KNO3 – 31,6 г
Сульфат кальция
CaSO4-0,2
гИодид свинца (II)
PbI2-0,07 г
Сульфат бария
BaSO4-0,0023 г
Хлорид серебра
AgCI-0,00009 г
Слайд 8ЗАДАЧА
В организме человека в среднем содержится 5 л крови, плотность
которой состовляет 1,05 г/мл. Сколько граммов железа и гемоглобина содержится
в крови, если массовая доля гемоглобина состовляет 12%, а массовая доля железа в гемоглобине – 5%?Слайд 9ЗАДАНИЕ
Постройте график растворимости медного купороса CuSO4 . 5H2о в воде
по следующим данным:
10 20
30 40 50 ºСг/л
400
300
200
100
Слайд 10Пользуясь графиком определите:
Какую массу CuSO4 ·5H2 O можно растворить в
100 мл воды при 40 ºС.
Предположите какую массу CuSO4 ·5H2
O можно растворить в 1 л воды при 70 ºС.Какая масса соли CuSO4 ·5H2 O выпадет в виде кристаллов из раствора, который приготовили из 340 г соли и 1 л воды при 50 ºС и охладили до 30 ºС.
29 г
440г
100г
Слайд 13
ВЕЩЕСТВА
Хорошо растворимые
Малорастворимые
Практически нерастворимые
>1г
31,6 г
Сульфат кальция
CaSO4-0,2 г
Иодид свинца (II)
PbI2-0,07 г
Сульфат бария
BaSO4-0,0023 г
Хлорид серебра
AgCI-0,00009
гпри 20ºС
(г/100г
воды)
?
Охарактеризуйте 2 словами раствор:
200г CuSO4
31,6 г KNO3
Ненасыщенный, концентрированный
Насыщенный, концентрированный
Ненасыщенный, разбавленный
Насыщенный, разбавленный
0,01 г CaSO4
0,0023 г BaSO4