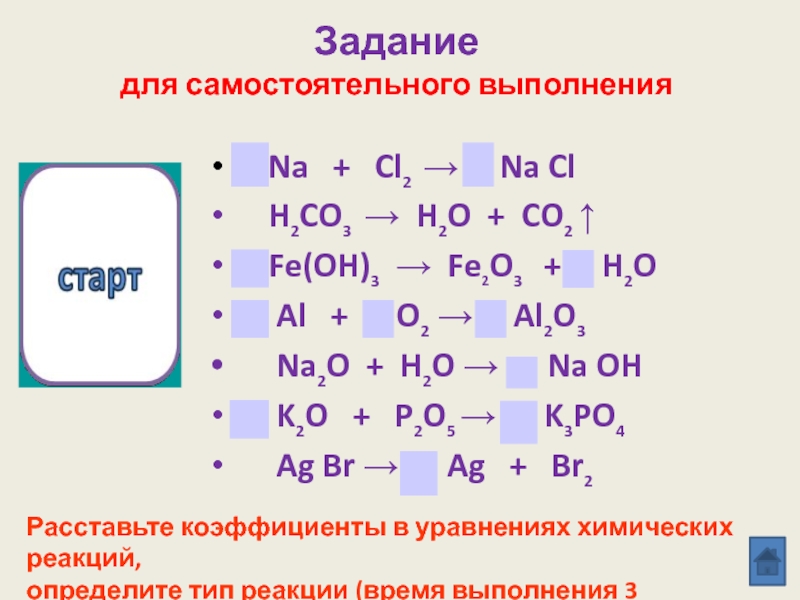
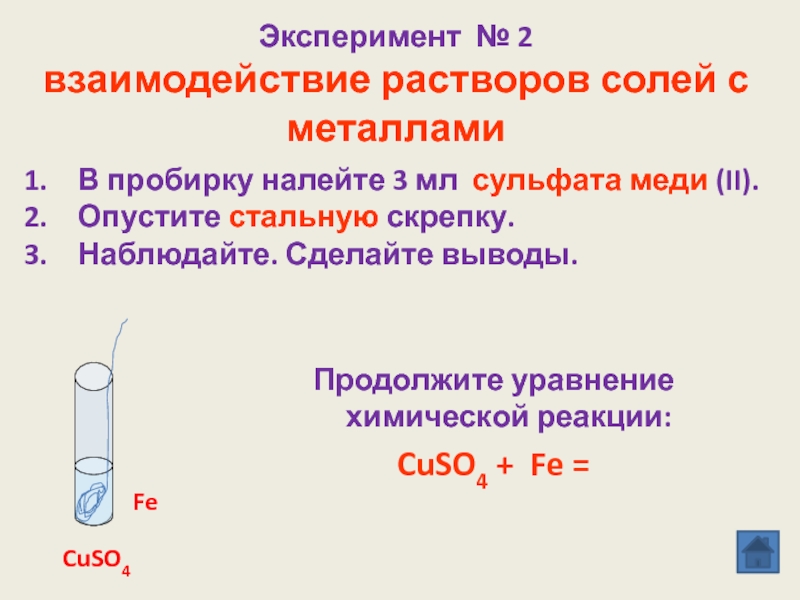
реакции замещения»
8 класс
Презентацию составила:
Дудорова Елена Васильевна
учитель химии
и биологии МБОУ «Торбеевская средняя общеобразовательная школа №3»