Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сера
Содержание
- 1. Сера
- 2. План:Общая характеристика Общая характеристика VI-Общая характеристика VI-а
- 3. S 2 8 6+16
- 4. Отдает электроныПринимает электроныВОССТАНОВИТЕЛЬвосстанавливаетсяОКИСЛИТЕЛЬокисляетсявосстановлениеокислениеСтепень окисления повышаетсяСтепень окисления понижается
- 5. Строение атомаНа внешнем электронном слое у атома
- 6. По отношению к металлам, водороду и менее
- 7. По отношению к фтору, кислороду, более электроотрицательным неметаллами, сложным веществам – сера является восстановителем Окислительно-востановительные свойства
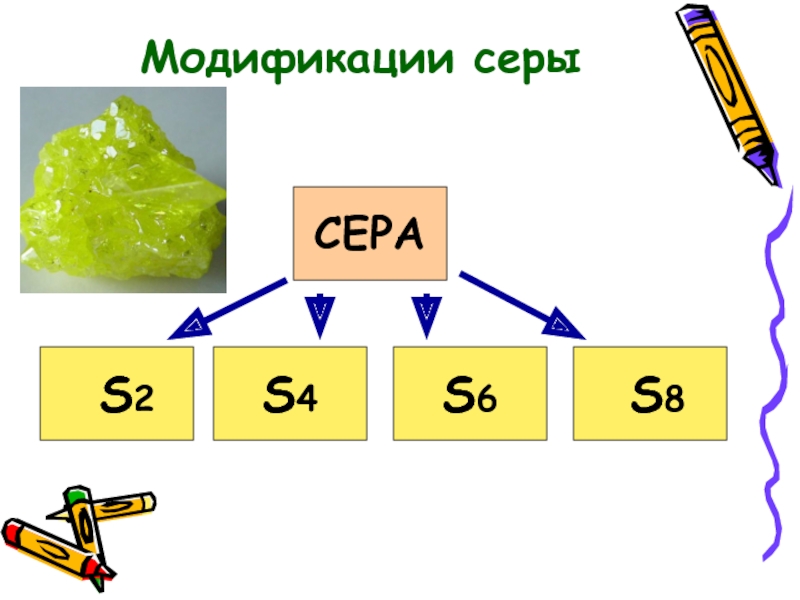
- 8. СЕРА S2 S8 S6 S4 Модификации серы
- 9. Слайд 9
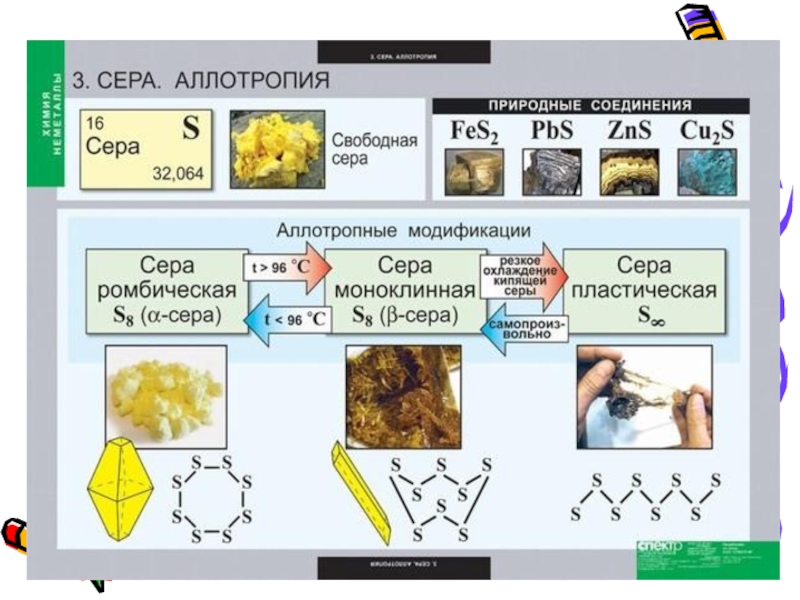
- 10. В обычных условиях это кристаллы так называемой ромбической модификации.Аллотропные модификации серы.
- 11. Известно несколько аллотропных модификаций серы. До температуры
- 12. Химическая связь – ковалентная неполярная2. Кристаллическая
- 13. В воде сера не растворяется (всплывает), растворима в органических растворителях. Физические свойства
- 14. При обычных условиях:Hg + S =HgSПроцесс ДЕМЕРКУРИЗАЦИИХимические свойства
- 15. Сера взаимодействует со многими металлами, образуя сульфиды:S
- 16. При нагревании сера реагирует с водородом, образуя сероводород:S + Н2 = H2SХимические свойства
- 17. Из неметаллов только азот и йод не
- 18. Элементарная сера может также проявлять восстановительные свойства:S + 2HNO3 = H2SO4 + 2NOХимические свойства
- 19. Слайд 19
- 20. Применение серы:
- 21. Домашнее задание: § 21 упр. 3
- 22. Интернет источники:http://media.memurlar.net/album/589/1c9c61d9-1ae2-e211-9ee7-14feb5cc13c9.jpg - сераhttp://kzdocs.docdat.com/pars_docs/refs/15/14854/14854_html_2bf65e3f.jpg - химический элемент сераhttp://everythingmaths.co.za/science/grade-10/12-the-particles-that-substances-are-made-of/images/eca278e55206d78105bdd5a0f38a4460.png -моноклинная сераhttp://www.uchkom43.ru/admin/uploads/2711280561.jpeg - сера. Аллотропияhttp://works.doklad.ru/images/uvSy1e5Fp44/m35153abe.png - применение серы
- 23. Скачать презентанцию
План:Общая характеристика Общая характеристика VI-Общая характеристика VI-а подгруппыСераСероводород и сульфидыОксиды серыОксид серы (Оксид серы (IV)Оксид серы (Оксид серы (VI)Сернистая кислотаСерная кислота
Слайды и текст этой презентации
Слайд 2План:
Общая характеристика Общая характеристика VI-Общая характеристика VI-а подгруппы
Сера
Сероводород и сульфиды
Оксиды
серы
кислотаСлайд 4Отдает электроны
Принимает электроны
ВОССТАНОВИТЕЛЬ
восстанавливается
ОКИСЛИТЕЛЬ
окисляется
восстановление
окисление
Степень окисления
повышается
Степень окисления
понижается
Слайд 5Строение атома
На внешнем электронном слое у атома серы шесть электронов.
Взаимодействуя
с менее электроотрицательными элементами сера может принимать 2 электрона, проявляя
степень окисления –2.Также сера способна отдавать электроны, проявляя степень окисления от +2 до +6,
Слайд 6По отношению к металлам, водороду и менее электроотрицательным неметаллам сера
является окислителем со степенью окисления -2.
Степень окисления
Слайд 7По отношению к фтору, кислороду, более электроотрицательным неметаллами, сложным веществам
– сера является восстановителем
Окислительно-востановительные свойства
Слайд 10В обычных условиях это кристаллы так называемой ромбической модификации.
Аллотропные модификации
серы.
Слайд 11Известно несколько аллотропных модификаций серы. До температуры 150°C молекула серы
имеет циклическую форму. Это кольцо из 8 атомов, соединенных в
виде короны.Аллотропные модификации серы.
Слайд 12Химическая связь –
ковалентная неполярная
2. Кристаллическая решетка –
молекулярная
Температуры плавления и кипения –
низкие
4.Летучие и непрочные
Слайд 13В воде сера не растворяется (всплывает), растворима в органических растворителях.
Физические свойства
Слайд 15Сера взаимодействует со многими металлами, образуя сульфиды:
S + Fe =
FeS
Ок-ль
2Al + 3S = Al2S3
Ок-льХимические свойства
Слайд 16При нагревании сера реагирует с водородом, образуя сероводород:
S + Н2
= H2S
Химические свойства
Слайд 17Из неметаллов только азот и йод не соединяются с серой.
Сжигание серы в струе кислорода приводит к образованию сернистого газа
или сернистого ангидрида SO2 :S + O2 = SO2
Химические свойства