Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы
Содержание
- 1. Щелочные металлы
- 2. Строение и свойства атомовЩелочные металлы – это
- 3. Электронно-графическая формула лития Li+3211s21s22s1ЭГФ:2s1
- 4. Электронно-графическая формула натрияNa+11281ЭГФ:1s21s22s2 2s2 2p62p63s13s1
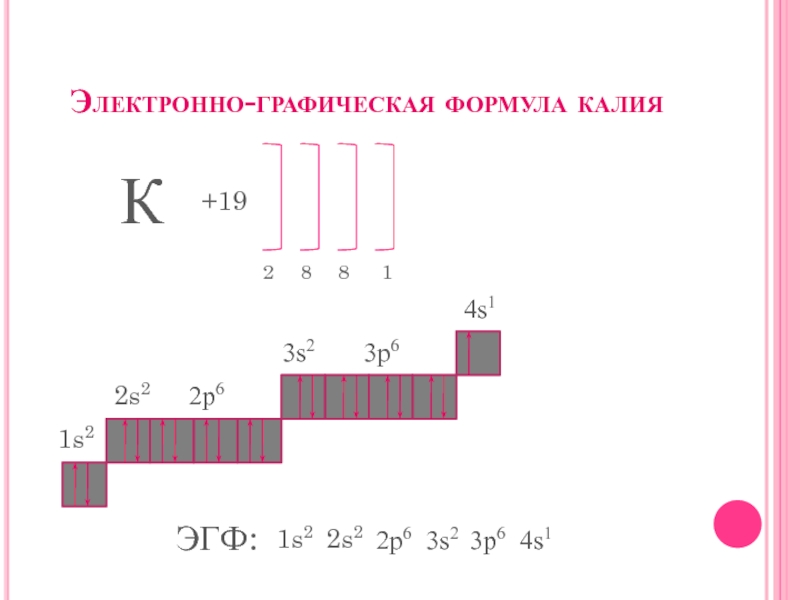
- 5. Электронно-графическая формула калияК+1928811s22s2 2p63s23p64s1ЭГФ:1s22s2 2p63s23p64s1
- 6. Характер простых веществ
- 7. ЛитийЛитий был открыт в 1817 году шведским
- 8. НатрийНатрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
- 9. КалийВ 1807 году английский химик Дэви электролизом
- 10. РубидийВ 1861 году немецкие учёные Роберт Вильгельм
- 11. ЦезийЦезий был открыт в 1860 году немецкими
- 12. ФранцийЭтот элемент был предсказан Д. И. Менделеевым
- 13. Химические свойстваУравнения реакций щелочных металлов с неметаллами
- 14. Химические свойстваПри взаимодействии с кислородом натрий образует
- 15. Химические свойстваВсе щелочные металлы активно взаимодействуют с
- 16. Соединения щелочных металлов ОксидыОксиды М2О – твердые
- 17. Соединения щелочных металлов ГидроксидыГидроксиды МОН – твердые
- 18. Соли щелочных металлов Карбонат натрия (Na2CO3)Карбонат натрия
- 19. Соли щелочных металлов Гидрокарбонат натрия (NaHCO3) Гидрокарбонат
- 20. Соли щелочных металлов Карбонат калия (K2CO3)Карбонат калия
- 21. Соли щелочных металлов Кристаллогидрат сульфата натрия (Na2So4*10H2O)Кристаллогидрат
- 22. Соединения щелочных металлов Хлорид натрия (NaCl)Хлорид натрия,
- 23. Применение калияКалий поддерживает работу сердечной мышцы, поэтому
- 24. Скачать презентанцию
Строение и свойства атомовЩелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д.И. Менделеева: литий(Li), натрий(Na), калий(K), рубидий(Rb), цезий(Cs), франций(Fr).На внешнем энергетическом уровне атомы этих элементов содержат
Слайды и текст этой презентации
Слайд 2Строение и свойства атомов
Щелочные металлы – это элементы главной подгруппы
I группы Периодической системы химических элементов Д.И. Менделеева: литий(Li), натрий(Na),
калий(K), рубидий(Rb), цезий(Cs), франций(Fr).На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
Слайд 7Литий
Литий был открыт в 1817 году шведским химиком и минералогом
А. Арфведсоном сначала в минерале петалите, а затем в сподумене
и в лепидолите. Металлический литий впервые получил Хамфри Дэви в 1825 году.Слайд 8Натрий
Натрий впервые был получен английским химиком Хемфри Дэви в 1807
году электролизом твердого NaOH.
Слайд 9Калий
В 1807 году английский химик Дэви электролизом твёрдого едкого кали
(KOH) выделил калий и назвал его «потассий». В 1809 году
Л. В. Гильберт предложил название «калий».Слайд 10Рубидий
В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав
Роберт Кирхгоф, изучая с помощью спектрального анализа природные алюмосиликаты, обнаружили
в них новый элемент, впоследствии названный рубидием по цвету наиболее сильных линий спектра.Слайд 11Цезий
Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и
Г. Р. Кирхгофом в водах Дюрхгеймского минерального источника в Германии
методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.Слайд 12Франций
Этот элемент был предсказан Д. И. Менделеевым (как Эка-цезий), и
был открыт (по его радиоактивности) в 1939 г. Маргаритой Перей,
сотрудницей Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции.Слайд 13Химические свойства
Уравнения реакций щелочных металлов с неметаллами – водородом и
серой:
2М+Н2= 2МН
0
0
t
+1
-1
2е
гидрид
2М+S= М2S
2е
0
0
t
+1
-2
сульфид
Слайд 14Химические свойства
При взаимодействии с кислородом натрий образует не оксид, а
пероксид:
2Na+O2 = Na2O2
0
0
2е
t
+1
-1
пероксид
И только литий образует оксид при взаимодействии с
кислородом:4Li+O2 = 2Li2O
0
0
+1
t
-2
2e
оксид лития
Слайд 15Химические свойства
Все щелочные металлы активно взаимодействуют с водой, образуя щелочи
и восстанавливая воду до водорода:
2М+2НОН = 2МОН+Н2
+1
+1
0
0
2е
Слайд 16Соединения щелочных металлов
Оксиды
Оксиды М2О – твердые вещества. Имеют ярко выраженные
основные свойства: взаимодействуют с водой, кислотами и кислотными оксидами. Оксиды
натрия Na2O и калия K2O получают, прокаливая пероксиды с соответствующими металлами, например:2Na + Na2O2 = 2Na2O
+1
2e
-2
t
-1
+1
0