Слайд 1Тема урока «Скорость химических реакций. Факторы, влияющие на скорость химической
реакции»
Цель: выясним, что есть скорость химической реакции, и от
каких факторов она зависит.
В ходе урока познакомимся с теорией вопроса по вышеназванной теме. На практике подтвердим некоторые наши теоретические предположения.
Слайд 2 Обсудим следующие вопросы:
Зачем нужны знания о скорости
химических реакций?
Какими примерами можно подтвердить то, что химические реакции протекают
с различными скоростями?
Как определяют скорость механического движения? Какова единица измерения этой скорости?
Как определяют скорость химической реакции?
Какие условия необходимо создать, чтобы началась химическая реакция?
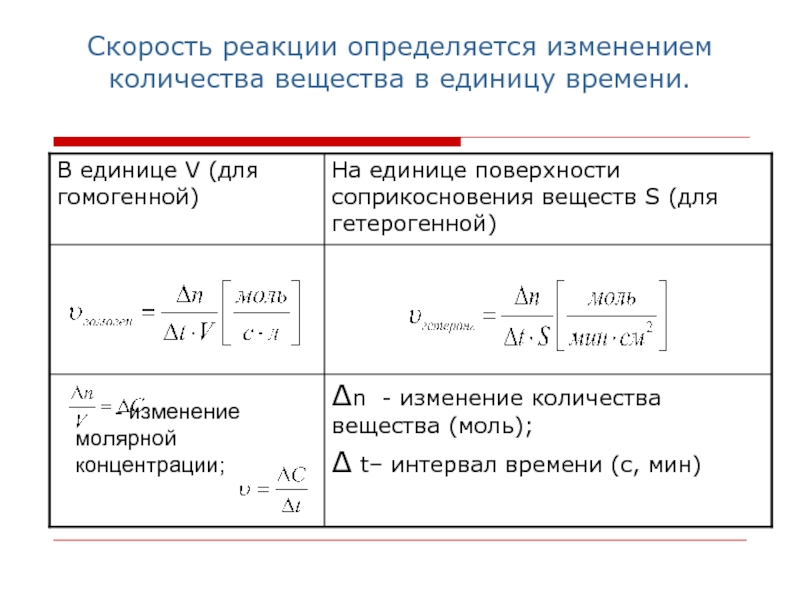
Слайд 3Скорость реакции определяется изменением количества вещества в единицу времени.
- изменение
молярной концентрации;
Слайд 4Анализ таблицы, выводы:
по приведённым формулам можно рассчитать лишь некоторую среднюю
скорость данной реакции в выбранном интервале времени (ведь для большинства
реакций скорость уменьшается по мере их протекания);
рассчитанная величина скорости будет зависеть от того, по какому веществу её определяют, а выбор последнего зависит от удобства и лёгкости измерения его количества.
Например, для реакции 2Н2 +О2 = 2Н2О:
v (по Н2) = 2v (по О2) = v (по Н2О)
Слайд 5Задача на применение знаний по «Скорости химических реакций»
Химическая реакция протекает
в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества
А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени;
б) концентрацию вещества В через 20 мин.
Слайд 7Факторы, влияющие на скорость химической реакции
природа реагирующих веществ;
температура;
концентрация реагирующих веществ;
действие
катализаторов;
поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Слайд 8Теория столкновений.
Основная идея теории: реакции происходят при столкновении частиц
реагентов, которые обладают определённой энергией.
Выводы:
Чем больше частиц реагентов, чем ближе
они друг к другу, тем больше шансов у них столкнуться и прореагировать.
К реакции приводят лишь эффективные соударения, т.е. такие при которых разрушаются или ослабляются «старые связи» и поэтому могут образоваться «новые». Но для этого частицы должны обладать достаточной энергией.
Минимальный избыток энергии (над средней энергией частиц в системе), необходимый для эффективного соударения частиц в системе), необходимый для эффективного соударения частиц реагентов, называется энергией активации Еа.
Слайд 91. Природа реагирующих веществ.
Под природой реагирующих веществ понимают их
состав, строение, взаимное влияние атомов в неорганических и органических веществах.
Величина
энергии активации веществ – это фактор, посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Слайд 10Задание на применение знаний
Объясните разную скорость взаимодействия цинка и магния
с уксусной кислотой; цинка с соляной и уксусной кислотой.
Напишите
соответствующие реакции (в протоколе).
Слайд 112. Температура
При увеличении температуры на каждые 10° С общее число
столкновений увеличивается только на ~ 1,6 %, а скорость реакции
увеличивается в 2-4 раза (на 100-300%).
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10° С, называют температурным коэффициентом.
Правило Вант-Гоффа математически выражается следующей формулой:
где –скорость реакции при температуре t2,
– скорость реакции при температуре t1,
– температурный коэффициент.
Слайд 12Задача на применение знаний:
Определите, как изменится скорость некоторой реакции:
а) при повышении температуры от 10° до 50° С;
б) при понижении температуры от 10° – 0° С.
Температурный коэффициент реакции равен 3.
Слайд 13Самопроверка
а) подставить данные задачи в формулу:
скорость реакции увеличится в 81
раз.
б)
Скорость реакции уменьшится в 3 раза.
Слайд 143. Концентрации реагирующих веществ.
На основе большого экспериментального материала в 1867
г. норвежские учёные К. Гульдберг, и П Вааге и независимо
от них в 1865 г. русский учёный Н.И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентраций реагирующих веществ:
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях равных их коэффициентам в уравнении реакции.
Этот закон ещё называют
законом действующих масс.
Слайд 15Математическое выражение
закона действующих масс.
По закону действующих масс скорость реакции,
уравнение которой А+В=С может быть вычислена по формуле:
v1= k1CACB,
а скорость реакции, уравнение которой А+2В=D, может быть вычислена по формуле:
v2= k2CACB.
В этих формулах: CA и CB – концентрации веществ А и В (моль/л), k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей реакции. Эти формулы также называют кинетическими уравнениями.
Слайд 16Задача на применение знаний:
1. Составьте кинетические уравнения для следующих реакций:
А) H2+I2=2HI;
Б) 2 Fe + 3CI2= 2
FeCI3.
2. Как изменится скорость реакции, имеющей кинетическое уравнение
v= kCA 2CB, если
А) концентрацию вещества А увеличить в 3 раза;
Б) концентрацию вещества А увеличить в 3 раза, а концентрацию В уменьшить в 3 раза?
Слайд 17Самопроверка.
Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций.
а)
скорость реакции увеличится в 9
раз.
б)
скорость реакции увеличится в 8 раз.
Слайд 184. Действие катализатора
Обсуждение вопросов:
1.Что такое катализатор и каталитические
реакции?
2. Приведите примеры известных вам каталитических реакций из органической и
неорганической химии. Укажите названия веществ – катализаторов.
3. Выскажите предположение о механизме действия катализаторов (на основе теории столкновений).
4. Каково значение каталитических реакций?
Слайд 195.Поверхность соприкосновения реагирующих веществ.
Скорость реакции увеличивается благодаря:
-увеличению площади
поверхности соприкосновения реагентов (измельчение);
-повышению реакционной способности частиц на поверхности
образующихся при измельчении микрокристаллов;
-непрерывному подводу реагентов и хорошему отводу продуктов с поверхности, где идёт реакция.
Фактор связан с гетерогенными реакциями, которые протекают на поверхности соприкосновения реагирующих веществ: газ - твердое вещество, газ - жидкость, жидкость - твердое вещество, жидкость - другая жидкость, твердое вещество - другое твердое вещество, при условии, что они не растворимы друг в друге.
Приведите примеры гетерогенных реакций.
Слайд 20Выводы по теме урока
Химические реакции протекают с различными скоростями. Величина
скорости реакции не зависит от объёма в гомогенной системе и
от площади соприкосновения реагентов – в гетерогенной.
На пути всех частиц, вступающих в химическую реакцию, имеется энергетический барьер, равный энергии активации Eа.
Скорость реакции зависит от факторов:
-природа реагирующих веществ;
-температура;
-концентрация реагирующих веществ;
- действие катализаторов;
-поверхность соприкосновения реагирующих веществ (в гетерогенных реакциях).
Слайд 21Выводы по теме урока
Величина энергии активации веществ – это фактор,
посредством которого сказывается влияние природы реагирующих веществ на скорость реакции.
Чем меньше энергия активации, тем больше эффективных соударений реагирующих частиц.
При увеличении температуры на 10º С общее число активных соударений увеличивается в 2-4 раза.
Чем больше концентрации реагентов, тем больше соударений реагирующих частиц, а среди них и эффективных соударений.
Катализатор изменяет механизм реакции и направляет её по энергетически более выгодному пути с меньшей энергией активации. Ингибитор замедляет ход реакции.
Гетерогенные реакции протекают на поверхности соприкосновения реагирующих веществ. Нарушение правильной структуры кристаллической решётки приводит к тому, что частицы на поверхности образующихся микрокристаллов значительно реакционноспособнее, чем те же частицы на «гладкой» поверхности.